-
实体肿瘤内存在乏氧细胞,约占10%~50%,它们大多处于细胞周期的G0期,增殖缓慢或不增殖,对射线有较强的抗拒性而使肿瘤更具有侵袭性。乏氧细胞的放射敏感性只有常氧细胞的1/3,在放疗中这部分细胞不易被杀死,从而降低了肿瘤的放射敏感性,导致放疗效果不理想,也成为肿瘤放疗后复发和转移的潜在隐患[1]。因此,在肿瘤放疗增敏的相关研究中,建立合适的乏氧细胞模型,是一项非常重要的工作。目前国内外建立乏氧细胞模型常用的方法有两种,一种是在细胞或组织的培养液中加入二氯化钴或铁的螯合剂,阻断氧信号的转导,模拟乏氧信号传给细胞,也称作细胞乏氧[2];另一种是在低氧的环境中培养肿瘤细胞或组织,即使用特殊的实验设备如“乏氧培养箱”,也称作环境乏氧[3]。本研究主要探讨二氯化钴与环境乏氧诱导人卵巢癌细胞株SKOV3乏氧的特点及更适合用于放疗增敏研究中乏氧细胞模型的建立方法。
HTML
-
人卵巢浆液性乳头状囊腺癌细胞株SKOV3购自武汉大学细胞典藏中心。
-
RPMI 1640培养基(美国Hyclone公司);胎牛血清(fetal bovine serum,FBS)(澳大利亚NQBB公司);胰蛋白酶(美国Amresco公司);噻唑蓝(中国Biosharp公司);二甲基亚砜(dimethylsulfoxide,DMSO)、二氯化钴(美国Sigma公司);厌氧产气袋、密封培养袋和氧气指示剂(日本三菱瓦斯化学株式会社)。
-
超净台(SW-CJ-1BU,苏净集团苏州安泰空气技术有限公司);倒置显微镜(日本Olympus CK2-TR);CO2培养箱(MCO-175,日本SANYO);医用直线加速器(瑞典ELECTA-Precise e1293);RT-6500酶标分析仪(中国深圳雷杜生命科学股份有限公司);数显恒温水浴箱(HH-S4,武汉奥普森实验设备有限公司);电子天平(梅托PL303,梅特勒·托利多仪器上海有限公司);微型离心机(Mini-6K,珠海黑马医学仪器有限公司)。
-
人卵巢癌SKOV3细胞用含10%FBS、60 U/ml双抗的RPMI 1640培养液,以105个/ml密度接种于培养瓶中,置于37 ℃、5% CO2、饱和湿度的恒温培养箱内常规培养,2~3 d传代1次。取对数生长期的细胞进行实验。
-
采用6 MeV X射线,剂量率200 cGy/min,皮靶距60 cm,照射野20 cm×20 cm。
-
取对数生长期的SKOV3细胞,以104个/孔的密度接种于96孔培养板中,每孔100 μl,培养24 h待细胞贴壁后弃去原培养液,然后加入含不同浓度的二氯化钴培养液,分为50、100、150、200、250 μmol/L共5个浓度组,同时设不加二氯化钴的正常对照组和不接种细胞的空白对照组,每组各取24、48、72、96 h 4个时间点检测,每浓度各时间点设6个平行孔,到达时间点后,每孔加入5 mg/ml的噻唑蓝溶液10 μl,于37 ℃、5% CO2培养箱内继续培养4 h后,弃去各孔噻唑蓝,加入DMSO 150 μl,振摇培养板3~5 min,用酶标仪在492 nm处测定各孔吸光度(OD)值,计算细胞存活率:
细胞存活率(%)=(实验组OD值-空白对照组OD值)/(正常对照组OD值-空白对照组OD值)×100%。
-
取对数生长期的SKOV3细胞,以104个/孔的密度接种于96孔培养板中,每孔100 μl,分为常氧对照组和环境乏氧组,每组重复接种4块96孔培养板,每块培养板上同时设不接种细胞的空白对照组,培养24 h待细胞贴壁后弃去原培养液,更换新鲜培养液,环境乏氧组置于装有厌氧产气袋和氧气指示剂的密封培养袋中,各组均于37 ℃、5% CO2培养箱内培养,每组各取24、48、72、96 h 4个时间点检测,到达时间点后,按照第1.6小节中噻唑蓝法测定各孔OD值,计算细胞存活率。
-
取对数生长期的SKOV3细胞,以104个/孔的密度接种于96孔培养板中,每孔100 μl,分为常氧对照组、二氯化钴组和环境乏氧组,每组重复接种5块96孔培养板,培养24 h待细胞贴壁后弃去原培养液,常氧对照组和环境乏氧组更换新鲜培养液,二氯化钴组加入含100 μmol/L二氯化钴的培养液,环境乏氧组放入密封培养袋中,每块培养板上同时设不接种细胞的空白对照组,各处理组于37 ℃、5% CO2培养箱内培养24 h后,分别接受0、2、4、6、8 Gy的X射线单次照射,继续培养72 h。到达时间点后,按照第1.6小节中噻唑蓝法测定各孔OD值,计算细胞存活率。
-
采用SPSS 19.0软件进行统计学处理,数据均以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验。P<0.05表示差异有统计学意义。
1.1. 实验细胞
1.2. 主要试剂
1.3. 主要仪器
1.4. 细胞培养
1.5. 照射条件
1.6. 二氯化钴对SKOV3细胞的毒性作用
1.7. 环境乏氧对SKOV3细胞的增殖抑制作用
1.8. 乏氧SKOV3细胞的放射敏感性
1.9. 统计学分析
-
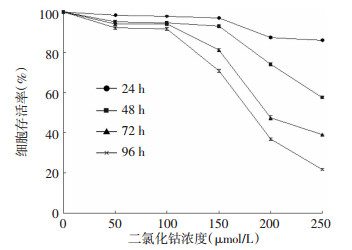
不同浓度的二氯化钴作用不同时间点对SKOV3细胞的毒性作用如图 1所示。与正常对照组比较,相同时间内,50、100、150、200、250 μmol/L二氯化钴对SKOV3细胞的增殖具有抑制作用,并随二氯化钴的浓度增加,其抑制作用增强;相同浓度的二氯化钴作用24、48、72、96 h后,各时间点的细胞存活率差异均有统计学意义(50 μmol/L:F=102.555;100 μmol/L:F=168.357;150 μmol/L:F=2174.232;200 μmol/L:F=5620.296;250 μmol/L:F=23 076.373,P均<0.05),且作用时间越长,对SKOV3细胞的增殖抑制作用越强。100、150 μmol/L二氯化钴作用96 h后,SKOV3细胞的存活率分别为91.55%和70.79%,可见,150、200、250 μmol/L二氯化钴对SKOV3细胞产生了较强的毒性,因此选择100 μmol/L二氯化钴作为后续建立乏氧细胞模型的适宜浓度。
-
由表 1各时间点的OD值可以看出,常氧对照组的细胞随培养时间的延长不断增殖(F=16 724.300,P<0.01),而环境乏氧组各时间点之间无显著性变化(F=1.202,P>0.05),即细胞在乏氧环境下,未出现明显的细胞增殖;相同时间点内,常氧对照组与环境乏氧组间差异均有统计学意义,前者的细胞增殖率远高于环境乏氧组。
组别 OD值 24 h 48 h 72 h 96 h 常氧对照组 0.3577±0.0054 0.4785±0.0034 0.6945±0.0070 0.9568±0.0033 环境乏氧组 0.2485±0.0035 0.2460±0.0064 0.2439±0.0052 0.2502±0.0082 t值 40.436 78.924 126.748 196.960 P值 <0.01 <0.01 <0.01 <0.01 Table 1. The optical density of different groups at different times
(x±s, n=6) -
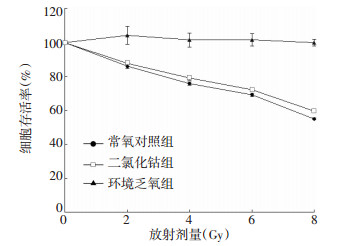
如图 2所示,与同组未照射细胞相比,常氧对照组与二氯化钴组接受2、4、6、8 Gy的X射线单次照射后,其细胞存活率均显著下降(F=2263.039、3672.044,P<0.01),且放射剂量越大,其细胞存活率越低,而环境乏氧组无显著性变化(F=1.412,P>0.05);与常氧对照组的同剂量照射细胞相比,除了2 Gy无显著性差异外(F=61.125,P>0.05),二氯化钴组其余各照射剂量下细胞存活率均升高(4 Gy:F=181.825;6 Gy:F=373.830;8 Gy:F=2425.510,P均<0.05),而与常氧对照组、二氯化钴组的同剂量照射细胞相比,环境乏氧组细胞存活率均显著升高(2 Gy:F=61.125;4 Gy:F=181.825;6 Gy:F=373.830;8 Gy:F=2425.510,P均<0.01)。
2.1. 二氯化钴对SKOV3细胞的毒性作用
2.2. 环境乏氧对SKOV3细胞的增殖抑制作用
2.3. 乏氧SKOV3细胞的放射敏感性
-
二氯化钴是一种广泛应用于模拟体外乏氧环境的化学试剂,其诱导细胞乏氧属于化学方法,在体外诱导细胞乏氧研究中常用的是结晶水形态六水合氯化钴,二氯化钴体外模拟细胞乏氧环境的机制与二价钴离子可诱导细胞中乏氧诱导因子及其调控基因的表达有关[4]。国内外文献报道,二氯化钴的最终浓度约为100 μmol/L,即可建立乏氧模型[5]。
本研究证实,100 μmol/L二氯化钴作用于SKOV3细胞24~96 h,对其细胞增殖有轻度的抑制作用,但当二氯化钴浓度超过100 μmol/L时,细胞毒性会逐渐增加,结合文献报道,因此选择100 μmol/L作为二氯化钴建立乏氧细胞模型的适宜浓度。但是,在检测乏氧SKOV3细胞的放射敏感性时,二氯化钴组在接受不同剂量X射线照射后的细胞存活率仅比常氧对照组高1.71%~4.60%,表明二氯化钴建立的乏氧SKOV3细胞模型的放射敏感性仍较高,未达到实验研究的要求,考虑到二氯化钴对不同肿瘤细胞所诱导的化学乏氧效果以及其本身的毒性作用,且氧分压或氧含量也无法在体外细胞中检测,因此体外的二氯化钴化学乏氧模型不能较好地模拟体内的乏氧微环境。
环境乏氧方法属于一种物理方法,一般是采用特殊的可调式培养箱、厌氧培养箱或自制的“乏氧培养箱”,均向箱内通入低氧气体[3],但是由于可调式培养箱和厌氧培养箱的价格昂贵,而自制的“乏氧培养箱”内的混合气体比例、温度等又难以掌握,且低氧气体与培养液平衡时间难以界定等问题限制了其在实验中的应用。本实验中采用了一种新型、简便且价廉的“乏氧培养装置”(包括厌氧产气袋、密封培养袋和氧气指示剂)。在实验中,将细胞培养板、厌氧产气袋和氧气指示剂同时放于密封培养袋中,再放置于常规细胞培养箱中,密封袋内的氧气在0.5~1 h内可以被厌氧产气袋完全吸收,同时可以根据氧气指示剂的颜色变化观察密封培养袋内的氧气浓度。本研究中环境乏氧法的氧含量始终维持在小于0.1%,与实体肿瘤细胞的乏氧环境较一致。
本研究中采用的特殊“乏氧培养装置”所建立的乏氧SKOV3细胞,其在乏氧环境中几乎不增殖,与实体肿瘤内的乏氧细胞状态吻合,在乏氧细胞放射敏感性的检测中,其对X射线产生了强烈的抵抗性,不同剂量的X射线对其几乎无影响,表明环境乏氧组的细胞放射敏感性显著低于常氧对照组和二氯化钴组,即环境乏氧法所建立的乏氧细胞模型的乏氧效果较二氯化钴法更明显,更适合用于放疗增敏研究。
二氯化钴诱导的化学乏氧与环境乏氧诱导的物理乏氧对细胞生长的影响以及乏氧机制均有一定的区别,且两者所模拟的乏氧不可能与生理性乏氧完全吻合,但对于体外乏氧细胞模型的建立方法,特别是SKOV3细胞在放疗增敏研究中的乏氧细胞模型,本研究中所采用的新型“乏氧培养装置”是一种比较合适的方法。









 DownLoad:
DownLoad: