-
p16基因是一种抑癌基因,近年来发现它在细胞衰老过程中发挥重要作用。p16是细胞周期蛋白依赖性激酶(cyclin dependent protein kinase,CDK)4和CDK6的抑制物,p16通过与CDK4和CDK6结合,阻滞CDK4、CDK6与cyclinD结合,抑制cyclinD-CDK复合物的活性,阻断对Rb蛋白(一种核磷酸蛋白)的磷酸化,使细胞停滞在G0期,不能进入细胞周期循环而处于静息状态[1-2]。p16在许多细胞进入衰老时均过度表达,其持续表达导致了细胞衰老。目前,p16已成为细胞衰老研究的热门靶点之一。RNA干扰是转录后水平序列特异性的抑制基因表达的一种天然机制。在本研究中我们构建了RNA干扰载体,并将表达载体成功地转染至辐射诱导衰老的小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)中,观察其对p16的干扰效果,旨在为后续p16相关研究提供实验基础。
HTML
-
表达载体pcDNATM6.2-GW/EmGFPmiR、BLOCK-iTTM Pol Ⅱ miR RNAi Expression Vector Kit with EmGFP、脂质体LipofeetamineTM2000和Trizol购自美国Invitrogen公司; DH5α感受态细胞购自德国TIANGEN公司; T4 DNA连接酶购自美国Promega公司; 实时荧光定量PCR试剂盒和ABI Prism 7500 Sequence Detection System购自美国ABI公司; 质粒提取试剂盒购自德国QIAGEN公司; Turbo Script逆转录第一链cDNA合成试剂盒购自北京原平皓生物技术有限公司; Radio Immunoprecipitation Assay裂解液购自美国Pierce公司; bicinchoninic acid试剂盒购自上海碧云天生物技术有限公司; 兔抗小鼠p16、兔抗小鼠β-actin一抗和山羊抗兔二抗购自美国Santa Cruz Biotechnology公司; Senescence β-Galactosidase Staining Kit购自美国Cell Signaling technology公司。MEF细胞由本实验室保存。其他试剂均为国产或进口分析纯试剂。ChemiDocTM XRS+成像系统购自美国BIO-RAD公司; 137Cs γ射线照射源由加拿大原子能有限公司生产,型号为Autocell40,剂量率0.80 Gy/min; eclipse 90i荧光显微镜购自日本Nikon公司。
-
以小鼠p16基因(NM_009877)作为目的基因,应用Invitrogen公司提供的辅助设计软件(Block-iT RNAi Designer)设计siRNA。miRNA-155是目前剪切位点研究较为清楚的天然miRNA[3],本研究选择miRNA-155作为骨架,结合线性化pcDNATM6.2-GW/EmGFPmiR真核表达载体的特点,选择符合条件的靶位点,设计两段互补的寡核苷酸序列,每对寡核苷酸的核心序列反向互补,并将备选序列和相应的基因数据库进行Blast同源比对,排除与p16基因高度同源的序列。设计好的序列(表 1)由上海英骏生物技术有限公司合成。
引物名称 序列 mp16-1F 5'-TGCTGTTAGCTCTGCTCTTGGGATTGGTTTTGG-CCACTGACTGACCAATCCCAAGCAGAGCTAA-3' mp16-1R 5'-CCTGTTAGCTCTGCTTGGGATTGGTCAGTCAGT-GGCCAAAACCAATCCCAAGAGCAGAGCTAAC-3' mp16-2F 5'-TGCTGAGCTGAAGCTATGCCCGTCGGGTTTTGG-CCACTGACTGACCCGACGGGTAGCTTCAGCT-3' mp16-2R 5'-CCTGAGCTGAAGCTACCCGTCGGGTCAGTCAG-TGGCCAAAACCCGACGGGCATAGCTTCAGCTC-3' Table 1. Sequences of siRNA template oligonucleotides
将2对合成好的oligo用灭菌双蒸水溶解成100 μmol/L双蒸水,互补单链各取5 μl两两混合,加入2 μmol/L 10×退火缓冲液和8 μl灭菌双蒸水,95 ℃加热5 min,然后放置室温自然冷却20 min,形成双链oligo。取1 μl退火产物,继续稀释成10 nmol/L浓度。在无菌离心管中,依次加入4 μl 5×连接缓冲液、9 μl灭菌双蒸水、2 μl pcDNA6.2-GW/EmGFPmiR质粒、4 μl 10 nmol/L ds oligo、1 μl 1U/μl T4 DNA连接酶,充分混匀后室温连接30 min。取2 μl上述重组体转化DH5α感受态细胞,在含50 μg/ml壮观霉素的Luria-Bertani琼脂板上培养16 h,挑选阳性克隆摇菌过夜。利用试剂盒提取质粒,送上海英骏公司测序,以验证重组克隆中插入片段序列是否与设计的oligo序列一致。
-
将生长状态良好的MEF细胞按照每孔1×105个细胞接种于六孔板中,H-DMEM培养液(含10%胎牛血清、100 U/ml青霉素和100 U/ml链霉素)在37 ℃、5% CO2培养箱内培养,待细胞生长融合至80%左右,用10.0 Gy 137Cs γ射线照射细胞[4]。照射后,采用脂质体LipofeetamineTM2000进行质粒转染细胞。具体转染操作根据脂质体转染说明书进行。每孔细胞分别加入2 μg质粒和5 μl脂质体,转染4 h更换含10%胎牛血清的无抗生素H-DMEM培养液,继续培养。
实验分组:对照组(不做任何处理)、照射组(接受10.0 Gy 137Cs γ射线照射)、照射+p16 siRNA-1组、照射+p16 siRNA-2组(接受10.0 Gy 137Cs γ射线照射后分别转染p16基因特异性siRNA-1和siRNA-2)、照射+空载组(接受10.0 Gy 137Cs γ射线照射后转染空载对照siRNA)。
-
细胞转染后24 h,收集细胞,用Trizol法提取细胞的总RNA。取少量用于RNA含量及纯度测定。总RNA按照Turbo Script逆转录第一链cDNA合成试剂盒进行cDNA第一链的合成。cDNA反转录反应体系为20 μl,反应条件为65 ℃ 5 min,42 ℃ 50 min,70 ℃15 min; 用实时荧光定量探针法检测样品中成熟mRNA分子的水平,实时荧光定量PCR反应体系为25 μl,反应条件为50 ℃2 min,95 ℃10 min,(95 ℃ 15 s,60 ℃ 1 s)×40循环。每个样本重复测量3次。以甘油醛-3-磷酸脱氢酶的表达量为参照标准,按照2-ΔΔt计算p16 mRNA相对表达量。
-
收集转染后24 h的细胞,用PBS洗涤2遍,细胞总蛋白抽提液提取总蛋白,并采用BCA法检测样品中蛋白的含量。取20 μg混合蛋白上样缓冲液,在100 ℃下加热10 min,采用15%的十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳分离,电泳后转至聚偏二氟乙烯膜。转膜结束后室温封闭1 h,加入兔抗小鼠p16抗体4 ℃过夜,洗膜后加入相对应的二抗室温孵育1 h,洗膜,最后加化学发光显色试剂,在ChemiDocTM XRS+成像系统中成像。另外,采用抗β-actin多克隆抗体检测β-actin蛋白表达作为样品内参以及转膜的效果。
-
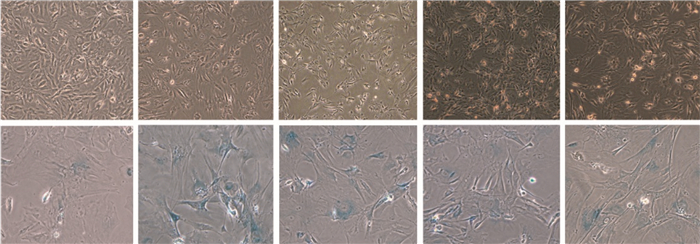
细胞转染后5 d,将24孔板中的细胞用PBS洗涤2遍,在室温下用1×定影液固定细胞10~15 min,用PBS洗涤2遍,加入1 ml染色混合液,37 ℃下过夜,具体操作步骤按照SA-β-Gal检测试剂盒说明书进行。衰老细胞染成蓝色为阳性细胞,光镜下观察并拍照,同时计算每200个细胞中阳性细胞的百分率[5]。
-
实验结果以均数±标准差(x±s)表示,数据分析采用t检验,P<0.05为差异有统计学意义。
1.1. 试剂与仪器
1.2. 载体构建
1.3. 细胞培养、转染及分组
1.4. 实时荧光定量PCR检测RNA干扰后p16基因mRNA表达水平的变化
1.5. Western blot检测RNA干扰后p16基因mRNA表达水平的变化
1.6. 衰老相关β-半乳糖苷酶(senescence associated-β-galactosidase,SA-β-Gal)活性的检测
1.7. 统计学处理
-
测序分析证明重组体中插入片段的碱基序列完整,没有碱基的突变以及丢失,表明已成功构建了针对鼠p16基因的p16 siRNA-1和p16 siRNA-2表达质粒。
-
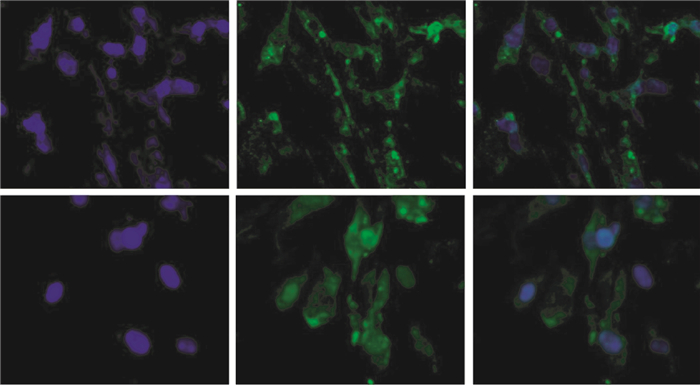
pcDNATM 6.2-GW/EmGFPmiR质粒带有绿色荧光蛋白基因,转染细胞24 h后,通过荧光显微镜观察绿色荧光,显示辐射诱导衰老MEF细胞在转染后有绿色荧光蛋白表达,说明转染成功(图 1)。
-
由图 2可见,经10 Gy137Cs γ射线照射后24 h,照射组小鼠胚胎成纤维细胞p16的mRNA相对表达水平较对照组升高,两者间的差异有统计学意义(t=87.60,P<0.05); 照射+空载组与对照组比较,p16的mRNA相对表达水平升高(t=85.32,P<0.05); 辐射诱导衰老的MEF细胞RNA干扰后24 h,与照射组比较,照射+p16 siRNA-1和照射+p16 siRNA-2组p16的mRNA水平显著降低(t=16.52、16.13,P均<0.05)。
-
与照射组比较,照射+p16 siRNA-1和照射+p16 siRNA-2组的p16蛋白表达水平有所降低,而照射+空载组的p16蛋白表达水平与照射组相比则无显著差别(图 3)。
-
SA-β-Gal染色后衰老细胞呈阳性,胞质内可见蓝色颗粒; 阴性细胞未着色。结果表明,照射组和照射+空载组的SA-β-Gal染色阳性细胞百分比显著高于对照组(t=72.91、72.73,P均<0.01); 照射+p16 siRNA-1和照射+p16 siRNA-2组SA-β-Gal染色阳性细胞百分比与对照组(t=35.19、34.92,P均<0.01)和照射组(t=37.72、38.09,P均<0.01)比较,差异均有统计学意义(图 4、表 2)。

Figure 4. Representative images of mouse embryonic fibroblast cells senescence associated-β-galactosidase activity in different group
组别 SA-β-Gal阳性细胞百分比(%) 对照组 1.83±0.76 照射组 68.83±1.26 照射+空载组 68.67±1.76 照射+p16 siRNA-1组 34.17±2.08 照射+p16 siRNA-2组 33.83±1.75 注:表中,SA-β-Gal:衰老相关β-半乳糖苷酶。 Table 2. The percentage of mouse embryonic fibroblast cells senescence associated-β-galactosidase positive cells in different group
(n=3, x±s)
2.1. 重组质粒测序结果
2.2. 干扰质粒转染MEF细胞
2.3. p16基因mRNA表达水平的变化
2.4. p16基因蛋白表达水平的变化
2.5. SA-β-Gal活性的变化
-
本研究设计并构建了小鼠p16的RNA干扰载体,经测序证实了所构建表达载体的正确性,而后通过脂质体介导的质粒转染,通过观察到目的细胞MEF中绿色荧光蛋白的表达,说明所构建的重组体能够有效地转染到目的细胞。
已有大量研究证实,电离辐射可以引起DNA损伤,最终导致细胞衰老[6-7]。本研究采用我们前期建立的10.0 Gy 137Cs γ射线照射诱导的小鼠胚胎成纤维细胞衰老模型[4, 8],经实时荧光定量PCR和Western blot检测表明:2个RNA干扰载体都能使靶基因p16的mRNA和蛋白表达水平降低,而照射+空载组的p16 mRNA和蛋白表达水平与照射组比较则无显著差异,这提示2个siRNA干扰载体在转染目的细胞辐射诱导衰老的MEF细胞后都有干扰p16基因表达的作用。
Dimri等[5]1995年首次提出一种鉴定细胞衰老的标志酶SA-β-Gal,他们的研究发现,衰老成纤维细胞和角质形成细胞均表达此酶,而休眠细胞和终末分化细胞则缺乏。因此,目前将SA-β-Gal染色作为细胞衰老的生物学标志[2]。p16在许多细胞进入衰老时均过度表达,其持续表达导致了细胞衰老。在本研究中,通过脂质体介导的质粒转染组SA-β-Gal染色阳性细胞百分比较照射组明显降低,说明转染后p16表达降低,衰老在一定程度上被抑制。
本研究初步探讨了RNA干扰沉默p16基因表达可以抑制MEF细胞的衰老,为后续相关研究提供了实验基础。










 DownLoad:
DownLoad: