-
特发性肺间质纤维化(idiopathic pulmonary fibrosis,IPF)是指原因不明的以肺实质炎症(肺泡炎)和进行性肺间质纤维化为特征的肺病。近些年,IPF的发病率逐渐增高,病程进展快速,大多数IPF没有有效的治疗方法,预后差。高分辨率CT(high resolution CT,HRCT)是目前最常用的诊断和监测检查手段(阳性预测值为96%),现用的临床指南指出大多数IPF根据典型HRCT表现并结合临床和实验室检查可以确诊,少数不典型病例除外[1]。PET/CT作为一种放射性示踪剂显像检查广泛应用于肿瘤、心血管及神经等方面疾病,在炎性疾病中的应用也逐年增加。近期已有很多PET/CT应用于IPF的研究报道,发现HRCT表现异常的区域在PET上表现为放射性摄取增高[2-6],那么HRCT上未见异常的区域18F-FDG摄取有无异常?本研究测量IPF患者HRCT表现正常区域的PET图像18F-FDG摄取值,与没有肺部疾病患者的18F-FDG摄取值进行比较,旨在表明PET/CT在IPF诊断及治疗监测方面的优势。
-
选取在本院接受PET/CT检查的有完整资料的IPF患者27例(IPF组),其中男性21例,女性6例,年龄47~93(63±11)岁,按照IPF的临床诊断标准[1],患者均经临床医师及影像科医师排除其他已知病因引起的弥漫性间质性肺疾病,且HRCT呈现寻常型间质性肺炎表现,所有患者均无肺内的其他病变,如肺炎、肺癌等,无合并自身免疫性疾病或其他严重躯体性疾病史。
随机选取本院健康体检者27例(正常对照组),其中男性19例,女性8例,年龄44~85(60±10)岁,患者HRCT所示均无肺气肿、肺炎、肺间质疾病、肺癌等肺内病变,无合并自身免疫性疾病或其他严重疾病史,患者临床资料完整。两组患者在性别比例及年龄上的比较差异均无统计学意义(P > 0.05)。
-
显像剂18F-FDG由日本住友公司的回旋加速器生产并通过自动合成模块自动合成,放化纯度>95%。采用美国GE Discovery VCT,其中CT为64层螺旋CT扫描仪。所有患者在检查前测量身高、体重及血糖,禁食6 h以上,休息15 min,饮水300~500 mL,按体重静脉注射18F-FDG 5.55 MBq/kg,在安静温暖的室内休息40~60 min,嘱患者排空尿液并饮水300 mL,以充盈胃肠道。患者平卧于检查床上,平静呼吸,双肘举于颞顶上方,首先行CT扫描,扫描范围为下颌至股骨上端,扫描参数:管电压120 kV,管电流110 mAs,层厚5 mm,层距5 mm;再行PET全身断层显像,每个床位采集1.5 min,共采集6~7个床位。对每例患者行深吸气屏气CT扫描,扫描参数:管电压120 kV,管电流180 mAs,层厚5 mm,层距5 mm,重建薄层CT,重建层厚为1.25 mm。再嘱患者将双手置于腹部,对颅脑行CT及PET检查,CT参数同体部扫描,PET每个床位采集3 min,共采集1个床位。采集完成后利用CT数据对PET图像进行衰减校正,在Xeleris工作站上数据经迭代法重建后进行融合,分别得到冠状面、矢状面、横断面断层图像。
-
由2名有3年以上工作经验的放射科医师和核医学科医师阅片,记录IPF组每例患者的HRCT表现,根据IPF诊断标准,规定病变区域为HRCT上表现为磨玻璃密度影、网格影及蜂窝影等的区域,非病变区域为肉眼可观察到的密度低于病变区的最小密度区。结合HRCT,测量IPF组病变区域的SUVmax。在IPF组非病变区域肺部HRCT横断面图像上画取3个ROI,对照组HRCT横断面图像上画取1个ROI,ROI的直径约为14 mm的圆形区域,选定在肺叶的中央以减小轴向呼吸运动的影响,同时避开主要的血管及气管,测量该ROI上下连续3个层面的CT值并取平均值。因HRCT为患者深吸气屏气扫描,PET/CT为患者平静呼吸状态下扫描,因此图像不能完全匹配,本研究根据典型的解剖结构如主动脉弓、气管隆突等将二者匹配起来,在PET/CT图像相应位置画取ROI,测定其SUVmax及平均标准化摄取值(mean standard uptake value,SUVmean),将ROI复制到纵隔内主动脉弓血池,计算与纵隔大血管主动脉弓血池(SUVmax、SUVmean)比值:肺组织/纵隔血池最大摄取比(lung tissue SUVmax /mediastinal blood pool SUVmax,LT/MBmax)和肺组织/纵隔血池平均摄取比(lung tissue SUVmean /mediastinal blood pool SUVmean,LT/MBmean),以校正由于个体差异对显像剂摄取的影响。
-
采用SPSS 19.0软件进行统计学分析。计量数据以均数±标准差(x±s)表示,如果数据为正态分布且方差齐,采用t检验;如果不符合正态分布,采用秩和检验,P < 0.05为差异有统计学意义。
-
IPF组27例患者,其中肺部表现为磨玻璃密度影14例、网格影27例、蜂窝影13例,同一患者可有多种表现,以上表现均为放射性摄取增高,SUVmax值为2.32±1.10(图 1)。IPF组非病变区和对照组ROI的SUVmax、LT/MBmax、SUVmean、LT/MBmean及CT值见表 1,表内数据来自正态分布总体。IPF组非病变区域LT/MBmax(0.44±0.55 vs. 0.32±0.05),和LT/MBmean(0.55±0.38 vs. 0.33±0.05)均高于对照组(t=5.87和2.89,P均 < 0.05);但两组CT值(-836.59±32.33 vs. -837.99±29.90)比较,差异无统计学意义(t=-0.15,P > 0.05)(图 2)。
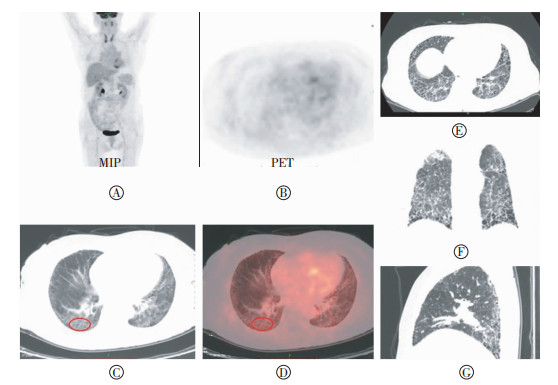
图 1 特发性肺间质纤维化患者18F-FDG PET/CT和高分辨率CT图 患者男性,68岁,图中,A:最大密度投影重建(MIP)图;B~D:分别为PET、CT和PET/CT显像图,图中显示双肺多发磨玻璃密度影及网格影,部分形成蜂窝影,以胸膜下较显著,相应病变区域可见18F-FDG代谢增高;E~G:高分辨率CT横断面、冠状面、矢状面图。结合HRCT在PET/CT图像病变区域画取ROI(红色圆圈),测量该ROI的SUVmax(SUVmax:5.004)。
Figure 1. 18F-FDG PET/CT and high resolution CT images of idiopathic pulmonary fibrosis patients
分组 SUVmax LT/MBmax SUVmean LT/MBmean CT值/HU IPF组非病变区 0.68±0.20 0.44±0.55 0.51±0.27 0.55±0.38 -836.59±32.33 正常对照组 0.42±0.06 0.32±0.05 0.34±0.06 0.33±0.05 -837.99±29.90 表 1 IPF组非病变区和对照组的ROI SUVmax、LT/MBmax、SUVmean、LT/MBmean与CT值的比较(x±s)
Table 1. Comparation the value of ROI SUVmax、LT/MBmax、SUVmean、LT/MBmean and CT between abnormal regions of IPF patients and control population(x±s)

图 2 特发性肺间质纤维化患者18F-FDG PET/CT和高分辨率CT图 患者男性,57岁,图中,A:最大密度投影重建(MIP)图;B~D:分别为PET、CT和PET/CT显像图,图中显示双肺胸膜下区磨玻璃密度影及网格影,相应病变区域可见18F-FDG代谢增高;E~F:高分辨率CT图,示双肺胸膜下区磨玻璃密度影及网格影。根据高分辨率CT在非病变区域画取ROI(红色圆圈),测量该ROI的CT值(E:-843.108,F:-841.307),在PET/CT相对应区域画取ROI,测量该ROI的SUVmax、SUVmean(SUVmax:0.560,SUVmean:0.509)。SUVmean:平均标准化摄取值。
Figure 2. 18F-FDG PET/CT and high resolution CT images of idiopathic pulmonary fibrosis patients
-
IPF的发病机制尚不明确,也没有明确的治疗方案。HRCT是目前诊断IPF最常用的影像学检查方法,然而HRCT仅能够提供结构异常等解剖学信息,提供的信息有限。PET/CT作为影像学显像技术,将放射性核素注入体内,探测放射性核素在体内的分布,可同时提供功能信息和解剖信息。
Takimoto等[2]研究发现IPF能引起18F-FDG摄取。Meissner等[3]对7例IPF患者进行18F-FDG PET检查,其中6例结果为阳性,结果证实18F-FDG PET检查对IPF患者的诊断价值。Groves等[4]应用PET/CT证实18F-FDG的摄取增高区域与CT上肺纤维化典型表现改变的区域是一致的。
本研究结果显示,IPF组27例患者中,肺部表现为磨玻璃密度影14例、网格影27例、蜂窝影13例,均表现为放射性摄取增高。HRCT上磨玻璃密度影区域有18F-FDG摄取增高,结果表明可能与炎症有关,包括肺在内的多个器官中的急性炎性细胞可以引起18F-FDG的摄取增高,因此,HRCT上的磨玻璃密度影区域18F-FDG摄取增高可以用炎性细胞解释。然而研究中网格影、蜂窝影区域同样有18F-FDG摄取,且所有的肺纤维化模型中都有成纤维细胞,并表达葡萄糖转运蛋白1,提示网格影、蜂窝影区域18F-FDG摄取可能由增殖的成纤维细胞引起。2015年,Bondue等[7]用博来霉素制作肺纤维化大鼠模型,在多个阶段采用18F-FDG和N-2-(4-[18F]氟苯甲酰氨基)乙基马来酰亚胺(18F-4-fluorobenzamido-N-ethylamino-male-imide,18F-FBEM)标记白细胞PET/CT显像证实,病变早期18F-FDG摄取与炎性反应有关,肺纤维化18F-FDG高摄取与增生的成纤维细胞大量消耗葡萄糖有关。目前认为网格影、蜂窝影区域已经有肺纤维化改变,当HRCT上出现蜂窝影时,表示病变已不可逆,提示为晚期病变[8-9]。然而此区域18F-FDG摄取增高可能提示正处于纤维化进程的活跃期,而非静止期,这些推测表明即使患者在HRCT上表现为纤维化晚期,仍有可能用药物改善病情。
病理学上认为成纤维细胞的活化、增殖及成纤维细胞向肌成纤维细胞的持续转化是肺纤维化发展的主要因素,肌成纤维细胞的持续存在易引起组织纤维化,肺纤维化是成纤维细胞和肌成纤维细胞参与肺组织结构持续性改建和重塑的结果[10]。成纤维细胞和肌成纤维细胞是临床上控制纤维化的重要靶点,纤维化阶段18F-FDG摄取与成纤维细胞有关,因此,PET可以通过反映成纤维细胞的活性来间接监测疾病的变化及治疗疗效。Meissner等[3]对1例IPF患者随访,第一次PET扫描为阳性,激素治疗一段时间后,呼吸困难明显改善,行PET检查发现其18F-FDG摄取降低,3个月后,随着强的松逐渐减量,呼吸困难逐渐加重,再次行PET检查,18F-FDG摄取明显增加,研究提出PET可以发现疾病活动性的改变,具有监测疾病治疗情况的潜能。Umeda等[11]采用双时显像进行研究,结果表明滞留指数与疾病的活动性有关。然而,18F-FDG PET/CT的稳定性需要进一步证实。Win等[12]对13例IPF患者在2周内进行2次18F-FDG PET/CT检查,采用2种方法对肺部18F-FDG的摄取进行评估,最终证实IPF患者肺部18F-FDG PET/CT图像是稳定的,有较好的短期可重复性,可用于疾病的治疗监测。
本研究在IPF组正常肺组织区域及对照组选取ROI,两组的CT值差异无统计学意义,表明选取区域在CT上的表现一致,两组LT/MBmax及LT/MBmean的差异有统计学意义,表明IPF组在CT上表现为正常的区域同样有18F-FDG摄取增高,PET较CT可能有更高的灵敏度,这与Win等[13]的研究结果一致。灵敏度更高的PET/CT在监测疾病变化方面较HRCT有优势,同时也许能够更早提示IPF的发生。
本研究可能对IPF的病理机制有一定的提示作用。67Ga-citrate应用于弥漫性肺实质性疾病,67Ga-citrate摄取是肺部炎症的表现,通过炎性细胞的转铁蛋白受体转运,在无临床表现的家族遗传性肺纤维化患者中也发现67Ga-citrate的摄取[14]。相对应的,本研究中IPF组HRCT显示的非病变区可能为病变的早期阶段,IPF患者肺内呈弥漫性的代谢增高,表明IPF累及全部肺实质,这与HRCT表现以累及双肺下叶及周围胸膜下的肺实质为主不符,这提示IPF的发展存在时间与分布上的不同步性。
本研究证明IPF患者HRCT上表现为磨玻璃密度影、网格影及蜂窝影区域有18F-FDG摄取,在HRCT上的非病变区域同样也有18F-FDG摄取,表明18F-FDG PET/CT较HRCT有较高的灵敏度,在病情监测以及治疗监测方面具有优势。
特发性肺间质纤维化HRCT病变区与非病变区18F-FDG PET/CT表现分析
18F-FDG PET/CT imaging analysis of regions with abnormal and normal pulmonary parenchyma on high resolution CT in idiopathic pulmonary fibrosis patients
-
摘要:
目的 对比分析特发性肺间质纤维化(IPF)高分辨率CT(HRCT)上病变区域和非病变区域的PET/CT表现及其诊断价值。 方法 按照IPF的临床诊断标准,选取接受PET/CT检查并有完整资料的IPF病例及健康体检者各27例,规定病变区域为HRCT上表现为磨玻璃密度影、网格影及蜂窝影等区域,非病变区域为肉眼可观察到的密度低于病变区的最小密度区,测定病变区域的SUVmax,分别在IPE组非病变区域和对照组肺部HRCT横断面图像上画取ROI,测量其CT值,并在PET/CT图像相应位置画取ROI,测量SUVmax、平均标准化摄取值(SUVmean),计算与纵隔大血管主动脉弓血池(SUVmax、SUVmean)比值:肺组织/纵隔血池最大摄取比(LT/MBmax)和肺组织/纵隔血池平均摄取比(LT/MBmean)。采用独立样本t检验比较组间LT/MBmax、LT/MBmean及CT值差异。 结果 IPF组27例患者,其中肺部表现为磨玻璃密度影14例、网格影27例、蜂窝影13例,同一患者可有多种表现,以上表现均为放射性摄取增高,SUVmax值为2.32±1.10。IPF组非病变区域LT/MBmax(0.44±0.55 vs.0.32±0.05)和LT/MBmean(0.55±0.38 vs.0.33±0.05)均高于对照组(t=5.87和2.89,P均 < 0.05);但两组CT值(-836.59±32.33 vs.-837.99±29.90)比较,差异无统计学意义(t=-0.15,P>0.05)。 结论 IPF患者HRCT上显示的病变区与非病变区对18F-FDG摄取均增加,PET/CT在IPF诊断及治疗监测方面有一定优势。 -
关键词:
- 特发性肺纤维化 /
- 正电子发射断层显像术 /
- 体层摄影术, X线计算机 /
- 氟脱氧葡萄糖F18
Abstract:Objective To compare and analyze the PET signals at regions with abnormal and normal pulmonary parenchyma on high resolution CT(HRCT) in idiopathic pulmonary fibrosis(IPF) patients to explore the diagnostic value of PET/CT. Methods According to the standards for the clinical diagnosis of IPF, a total of 27 IPF patients(21 men and 6 women) and 27 control populations(19 men and 8 women) were randomly selected and recruited for PET/CT. The abnormal regions were described to show ground-glass appearance, reticulation, honeycombing, and so on. Normal regions corresponding to areas of minimal observed density were noted as distinct from the abnormal regions. The maximal standard uptake value(SUVmax) of the abnormal regions was measured. The ROI in HRCT images of the control population was placed in areas of each lung that were considered morphologically normal to measure the CT densities. The ROI was selected in PET/CT images at corresponding locations; the SUVmax and mean standard uptake value(SUVmean) were measured and used to calculate the aortic blood pool of mediastinal large blood vessels. The LT/MBmax, LT/MBmean, and CT densities of each ROI were analyzed by the independent sample t-test. Results Increased pulmonary 18F-FDG uptake was observed in 27 of 27 patients. The parenchymal patterns on HRCT at the site of high metabolism were ground-glass appearance(14/27), reticulation(27/27), and honeycombing(13/27). The LT/MBmax in the normal lung parenchyma of IPF patients was higher than in the control population[(0.44±0.55 vs. 0.32±0.05); t=5.87, P < 0.05]. The LT/MBmean in normal lung parenchyma of IPF was higher than in the controls[(0.55±0.38 vs. 0.33±0.05); t=2.89, P < 0.05]. The CT densities in normal lung parenchyma of IPF and control population were not significantly different[(-836.59±32.33 vs.-837.99±29.90); t=-0.15, P>0.05]. Conclusions IPF patients showed increased pulmonary uptake of 18F-FDG on PET in lung regions with abnormal and normal morphological appearances on HRCT. Therefore, PET/CT gives superior diagnosis and therapeutic monitoring. -
图 1 特发性肺间质纤维化患者18F-FDG PET/CT和高分辨率CT图 患者男性,68岁,图中,A:最大密度投影重建(MIP)图;B~D:分别为PET、CT和PET/CT显像图,图中显示双肺多发磨玻璃密度影及网格影,部分形成蜂窝影,以胸膜下较显著,相应病变区域可见18F-FDG代谢增高;E~G:高分辨率CT横断面、冠状面、矢状面图。结合HRCT在PET/CT图像病变区域画取ROI(红色圆圈),测量该ROI的SUVmax(SUVmax:5.004)。
Figure 1. 18F-FDG PET/CT and high resolution CT images of idiopathic pulmonary fibrosis patients
图 2 特发性肺间质纤维化患者18F-FDG PET/CT和高分辨率CT图 患者男性,57岁,图中,A:最大密度投影重建(MIP)图;B~D:分别为PET、CT和PET/CT显像图,图中显示双肺胸膜下区磨玻璃密度影及网格影,相应病变区域可见18F-FDG代谢增高;E~F:高分辨率CT图,示双肺胸膜下区磨玻璃密度影及网格影。根据高分辨率CT在非病变区域画取ROI(红色圆圈),测量该ROI的CT值(E:-843.108,F:-841.307),在PET/CT相对应区域画取ROI,测量该ROI的SUVmax、SUVmean(SUVmax:0.560,SUVmean:0.509)。SUVmean:平均标准化摄取值。
Figure 2. 18F-FDG PET/CT and high resolution CT images of idiopathic pulmonary fibrosis patients
表 1 IPF组非病变区和对照组的ROI SUVmax、LT/MBmax、SUVmean、LT/MBmean与CT值的比较(x±s)
Table 1. Comparation the value of ROI SUVmax、LT/MBmax、SUVmean、LT/MBmean and CT between abnormal regions of IPF patients and control population(x±s)
分组 SUVmax LT/MBmax SUVmean LT/MBmean CT值/HU IPF组非病变区 0.68±0.20 0.44±0.55 0.51±0.27 0.55±0.38 -836.59±32.33 正常对照组 0.42±0.06 0.32±0.05 0.34±0.06 0.33±0.05 -837.99±29.90 -
[1] 美国胸科学会, 欧洲呼吸学会, 日本呼吸学会, 等.特发性肺纤维化诊治循证指南(摘译本)[J].中华结核和呼吸杂志, 2011, 34(7):486-494. DOI:10.3760/cma.j.issn.1001-0939.2011.07.005.
American Thoracic Society, European Respiratory Society, the Japanese Respiratory Society, et al.Idiopathic pulmonary fibrosis:evidence-based guidelines for diagnosis and management(pick version)[J].Chin J Tuberc Respir Dis, 2011, 34(7):486-494. doi: 10.3760/cma.j.issn.1001-0939.2011.07.005[2] Takimoto T, Sasada S, Yamadori T, et al.A case of adenocarcinoma of lung with idiopathic pulmonary fibrosis, showing 18-fluorodeo-xyglucose uptake in positron emission tomography[J].Nihon Kokyuki Gakkai Zasshi, 2008, 43(4):258-262. DOI:10.1111/j.1365-2958.2008.06208.x. [3] Meissner HH, Soo Hoo GW, Khonsary SA, et al.Idiopathic pulmonary fibrosis:evaluation with positron emission tomography[J].Respiration, 2006, 73(2):197-202. DOI:10.1159/000088062. [4] Groves AM, Win T, Screaton NJ, et al.Idiopathic pulmonary fibrosis and diffuse parenchymal lung disease:implications from initial experience with 18F-FDG PET/CT[J].J Nucl Med, 2009, 50(4):538-545. DOI:10.2967/jnumed.108.057901. [5] El-Chemaly S, Malide D, Yao J, et al.Glucose transporter-1 distribution in fibrotic lung disease:association with[18F]-2-fluoro-2-deoxyglucose-PET scan uptake, inflammation, and neovascularization[J].Chest, 2013, 143(6):1685-1691. DOI:10.1378/chest.12-1359. [6] Nusair S, Rubinstein R, Freedman NM, et al.Positron emission tomography in interstitial lung disease[J].Respirology, 2007, 12(6):843-847. DOI:10.1111/j.1440-1843.2007.01143.x. [7] Bondue B, Sherer F, Van Simaeys GA, et al.PET/CT with 18F-FDG-and 18F-FBEM-labeled leukocytes for metabolic activity and leukocyte recruitment monitoring in a mouse model of pulmonary fibrosis[J].J Nucl Med, 2015, 56(1):127-132. DOI:10.2967/jnumed.114.147421. [8] Kambouchner M, Levy P, Nicholson AG, et al.Prognostic relevance of histological variants in nonspecific interstitial pneumonia[J].Histopathology, 2014, 65(4):549-560. DOI:10.1111/his.12415. [9] Tabaj GC, Fernandez CF, Sabbagh E, et al.Histopathology of the idiopathic interstitial pneumonias(ⅡP):A review[J].Respirology, 2015, 20(6):873-883. DOI:10.1111/resp.12551. [10] 杨雪梅, 王兴胜, 崔社怀.肌成纤维细胞在肺纤维化中的来源和作用[J].国际病理科学与临床杂志, 2008, 28(1):54-58. DOI:10.3969/j.issn.1673-2588.2008.01.013.
Yang XM, Wang XS, Cui SH.Origin and role of myofibroblast in pulmonary fibrosis[J].Inter J Pathol Clini Med, 2008, 28(1):54-58. doi: 10.3969/j.issn.1673-2588.2008.01.013[11] Umeda Y, Demura Y, Ishizaki T, et al.Dual-time-point 18F-FDG PET imaging for diagnosis of disease type and disease activity in patients with idiopathic interstitial pneumonia[J].Eur J Nucl Med Mol Imaging, 2009, 36(7):1121-1130. DOI:10.1007/s00259-009-1069-1. [12] Win T, Lambrou T, Hutton BF, et al.18F-Fluorodeoxyglucose positron emission tomography pulmonary imaging in idiopathic pulmonary fibrosis is reproducible:implications for future clinical trials[J].Eur J Nucl Med Mol Imaging, 2012, 39(3):521-528. DOI:10.1007/s00259-011-1986-7. [13] Win T, Thomas BA, Lambrou T, et al.Areas of normal pulmonary parenchyma on HRCT exhibit increased FDG PET signal in IPF patients[J].Eur J Nucl Med Mol Imaging, 2014, 41(2):337-342. DOI:10.1007/s00259-013-2514-8. [14] Bitterman PB, Rennard SI, Keogh BA, et al.Familial idiopathic pulmonary fibrosis:evidence of lung inflammation in unaffected family members[J].N Engl J Med, 1986, 314(21):1343-1347. DOI:10.1056/NEJM198605223142103. -





 下载:
下载: