-
肝癌为我国常见的恶性肿瘤之一,其侵袭性强、预后差,早期诊断、分期及疗效评估可以指导医师选择正确的治疗方法,改善患者预后[1]。PET/CT已成为肝脏肿瘤筛查及诊断的重要分子影像学技术。在临床工作中,对于具有典型肝癌影像学征象的患者,诊断比较简单,但对缺乏特异性的患者的诊断较困难。本研究阐述了一例18F-FDG联合18F-胸腺嘧啶脱氧核苷(18F-fluoro-3′-deoxy-3′-L-fluorothymidine,18F-FLT)诊断原发性高分化肝癌的诊治过程,以提高诊断水平。
-
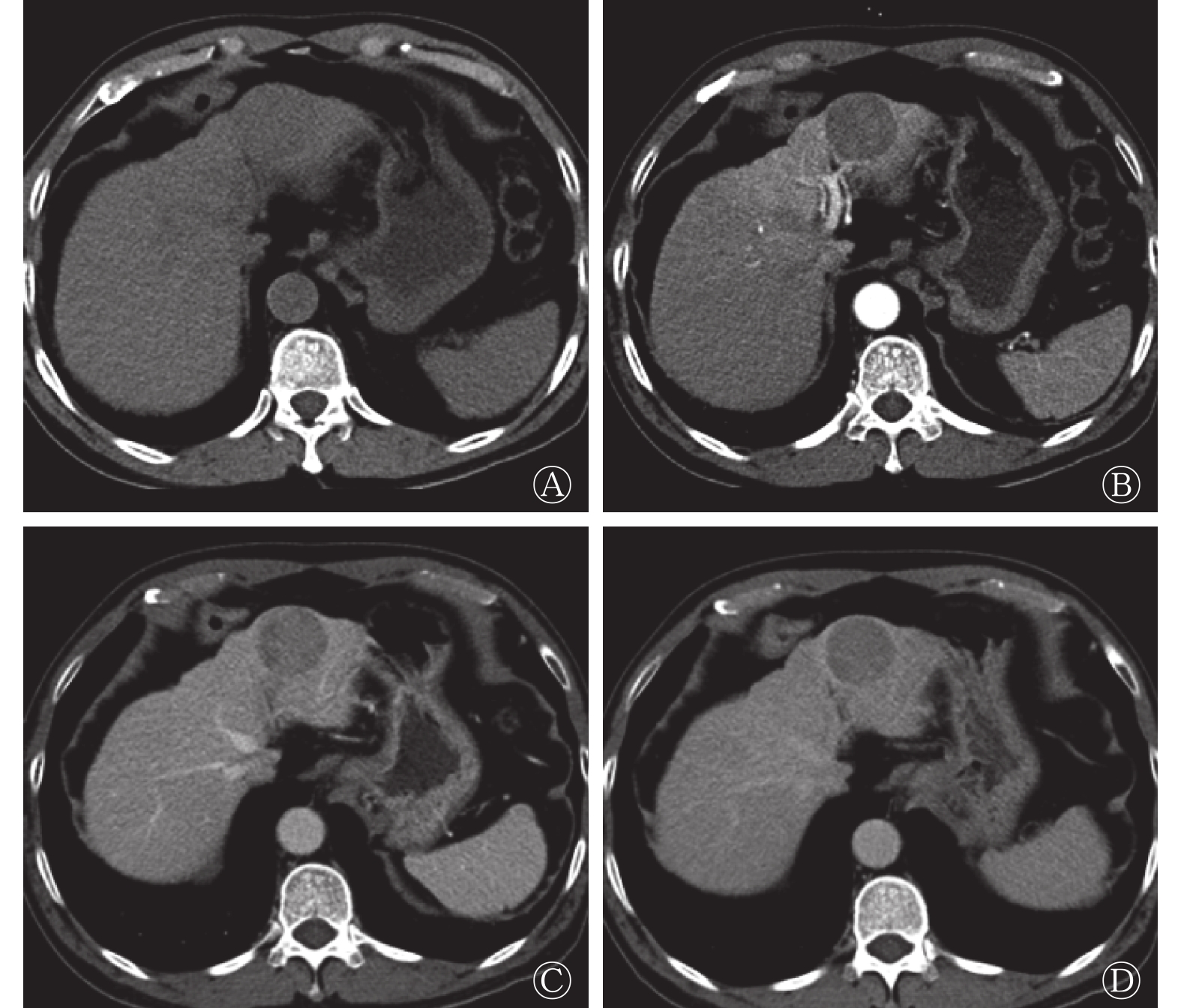
患者男性,69岁,因“常规体检CT发现肝占位6 d”入院,无明显乏力恶心纳差,有乙肝病史。入院后查体:腹部平软,未见腹壁静脉曲张,无压痛及腹肌紧张,未触及腹部包块,肋缘下未触及肝、脾,莫菲氏征阴性。相关实验室检查结果如下,生化:天门冬氨酸氨基转移酶30.3 U/L(正常值为0.0~50.0 U/L),白蛋白40.9 g/L(正常值为36.0~55.0 g/L),总胆红素18.6 μmol/L(正常值为2.0~24.0 μmol/L),直接胆红素6.1 μmol/L(正常值为0.0~7.5 μmol/L),间接胆红素11.0 μmol/L(正常值为1.7~17.0 μmol/L);肿瘤标志物:甲胎蛋白16.0 μg/L(正常值为0~20.0 μg/L),癌胚抗原2.9 μg/L(正常值为0.0~5.0 μg/L)。CT肝脏三期增强扫描显示(图1):肝左外叶上段低密度结节灶,大小约36 mm×39 mm,无明显强化,边界基本清晰,性质难定,鉴于患者有乙肝病史,肝癌待排除。为进一步诊治行PET/CT检查。
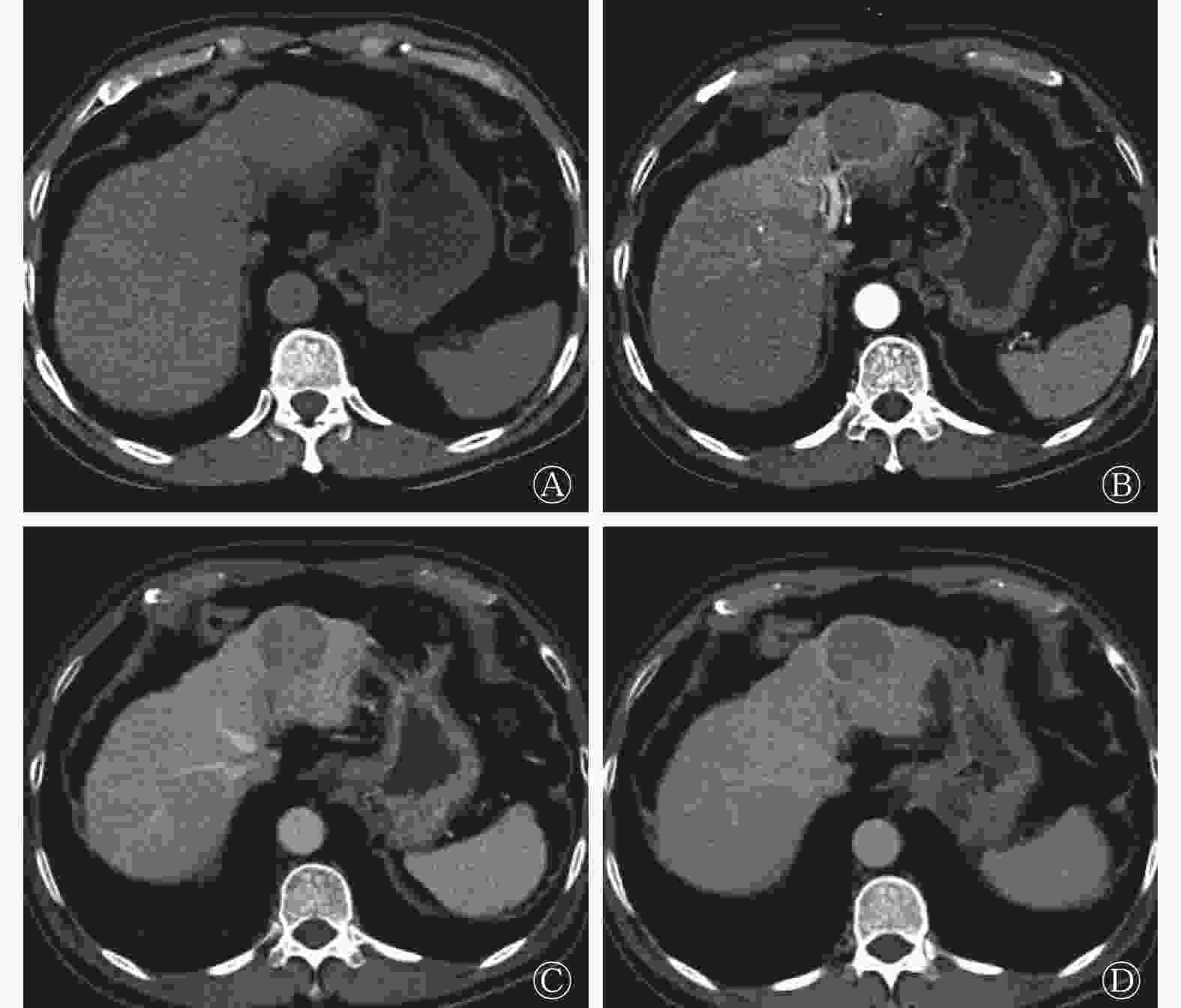
图 1 患者男性,69岁,CT肝脏动态增强扫描横断图像
Figure 1. Dynamic contrast-enhanced CT imagings pf liver(male,69 years old)
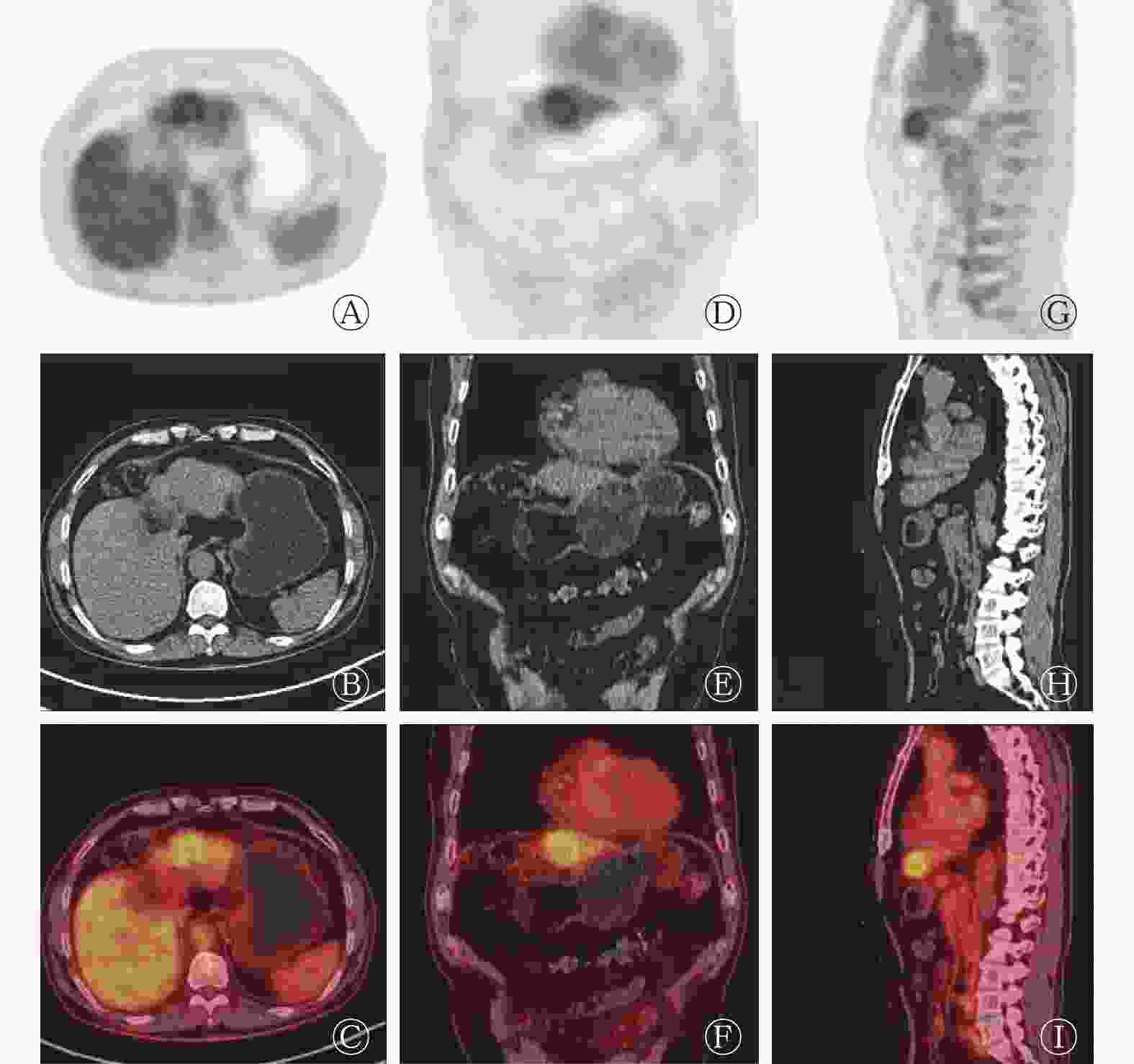
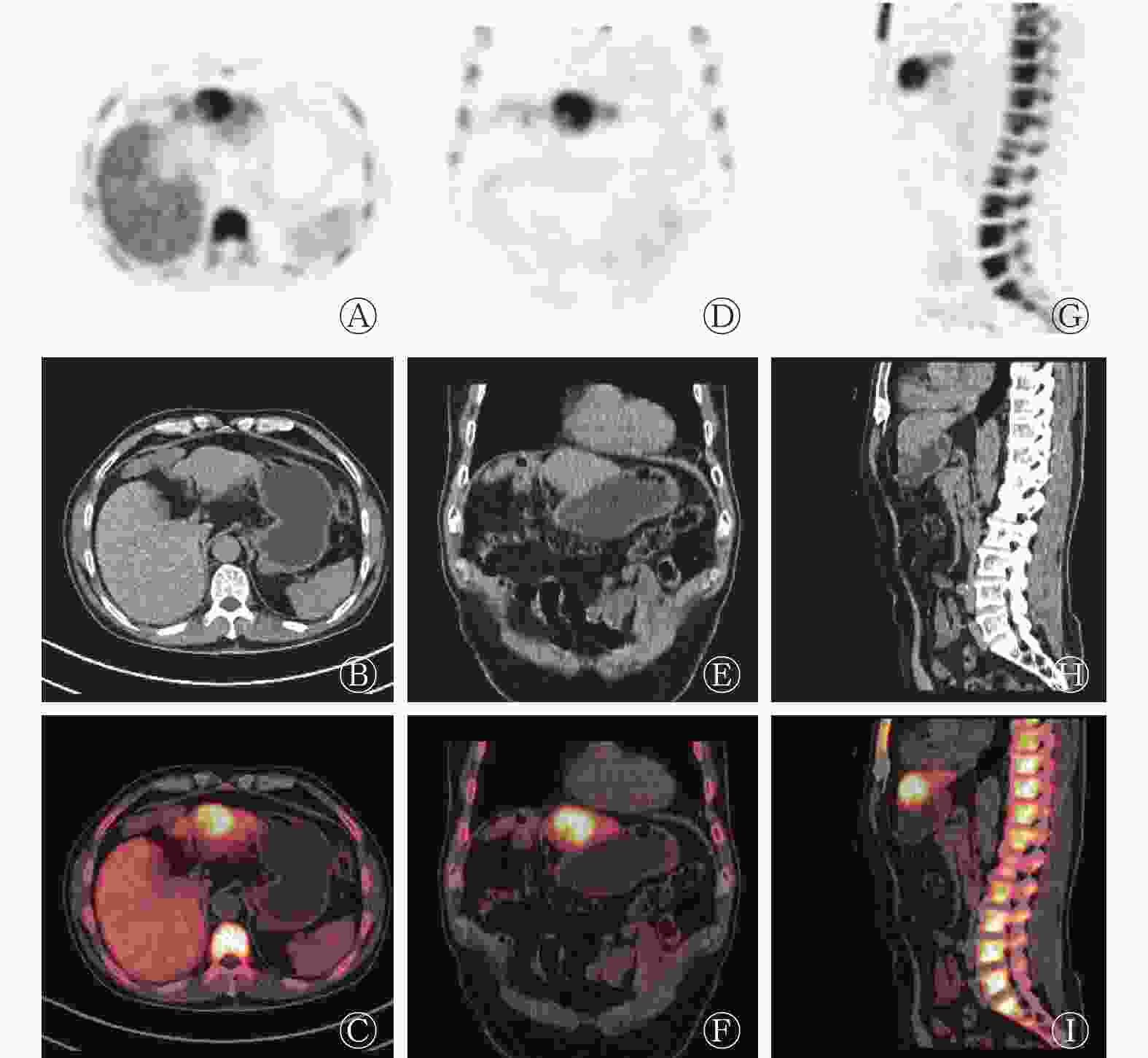
本研究获得我院伦理委员会批准(批准号:201708093),患者于检查前签署了知情同意书。18F-FDG PET/CT采用德国西门子Biograph mct-64,患者空腹6 h以上,空腹血糖水平低于10 mmol/L,静脉注射18F-FDG 4.0×109 Bq/kg,安静状态下休息60 min后行18F-FDG PET/CT显像(图2)。图像显示:肝左外叶上段结节,18F-FDG代谢稍增高,SUVmax 为2.8,病灶与邻近肝实质分界模糊,难以确定病灶性质。次日行18F-氟代脱氧胸腺嘧啶(18F-fluoro-3′-deoxy-3′-L-fluorothymidine,18F-FLT)显像(图3),图像提示:肝左叶病灶代谢活跃,SUVmax为11.2,病灶与邻近正常肝实质代谢差异明显,高度怀疑肝癌。
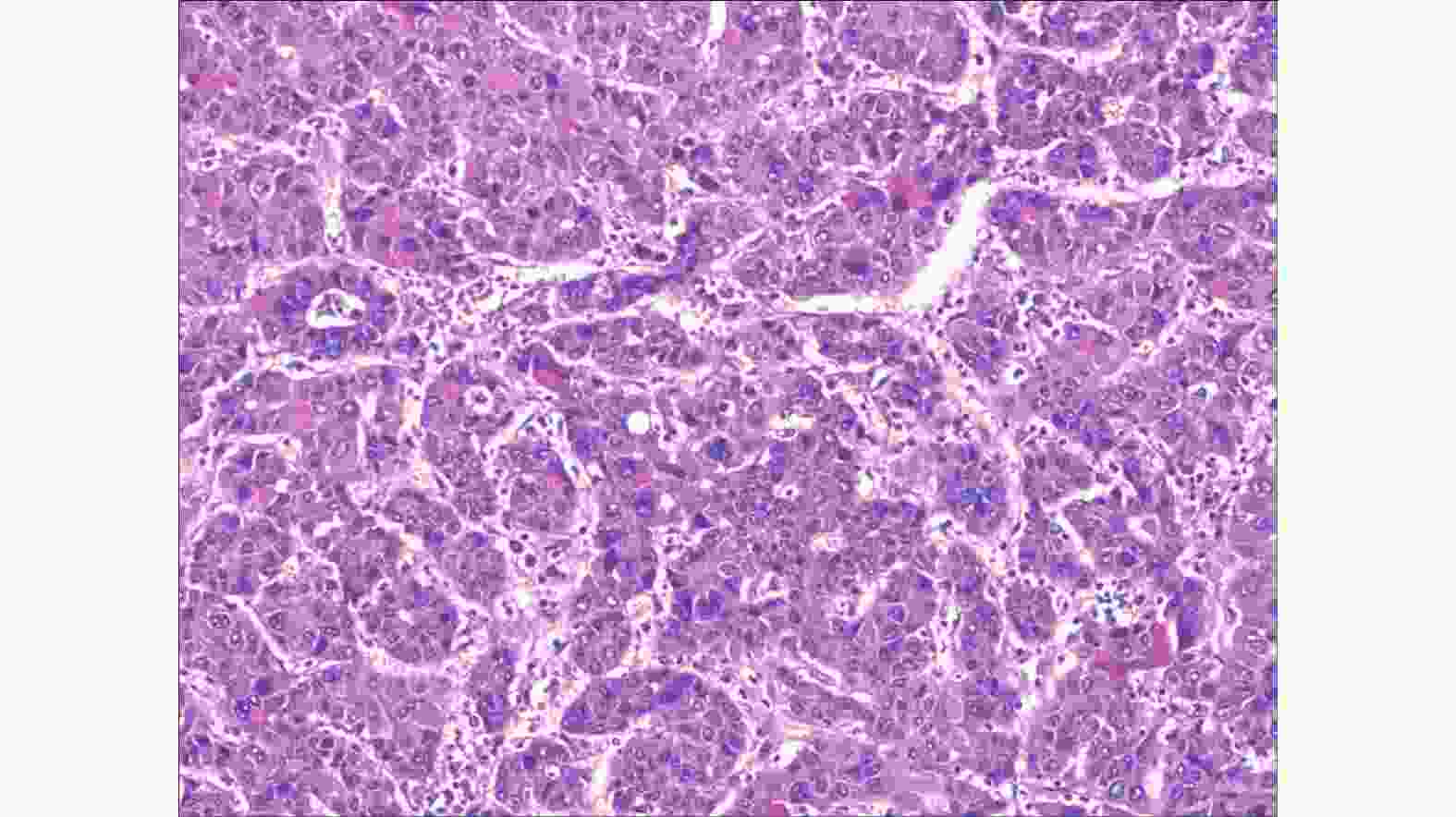
患者有手术指征,无手术绝对禁忌症,行腹腔镜下肝占位切除术+腹腔黏连松弛术+腹腔冲洗引流术,手术顺利;送检病灶大小约4 cm×4 cm×3.5 cm。术后病理结果(图4):肝左外叶高中分化肝细胞癌,切缘未见癌,周围肝组织示结节性肝硬化。
-
原发性肝癌是亚洲,特别是东南亚地区的高发癌种,是肝细胞或肝内胆管上皮发生的恶性肿瘤[1]。男性稍多于女性,多在中年后发病,其病因尚不完全清楚,与乙型和丙型肝炎、肝硬化、真菌及其毒素如黄曲霉素等因素相关[2]。甲胎蛋白(AFP)阳性者占70%~90%。在我国,原发性肝癌大部分由慢性乙型肝炎引起,患者常合并肝硬化。本研究报道的患者有乙肝病史,平时无明显特异性症状,肿瘤标志物正常。常规体检发现肝左叶占位。
肝脏占位的良恶性鉴别对于临床诊断及治疗具有重要意义[2]。常用的影像学检查方法主要有超声、CT和MRI,多数情况下,CT和MRI平扫难以对肝脏占位的良恶性提供定性诊断,增强扫描对肝癌诊断具有重要价值。但上述几种检查方法主要基于疾病的形态学影像及血供特点,缺乏肿瘤病灶的代谢信息[3]。同时,由于解剖位置的关系,当肿瘤位于普通影像学检查的死角时,增强扫描也有可能误诊或漏诊;另外当肝脏占位缺乏典型影像学征象时,依据形态学影像及血供特点难以确定病灶性质[3-4]。本研究中该例患者CT三期增强扫描均显示肝左叶病灶无明显强化,提示病灶血供不丰富,缺乏肝癌典型的影像学特征,故难以对病灶性质做出判断。在实际的临床工作中,临床医师经常遇到这种病例。PET/CT的出现为肝脏结节的鉴别诊断提供了新方法。
PET/CT是PET与CT有机融合的新型设备,结合了两者的优点,使病灶的代谢特征与形态学特征相互融合。目前,18F-FDG PET已广泛应用于肿瘤良恶性的鉴别、分期和再分期、疗效监测、治疗后复发和坏死的鉴别等,在肿瘤的治疗决策中发挥越来越重要的作用,但18F-FDG并不是肿瘤的特异性显像剂。一些分化较好的恶性肿瘤不摄取或摄取较少的18F-FDG[4-6]。正如本文病例,18F-FDG PET/CT显像时肝左外叶上段病灶与肝实质分界不清,病灶与正常肝实质的代谢差别不明显,故仍然难以确定病灶性质。
肝细胞癌因肿瘤细胞分化程度不同对18F-FDG摄取的差别很大。分化较好的肝细胞癌的肿瘤细胞内含有一定水平的葡萄糖-6-磷酸酶,可将进入肿瘤细胞并经已糖激酶催化生成的6-磷酸-18F-FDG水解,去掉6-磷酸,生成18F-FDG,18F-FDG可通过细胞膜被肿瘤细胞清除,PET显像无18F-FDG积聚,导致癌灶摄取18F-FDG不高[5],因此出现假阴性结果,这导致18F-FDG PET在诊断肝癌方面受到一定限制[6]。诸多文献指出PET诊断肝细胞肝癌(hepatocellular carcinoma,HCC)的灵敏度只有50%左右[5-10]。目前全世界范围内尚未发现全面取代18F-FDG的正电子药物,因此弥补18F-FDG PET的不足已成为开发新的正电子药物及临床应用研究的目标和发展的动力。
18F-FLT是近年来比较受关注的新型正电子示踪剂,属于胸腺嘧啶的类似物,在限速酶胸苷激酶(thymidine kinase1,TK1)的作用下参与DNA合成,其利用TK1催化的磷酸化作用来评价DNA的复制过程,通过反映TK1的活性间接反映肿瘤细胞的增殖状况,从而评估肿瘤细胞DNA的合成和细胞增殖活性,有助于对肿瘤进行良恶性鉴别、疗效评估和预后判断,是目前性能较好的核酸代谢显像剂[7-9]。在正常生理情况下,18F-FLT在肝脏的代谢比较旺盛,但它仍然可以反映肝癌细胞的增殖状态。本文中该病例在行18F-FLT PET/CT显像时,病灶区域的代谢明显高于肝实质,提示病灶增殖活跃,怀疑肝癌。在PET/CT图像中不难看出:两种显像剂对同一病灶的显像差异明显,18F-FLT可以比18F-FDG更好地反映肿瘤细胞的增殖状态。18F-FDG和18F-FLT的联合使用及18F-FLT的重要补充价值对该病灶的早期判断及临床医师的决策起了重要作用。
尽管大脑、纵隔及小肠等在生理情况下摄取18F-FLT的量都明显低于18F-FDG,但用18F-FLT描述肿瘤的生物学特征比18F-FDG更具有优势[10-16]。若联合CT和MRI对肝脏肿瘤进行检测,肯定会提高检出的特异度,并对良恶性肿瘤的区分提供有效的帮助。
目前,研究人员更注重对肿瘤治疗前后反应的早期评价。传统显像如CT及MRI主要比较治疗前后的形态学改变,但肿瘤要发生形态学的改变一般都需要数周甚至数月,这样就达不到早期评价的目的[14-18]。有文献表明,PET在HCC射频消融治疗后7 d即可观察到病灶的残留情况,早于传统影像学手段CT和MRI[10-13],同时Troost等[19]和Dittmann等[20]研究指出,18F-FLT PET可以监测肿瘤治疗的早期反应,病灶摄取信号的改变在肿瘤形态学改变之前,18F-FLT用于肿瘤早期反应的效果评价要显著好于18F-FDG。
近年来,大量的研究证实11C-乙酸盐PET/CT也可以弥补18F-FDG在肝癌诊断中的不足,存在较好的互补关系,这与两种显像剂参与肿瘤细胞内不同的代谢途径有关[21-28]。18F-FDG主要参与细胞葡萄糖无氧酵解过程,而11C-乙酸盐的滞留量与脂肪酸磷脂合成过程有关,间接反映的是肿瘤细胞的有氧代谢途径。肿瘤细胞内主要的供能途径随肿瘤恶性程度的提高由有氧代谢逐渐转变为无氧酵解。18F-FDG对分化好、恶性程度低的肿瘤检出率高,而11C-乙酸盐则相反。既往研究提示11C-乙酸盐PET对分化好的HCC病灶诊断阳性率高,而18F-FDG PET对分化差的HCC病灶敏感,其他类型的肝脏恶性病变11C-乙酸盐PET均为阴性[24-28]。18F-FDG和11C-乙酸盐示踪剂联合应用可以提高PET/CT显像对肝癌诊断的准确率,降低漏诊率和误诊率,为肝癌患者拟定治疗方案和随访提供了可靠的诊断依据[19-28]。
本文病例中,两种显像剂对同一病灶的显示差异显著,也充分体现了不同显像剂的联合使用对肝脏不典型性或非特异性病变的初期诊断具有重要价值。因此,临床监测肿瘤或对肿瘤疗效进行评价时,要考虑肝脏肿瘤的不同类型及特征;同时在条件允许的情况下,最好能够多种辅助检查同时进行并综合分析,这样能够明显提高检测的灵敏度和特异度,为临床的诊断及治疗提供一定的价值。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 张威负责数据的获取和论文撰写;许国辉负责论文的审阅;程祝忠负责研究命题的提出、设计;姚玉堂负责文献的查询;何发伟及李勇负责采集病史;罗红兵负责文献的修改。
18F-FLT联合18F-FDG诊断高分化肝癌一例
18F-FLT combined with 18F-FDG in the diagnosis of highly differentiated hepatocellular carcinoma: a case report
-
摘要: 笔者报道了一例18F-FDG联合18F-胸腺嘧啶脱氧核苷(18F-FLT)诊断原发性高分化肝癌的显像病例,从临床症状、实验室检查、影像学等方面分析该病特点,阐述了PET/CT在肝脏疾病诊断中的优势,同时指出18F-FDG在肝癌诊断中的不足,并通过文献回顾了18F-FLT、11C-乙酸盐在肝癌中的应用。不同显像剂的联合使用对肝脏占位的诊断具有重要价值。Abstract: The author reported one case of 18F-FDG imaging combined with 18F fluorothymidine(18F-FLT) in the diagnosis of primary highly differentiated hepatocellular carcinoma. The characteristics of the disease were analyzed according to clinical symptoms, laboratory examinations, and radiology. The advantages of PET/CT in the diagnosis of liver diseases were expounded, and the deficiency of 18F-FDG in the diagnosis of liver cancer was indicated. The literature on the application of 18F-FLT 11C-acetate to hepatocellular carcinoma was reviewed. This study concluded that the combined use of different imaging agents is of great value in the diagnosis of liver-occupying lesions.
-
Key words:
-
-
[1] 唐平, 孟兆娣. 复发性肝内胆管细胞癌的治疗现状[J]. 实用医学杂志, 2017, 33(4): 657−660. DOI: 10.3969/j.issn.1006−5725.2017.04.044.
Tang P, Meng ZD. Current status of treatment for recurrent intrahepatic cholangiocarcinoma[J]. J Pract Med, 2017, 33(4): 657−660. DOI: 10.3969/j.issn.1006−5725.2017.04.044.[2] 中华人民共和国卫生和计划生育委员会医政医管局. 原发性肝癌诊疗规范(2017年版)[J]. 中华消化外科杂志, 2017, 16(7): 635−647. DOI: 10.3760/cma.j.issn.1673−9752.2017.07.001.
Medical Administration of the Health and Family Planning Commission of the People's Republic of China. Standardization of diagnosis and treatment for hepatocellular carcinoma (2017 edition)[J]. Chin J Digest Surg, 2017, 16(7): 635−647. DOI: 10.3760/cma.j.issn.1673−9752.2017.07.001.[3] 冯智超, 朱文卫, 刘倩云, 等. 动脉增强分数定量彩图对肝脏局灶性结节增生与肝细胞癌的鉴别诊断价值[J]. 临床放射学杂志, 2017, 36(2): 231−235. DOI: 10.13437/j.cnki.jcr.2017.02.020.
Feng ZC, Zhu WW, Liu QY, et al. Differential Diagnosis Value of Quantitative Color Mapping of the Arterial Enhancement Fraction between Hepatic Focal Nodular Hyperplasia and Hepatocellular Carcinoma[J]. J Clin Radiol, 2017, 36(2): 231−235. DOI: 10.13437/j.cnki.jcr.2017.02.020.[4] 张峰, 谢良骏, 曹素娥, 等. 18F-FDG PET/CT延迟显像在原发性肝癌诊断中的应用价值[J]. 中华肝脏外科手术学电子杂志, 2017, 6(4): 324−327. DOI: 10.3877/cma.j.issn.2095−3232.2017.04.020.
Zhang F, Xie LJ, Cao SE, et al. Application value of 18F-FDG PET/CT delayed imaging in diagnosis of primary liver cancer[J]. Chin J Hepat Surg, 2017, 6(4): 324−327. DOI: 10.3877/cma.j.issn.2095−3232.2017.04.020.[5] 尚玉琨, 谢明萱. PET在肝脏肿瘤诊断中的应用及研究进展[J]. 中华国际医学杂志, 2002, 2(1): 76−78.
Shang YK, Xie MX. The application and research progress of PET in the diagnosis of liver tumors[J]. Chin J Int Med, 2002, 2(1): 76−78.[6] 王晓燕, 张祥松, 陈志丰, 等. 18F-FDG PET/CT及增强CT诊断原发性肝癌及肝癌术后复发的价值[J]. 中华核医学杂志, 2010, 30(1): 15−18. DOI: 10.3760/cma.j.issn.0253−9780.2010.01.004.
Wang XY, Zhang XS, Chen ZF, et al. The diagnostic value of comparison of 18F-FDG PET/CT with contrast-enhanced CT in detecting primary hepatic carcinoma and postoperative recurrence[J]. Chin J Nucl Med , 2010, 30(1): 15−18. DOI: 10.3760/cma.j.issn.0253−9780.2010.01.004.[7] 江骁, 王潇雄, 陆皓, 等. CFN-MPS-200模块自动化制备18F-FLT及其质量控制与生物评价[J]. 四川大学学报: 医学版, 2017, 48(2): 295−298. DOI: 10.13464/j.scuxbyxb.2017.02.026.
Jiang X, Wang XX, Lu H, et al. Quality Control and Biological Assessment of Automated Synthesized 3'-deoxy-3'-18F-fluorothymidine using CFN-MPS-200 Module[J]. J Sichuan Univ: Med Ed, 2017, 48(2): 295−298. DOI: 10.13464/j.scuxbyxb.2017.02.026.[8] 路丽彦, 姜磊, 高云朝, 等. 18F-FLT与18F-FDG评估白血病荷瘤裸鼠模型肿瘤增殖的研究[J]. 上海交通大学学报: 医学版, 2012, 32(10): 1312−1315. DOI: 10.3969/j.issn.1674−8115.2012.10.007.
Lu LY, Jiang L, Gao YC, et al. Application of 18F-FLT and 18F-FDG in evaluation of tumor proliferation of nude mouse models of leukemia[J]. J Shanghai Jiaotong Univ: Med Ed, 2012, 32(10): 1312−1315. DOI: 10.3969/j.issn.1674−8115.2012.10.007.[9] 江茂情, 吴华. 18F-FDG和18F-FLT PET-CT在肿瘤非手术治疗早期疗效评价中的应用[J]. 国际放射医学核医学杂志, 2012, 36(6): 339−343. DOI: 10.3760/cma.j.issn.1673−4114.2012.06.005.
Jiang MQ, Wu H. 18F-FDG and 18F-FLT PET-CT in evaluation of the early response of malignant tumors after different therapies[J]. Int J Radiol Med Nucl Med, 2012, 36(6): 339−343. DOI: 10.3760/cma.j.issn.1673−4114.2012.06.005.[10] Torizuka T, Tamaki N, Inokuma T, et al. Value of fluorine-18-FDG-PET to monitor hepatocellular carcinoma after interventional therapy[J]. J Nucl Med, 1994, 35(12): 1965−1969. [11] Anderson GS, Brinkmann F, Soulen MC, et al. FDG positron emission tomography in the surveillance of hepatic tumors treated with radiofrequency ablation[J]. Clin Nucl Med, 2003, 28(3): 192−197. DOI: 10.1097/01.RLU.0000053530.95952.FD. [12] Danve A, O'Dell J. The Role of 18F Fluorodeoxyglucose Positron Emission Tomography Scanning in the Diagnosis and Management of Systemic Vasculitis[J]. Int J Rheum Dis, 2015, 18(7): 714−724. DOI: 10.1111/1756−185X.12713. [13] 李立伟, 金泉, 马璐娜, 等. 肝癌经动脉栓塞化疗后FDG PET显像的临床价值——附10例FDG PET和CT结果对照[J]. 中国医学影像技术, 2001, 17(11): 1074−1075. DOI: 10.3321/j.issn:1003−3289.2001.11.020.
Li LW, Jin Q, Ma LN, et al. Clinical Value of FDG PET Imaging in Monitoring Hepatocellular Carcinoma after Chemoembolization Compared FDG PET with CT in 10 Cases[J]. Chin Med Imag Technol, 2001, 17(11): 1074−1075. DOI: 10.3321/j.issn:1003−3289.2001.11.020.[14] 何玉林, 王雪梅, 包宝亮. 18F-FLT合成及其在PET/CT显像中的应用[J]. 内蒙古医学院学报, 2010, 32(2): 95−98. DOI: 10.3969/j.issn.1004−2113.2010.02.005.
He YL, Wang XM, Bao BL. THE SYNTHESIS AND APPLICATION OF 18F-FLT IN PET/CT IMAGING[J]. Acta Acad Med Nei Mongol, 2010, 32(2): 95−98. DOI: 10.3969/j.issn.1004−2113.2010.02.005.[15] 王甜甜, 赵晋华. 18F-FLT增殖显像机制及前期临床研究[J]. 国际放射医学核医学杂志, 2012, 36(1): 8−12. DOI: 10.3760/cma.j.issn.1673−4114.2012.01.002.
Wang TT, Zhao JH. The basis of 18F-3'-deoxy-3'-L-fluorothymidine as a proliferation tracer and preclinical study[J]. Int J Radiol Med Nucl Med, 2012, 36(1): 8−12. DOI: 10.3760/cma.j.issn.1673−4114.2012.01.002.[16] 陈晓婷, 赵鑫, 高振华, 等. 非小细胞肺癌18F-FLT PET显像结果与肿瘤细胞高增殖区的一致性探讨[J]. 山东医药, 2016, 56(6): 45−47. DOI: 10.3969/j.issn.1002−266X.2016.06.016.
Chen XT, Zhao X, Gao ZH, et al. Consistency between 18F-FLT PET imaging results and hyperproliferative regions of tumor cells[J]. Shandong Med, 2016, 56(6): 45−47. DOI: 10.3969/j.issn.1002−266X.2016.06.016.[17] 陈雷, 柳曦. 18F-FDG和18F-FLT的正电子发射断层显像对肿瘤放化疗疗效评价的实验研究[J]. 中国医药导报, 2013, 10(18): 41−43. DOI: 10.3969/j.issn.1673−7210.2013.18.014.
Chen L, Liu X. Experimental research of 18F-FDG and 18F-FLT PET in efficient evaluation of tumor chemotherapy[J]. Chin Med J, 2013, 10(18): 41−43. DOI: 10.3969/j.issn.1673−7210.2013.18.014.[18] Buck AK, Halter G, Schirrmeister H, et al. Imaging Proliferation in Lung Tumors with PET: 18F-FLT Versus 18F-FDG[J]. J Nucl Med, 2003, 44(9): 1426−1431. [19] Troost EGC, Bussink J, Hoffmann AL, et al. 18F-FLT PET/CT for Early Response Monitoring and Dose Escalation in Oropharyngeal Tumors[J]. J Nucl Med, 2010, 51(6): 866−874. DOI: 10.2967/jnumed.109.069310. [20] Dittmann H, Dohmen BM, Paulsen F, et al. [18F]FLT PET for diagnosis and staging of thoracic tumours[J]. Eur J Nucl Med Mol Imag, 2003, 30(10): 1407−1412. DOI: 10.1007/s00259−003−1257−3. [21] Timmer SAJ, Lubberink M, Germans T, et al. Potential of [11C]acetate for measuring myocardial blood flow: Studies in normal subjects and patients with hypertrophic cardiomyopathy[J]. J Nucl Cardiol, 2010, 17(2): 264−275. DOI: 10.1007/s12350−009−9181−y. [22] Liu D, Khong PL, Gao YM, et al. Radiation Dosimetry of Whole-Body Dual-Tracer 18F-FDG and 11C-Acetate PET/CT for Hepatocellular Carcinoma[J]. J Nucl Med Off Publ Soc Nucl Med, 2016, 57(6): 907−912. DOI: 10.2967/jnumed.115.165944. [23] 霍力, 党永红, 崔瑞雪, 等. 11C-乙酸盐PET双时相显像鉴别诊断肝原发肿瘤[J]. 中华核医学与分子影像杂志, 2014, 34(2): 96−99. DOI: 10.3760/cma.j.issn.2095−2848.2014.02.004.
Huo L, Dang YH, Cui RX, et al. Detection of primary hepatoma with early and routine 11C-acetate PET imaging[J]. Chin J Nucl Med Mol Imag, 2014, 34(2): 96−99. DOI: 10.3760/cma.j.issn.2095−2848.2014.02.004.[24] 孙爱君, 任茜, 刘健, 等. 11C-乙酸盐PET和PET/CT在肿瘤显像中的应用[J]. 国际放射医学核医学杂志, 2013, 37(4): 243−247. DOI: 10.3760/cma.j.issn.1673−4114.2013.04.013.
Sun AJ, Ren X, Liu J, et al. The application of 11C-acetate PET and PET-CT for tumors[J]. Int J Radiol Med Nucl Med, 2013, 37(4): 243−247. DOI: 10.3760/cma.j.issn.1673−4114.2013.04.013.[25] Yoo SW, Kim DY, Lee C, et al. Small Bowel Metastasis From Hepatocellular Carcinoma Detected by 18F-FDG PET/CT But Not by 11C-Acetate PET/CT[J]. Clin Nucl Med, 2017, 42(12): 966−967. DOI: 10.1097/RLU.0000000000001882. [26] Li SR, Peck-Radosavljevic M, Ubl P, et al. The value of [11C]-acetate PET and[18F]-FDG PET in hepatocellular carcinoma before and after treatment with transarterial chemoembolization and bevacizumab[J]. Eur J Nucl Med Mol Imag, 2017, 44(10): 1732−1741. DOI: 10.1007/s00259−017−3724−2. [27] Cheung TT, Ho CL, Lo CM, et al. 11C-acetate and 18F-FDG PET/CT for clinical staging and selection of patients with hepatocellular carcinoma for liver transplantation on the basis of Milan criteria: surgeon's perspective[J]. J Nucl Med, 2013, 54(2): 192−200. DOI: 10.2967/jnumed.112.107516. [28] Mohsen B, Giorgio T, Rasoul ZS, et al. Application of 11C-acetate positron-emission tomography (PET) imaging in prostate cancer: systematic review and meta-analysis of the literature[J]. BJU Int, 2013, 112(8): 1062−1072. DOI: 10.1111/bju.12279. -





 下载:
下载: