-
原发性中枢神经系统肿瘤中最常见的是脑胶质瘤,当前治疗的主要方式为手术、放疗及放化疗的联合治疗[1]。复发性脑胶质瘤患者的预后极差,以复发性胶质母细胞瘤为例,平均生存期为14.5个月[2]。18F-FDG PET/CT在预测复发脑胶质瘤患者预后中具有一定的价值[3]。但是,18F-FDG在正常脑组织中有较高本底,18F-FDG显像很难准确勾画肿瘤的边界和浸润范围,一些炎性病变会导致18F-FDG非特异性的摄取,限制了其在脑肿瘤中的应用。18F-脱氧胸腺嘧啶核苷(fluorothymidine, FLT)主要用来评估恶性肿瘤的增殖活性,且正常脑组织对18F-FLT的摄取非常低,因此18F-FLT是一种理想的脑肿瘤显像剂。本研究旨在分析18F-FLT PET/CT显像中的肿瘤增殖体积(proliferation volume,PV),18F-FLT、18F-FDG PET/CT显像中肿瘤的SUVmax与正常脑组织的平均标准化摄取值(average standardized uptake value, SUVmean)的比值(用“T/N”表示)及其他相关临床因素对复发脑胶质瘤患者的预后价值。
-
回顾性分析2012年1月至2016年1月在本院行18F-FDG与18F-FLT PET/CT显像的脑胶质瘤患者资料,所有确诊为首次复发且符合以下条件的患者被纳入本研究:①病理结果为脑胶质瘤;②复发由病理结果证实,或多次MRI检查结合其他临床资料证实;③ Karnofsky(卡氏,KPS,百分法)评分≥60分。排除标准:如果治疗相关的良性病变(包括手术后瘢痕、纤维增生、放射性水肿反应、放射性脑坏死等)不能排除,则该患者将被排除。
确诊为复发的脑胶质瘤患者有20例,其中男性13例、女性7例,年龄为12~73岁,平均年龄(45.65±15.50)岁。患者检查之后根据临床情况接受不同的治疗,对所有的患者进行随访(无失访)直至其死亡。总生存时间(OS)定义为从18F-FDG PET/CT扫描到患者死亡的时间。
-
由日本住友重工公司的HM-10回旋加速器生产的18F,经日本住友重工公司的F300E自动合成模块合成的18F-FDG和18F-FLT,放化纯度均>95%。患者禁食6 h以上,血糖控制在10.0 mmol/L以下,按患者体重静脉注射18F-FDG 4.44 MBq/kg,在暗室平卧60 min,排尿后行PET/CT脑显像。显像仪器为荷兰Philips公司生产的GEMINI TF Ⅱ PET/CT仪。显像条件:三维PET扫描,采集一个床位(6 min/床位),矩阵为128×128;CT扫描为视野(FOV)250 mm、电压140 kV、电流250 mA、螺距0.75、单圈旋转时间0.8 s。隔日行18F-FLT显像,患者无需禁食,其余显像条件同18F-FDG PET/CT显像。
-
图像重建采用滤波反投影法。PET/CT融合图像、PET图像和CT图像都通过软件进行帧对帧对比分析。18F-FDG与18F-FLT浓聚灶均由2位5年以上PET/CT诊断经验的核医学科医师目测确认,如有争议则组织科室讨论确定。手动勾画ROI,由计算机自动生成肿瘤的SUVmax,同时在对侧未受累的正常脑组织区域勾画直径为1.0 cm的圆形ROI作为正常对照组织,如果因为肿瘤的位置导致在对侧大脑半球无法勾画正常脑组织,则在18F-FDG或18F-FLT摄取最高的层面上选取完整的脑组织进行勾画,并计算T/N。在复发病灶的浓聚区域范围内以40% SUVmax为阈值,软件自动计算出PV。在18F-FLT PET/CT图像上测量复发肿瘤的T/NFLT、最大直径、PV;在18F-FDG PET/CT图像上测量复发肿瘤的T/NFDG。所有数据由同一位核医学医师测量和记录。
-
应用IBM SPSS 20.0软件进行统计学分析。通过受试者工作特征曲线(receiver operating characteristic curve,ROC)分析PV、肿瘤最大直径、T/NFDG、T/NFLT预测肿瘤复发(患者为长生存期)的最佳阈值,并评价预测效能。采用Kaplan-Meier分析法进行生存分析,组间比较采用log-rank检验。采用比例风险回归模型(proportional hazards model,Cox模型)对PV、最大直径、T/NFDG、T/NFLT及其他相关临床因素与预后关系进行单因素和多因素分析。P < 0.05表示差异有统计学意义。
-
首次手术病理结果为世界卫生组织(world health organization,WHO)Ⅱ级的有7例,其中星型细胞瘤6例、室管膜瘤1例;首次手术病理结果为WHO Ⅲ、Ⅳ级的有13例,其中Ⅲ级3例(均为间变性少突胶质细胞瘤)、Ⅳ级10例(均为胶质母细胞瘤)。18F-FDG PET/CT图像上测量的T/NFDG为0.404~3.882(1.720±0.950)。18F-FLT PET/CT图像上测量的T/NFLT为2.40~24.00(9.00±4.60),肿瘤最大直径为1.10~5.80(2.87±1.10)cm,PV为1.35~33.67(13.30±7.48)cm3。随访截至2016年12月,20例患者全部死亡。患者的中位生存期为7个月,>7个月界定为长生存期,≤7个月界定为短生存期。其他一般资料见表 1。
临床因素 例数 百分比或范围 性别 男 13 65% 女 7 35% 中位年龄/岁 55 12-73 原发肿瘤分级(WHO) Ⅱ级 7 35% Ⅲ、Ⅳ级 13 65% 治疗方式 手术+放化疗 10 5% 手术+放疗 9 45% 手术+化疗+贝伐珠单抗 1 5% 注:表中,WHO:世界卫生组织;T/N:肿瘤的最大标准化摄取值与正常脑组织的平均标准化摄取值的比值;FDG:氟脱氧葡萄糖;FLT:脱氧胸腺嘧啶核苷;PV:增殖体积。 表 1 20例复发脑胶质瘤患者的一般特征
Table 1. Characteristics of 20 patients with recurrent gliomas
-
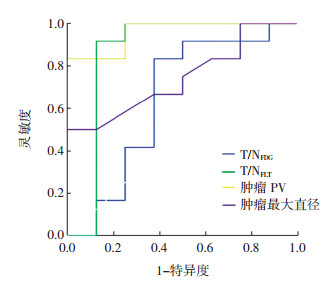
不同因素预测复发脑胶质瘤患者为长生存期的ROC曲线见图 1。PV的最佳阈值为12.565 cm3,对应的灵敏度为83.300%、特异度为100%,ROC曲线下面积(area under roc curve,AUC)为0.958(95%CI:0.879~1.000);T/NFLT的最佳阈值为7.752,对应的灵敏度为91.700%、特异度为87.500%、AUC为0.865(95%CI:0.636~1.000);最大直径的最佳阈值为2.800 cm,对应的灵敏度为58.300%、特异度为75.000%、AUC为0.745(95%CI:0.529~0.961);T/NFDG的最佳阈值为1.192,对应的灵敏度为83.300%、特异度为62.500%、AUC为0.646(95%CI:0.365~0.926)。
-
不同PV(< 12.565 cm3与≥12.565 cm3)、T/NFLT(< 7.752与≥7.752)、最大直径(< 2.800 cm与≥2.800 cm)、T/NFDG(< 1.192与≥1.192)、首次手术病理结果(Ⅱ级与Ⅲ、Ⅵ)间的生存结果差异均有统计学意义(χ2=12.587、12.219、4.285、5.955、6.787,均P < 0.05);不同年龄(< 52岁与≥52岁)与性别组间的生存结果差异均无统计学意义(χ2=1.064、0.611,均P>0.05)。
-
Cox模型单因素分析结果提示,PV、T/NFLT、T/NFDG、首次手术病理结果与20例复发脑胶质瘤的生存期相关,最大直径、患者的年龄、性别对20例复发脑胶质瘤的生存期没有影响(表 2)。应用Cox模型对全部20例复发脑胶质瘤的PV、T/NFLT、T/NFDG、首次病理等预后相关因子进行多因素分析,结果显示PV是本组20例复发脑胶质瘤患者预后的独立影响因素,危险比为0.208(95%CI:0.076~0.953,P=0.012),生存曲线分析也显示PV < 12.565 cm3的10例患者生存时间明显高于PV≥12.565 cm3的10例患者(图 2);而T/NFLT、T/NFDG和首次病理结果均不能作为独立预后因素,危险比分别为4.947(95%CI:0.727~33.644)、1.837(95% CI:0.576~5.853)和2.335(95%CI:0.558~9.764),P值分别为0.102、0.304和0.245(均>0.05)。
影响因素 统计学指标 危险比(HR) 95%CI P值 PV(< 12.565 cm3与≥ 12.565 cm3) 0.113 0.024-0.530 0.006 T/NFLT(< 7.752与≥7.752) 0.105 0.021-0.513 0.005 肿瘤直径(< 2.800 cm与≥2.800 cm) 0.388 0.141-1.066 0.066 T/NFDG(< 1.192与≥1.192) 0.314 0.109-0.903 0.032 首次病理结果(WHO Ⅱ级与WHO Ⅲ、Ⅳ级) 0.262 0.082-0.838 0.024 年龄(< 52岁与≥52岁) 0.629 0.242-1.632 0.340 性别(男/女) 1.417 0.548-3.665 0.473 注:表中,PV:增殖体积;T/N:肿瘤的最大标准化摄取值与正常脑组织的平均标准化摄取值的比值;FDG:氟脱氧葡萄糖;FLT:脱氧胸腺嘧啶核苷;WHO:世界卫生组织。 表 2 影响20例复发脑胶质瘤患者预后的Cox模型单因素分析
Table 2. Cox single-factor analyses of twenty patients with recurrent glioma
-
有研究结果显示,18F-FLT PET/CT显像中的T/NFLT与脑胶质瘤预后显著相关[4-5]。也有研究结果提示,高级别胶质瘤的T/NFLT明显高于低级别胶质瘤的T/NFLT[6]。这证明T/NFLT是一个反映胶质瘤患者肿瘤细胞增殖的可靠参数。本研究结果中,仅Cox模型单因素分析结果提示T/NFLT和复发脑胶质瘤患者的预后显著相关,而多因素分析结果提示T/NFLT不是独立预后因素。在脑胶质瘤的治疗中,尤其是综合治疗后复发的脑胶质瘤存在异质性,T/NFLT只能反映某一截面肿瘤的增殖水平,而不是肿瘤整体的增殖水平。这可能是T/NFLT不能作为复发脑胶质瘤患者独立预后因素的原因。
PV代表了肿瘤中具有较高增殖活性的部分,同时包含了增殖因素和解剖体积因素。因此可以推测,PV是一个可靠的代表患者肿瘤负荷的生物标志。国外的研究结果显示,18F-FLT PET对复发恶性脑胶质瘤患者生存的预测有较高的价值[7-8]。Idema等[9]研究结果表明,18F-FLT PET/CT显像得出的肿瘤PV是原发性恶性脑胶质瘤患者独立的预后因素,其预测能力强于其他已知的临床因素。本研究结果也显示,PV < 12.565 cm3的10例患者生存时间明显高于PV≥12.565 cm3的10例患者。因此提示PV大的复发恶性脑胶质瘤与PV小的复发恶性脑胶质瘤相比,可能需要更积极的治疗和更密切的随访。
18F-FDG PET/CT显像中的代谢功能参数,在预测肺癌、食管癌、宫颈癌、淋巴瘤等肿瘤的预后中有较高的价值[10-13]。也有研究结果显示,18F-FDG PET能够预测高级别复发脑胶质瘤的预后[14]。本研究结果也提示,T/NFDG < 1.192患者的生存期显著高于T/NFDG≥1.192的患者。由于正常脑皮质对18F-FDG的高摄取,使得18F-FDG PET很难准确勾画肿瘤的边界和浸润范围,难以准确计算肿瘤的代谢体积,而且一些炎性病变尤其是肉芽肿性病变导致FDG非肿瘤性的摄取增加,也导致肿瘤的代谢体积很难真正体现肿瘤的代谢活性,这些方面都限制了18F-FDG PET在脑胶质瘤中的应用。
病理分级通常被认为是恶性胶质瘤的一个重要预后因素。而我们的研究中,原发肿瘤的病理分级在Cox模型单因素分析中与预后相关,但是在多因素分析中不是一个独立预后因素。因为复发脑胶质瘤患者的一般情况相对较差,得到所有患者复发时的病理诊断结果几乎不可能,因此我们采用第一次获得的病理结果进行分级,这有可能低估了一部分患者复发时的病理分级。因为部分WHO低级别的胶质瘤,复发时会转化成WHO更高级别的胶质瘤。
我们的研究存在一定的不足:①研究纳入的病例相对较少,降低了研究结果的说服力;②入组患者在PET/CT扫描后接受了不同的治疗,而且恶性胶质瘤复发后的治疗方式很难统一,我们没有调整PET/CT扫描后治疗方式对生存期的影响;③为了避免不同复发次数对生存期的影响,本研究仅纳入了初次复发的脑胶质瘤患者,但是在实际临床工作中,相当一部分的脑胶质瘤患者都会有多次复发。18F-FLT PET/CT显像得出的PV在多次复发的脑胶质瘤患者预后中的价值仍需进一步研究。
综上所述,18F-FLT PET/CT显像是一种无创的影像学技术,可以在体外监测复发恶性脑胶质瘤的增殖活性,并计算恶性复发脑胶质瘤的肿瘤PV。18F-FLT PET/CT显像得出的肿瘤PV是复发恶性脑胶质瘤的独立预后因素。临床医师可以通过18F-FLT PET/CT显像来预测复发恶性脑胶质瘤的生存期,指导个体化治疗决策的制定,对于肿瘤PV大的患者,给予更积极的治疗和更密切的随访以提高患者的生存期。
18F-FLT PET/CT显像评估复发脑胶质瘤患者预后的价值
Prognostic value of 18F-FLT PET/CT imaging in patients with recurrent gliomas
-
摘要:
目的 探讨18F-脱氧胸腺嘧啶核苷(FLT)PET/CT显像中的肿瘤增殖体积(PV)在评估复发脑胶质瘤患者预后中的价值。 方法 回顾性分析2012年1月至2016年1月行18F-FLT PET/CT与18F-氟脱氧葡萄糖(FDG)PET/CT检查、经病理结果或临床随访证实为复发的20例脑胶质瘤患者的临床资料。在18F-FLT PET/CT图像上测量复发肿瘤的最大标准化摄取值与正常脑组织的平均标准化摄取值的比值(T/NFLT)、最大直径和PV,在18F-FDG PET/CT图像上测量复发肿瘤的T/NFDG。随访时间截至2016年12月。采用Kaplan-Meier分析法进行生存分析,组间比较采用log-rank检验;采用比例风险回归(Cox)模型对PV、最大直径、T/NFDG、T/NFLT及其他相关临床因素与预后关系进行单因素和多因素分析。 结果 20例复发脑胶质瘤患者的中位生存时间为7个月。PV、T/NFLT、最大直径、T/NFDG、年龄预测长生存期的最佳阈值分别为12.565 cm3、7.752、2.800 cm、1.192、52岁,对应的ROC曲线下面积(AUC)分别为0.958、0.865、0.745、0.646、0.667。Kaplan-Meier单因素分析结果显示,复发灶不同PV(< 12.565 cm3与≥12.565 cm3)、T/NFLT(< 7.752与≥7.752)、肿瘤最大直径(< 2.800 cm与≥2.800 cm)、T/NFDG(< 1.192与≥1.192)、首次病理结果(Ⅱ级与Ⅲ、Ⅳ级)间的生存曲线差异均有统计学意义(χ2=12.587、12.219、4.285、5.955、6.787,均P < 0.05)。Cox模型单因素分析结果显示,20例复发脑胶质瘤患者的预后与PV、T/NFLT、T/NFDG、首次病理结果有关,危险比分别为0.113(95% CI:0.024~0.530)、0.105(95% CI:0.021~0.513)、0.314(95% CI:0.109~0.903)、0.262(95% CI:0.082~0.838),差异均有统计学意义(均P < 0.05)。Cox回归模型多因素分析结果显示,肿瘤PV是复发脑胶质瘤患者生存预后的独立影响因素。 结论 18F-FLT PET/CT显像中的肿瘤PV可以作为复发脑胶质瘤患者预后的评估指标。 Abstract:Objectives To evaluate the prognostic value of proliferation volume (PV) measured by pretreating patients with recurrent gliomas with 18F-fluorothymidine (FLT) PET/CT imaging. MethodsThe clinical data of 20 patients that underwent 18F-FDG PET/CT and 18F-FLT PET/CT examinations from January 2012 to January 2016 showed that recurrent gliomas were retrospectively analyzed. We measured the ratio of the maximum standard uptake value of the tumor to the mean standard uptake value of the normal brain tissue (T/NFLT), PV, and maximum diameter via 18F-FLT PET/CT imaging, T/NFDG was measured by 18F-FDG PET/CT imaging. The follow-up time lasted until December 2016. ResultThe median survival time of 20 patients with recurrent gliomas was 7 months. The optimal PV, T/NFLT, diameter, T/NFDG, and age cut-off values were 12.565 cm3, 7.752, 2.800 cm, 1.192, and 52 years, with the area under the curve values of 0.958, 0.865, 0.745, 0.646, and 0.667, respectively. Kaplan-Meier single factor analysis revealed that the survival times significantly differed among patients with different PV (< 12.565 cm3 vs. ≥ 12.565 cm3), T/NFLT (< 7.752 vs. >7.752), maximum diameter (< 2.800 cm vs. >2.800 cm), and T/NFDG values (< 1.192 vs. >1.192), as well as different pathologies of the first operation (WHO Ⅱ vs. WHO Ⅲ and Ⅲ) (χ2=12.587, 12.219, 4.285, 5.955, 6.787; all P < 0.05). Cox single-factor analyses indicated that PV, T/NFLT, T/NFDG, and pathology were the risk factors of survival, with the hazard ratios of 0.113 (95% CI:0.024-0.530), 0.105 (95% CI:0.021-0.513), 0.314 (95% CI:0.109-0.903), and 0.262 (95% CI:0.082-0.838), respectively. Cox multifactor analyses indicated that PV was an independent predictor of survival risk. Conclusion PV is an important factor in the prognosis prediction of patients with recurrent gliomas via 18F-FLT PET/CT imaging. -
表 1 20例复发脑胶质瘤患者的一般特征
Table 1. Characteristics of 20 patients with recurrent gliomas
临床因素 例数 百分比或范围 性别 男 13 65% 女 7 35% 中位年龄/岁 55 12-73 原发肿瘤分级(WHO) Ⅱ级 7 35% Ⅲ、Ⅳ级 13 65% 治疗方式 手术+放化疗 10 5% 手术+放疗 9 45% 手术+化疗+贝伐珠单抗 1 5% 注:表中,WHO:世界卫生组织;T/N:肿瘤的最大标准化摄取值与正常脑组织的平均标准化摄取值的比值;FDG:氟脱氧葡萄糖;FLT:脱氧胸腺嘧啶核苷;PV:增殖体积。 表 2 影响20例复发脑胶质瘤患者预后的Cox模型单因素分析
Table 2. Cox single-factor analyses of twenty patients with recurrent glioma
影响因素 统计学指标 危险比(HR) 95%CI P值 PV(< 12.565 cm3与≥ 12.565 cm3) 0.113 0.024-0.530 0.006 T/NFLT(< 7.752与≥7.752) 0.105 0.021-0.513 0.005 肿瘤直径(< 2.800 cm与≥2.800 cm) 0.388 0.141-1.066 0.066 T/NFDG(< 1.192与≥1.192) 0.314 0.109-0.903 0.032 首次病理结果(WHO Ⅱ级与WHO Ⅲ、Ⅳ级) 0.262 0.082-0.838 0.024 年龄(< 52岁与≥52岁) 0.629 0.242-1.632 0.340 性别(男/女) 1.417 0.548-3.665 0.473 注:表中,PV:增殖体积;T/N:肿瘤的最大标准化摄取值与正常脑组织的平均标准化摄取值的比值;FDG:氟脱氧葡萄糖;FLT:脱氧胸腺嘧啶核苷;WHO:世界卫生组织。 -
[1] 刘道佳, 唐明灯, 林端瑜, 等. 18F-FDG与18F-FLT PET/CT诊断脑胶质瘤综合治疗后复发的对比研究[J].中华核医学与分子影像杂志, 2017, 37 (4):198-201. DOI:10.3760/cma.j.issn.2095-2848. 2017.04.002
Liu DJ, Tang MD, Lin DY, et al. Comparison on the diagnostic values of 18F-FDG and 18F-FLT PET/CT in patients with suspicious recurrence of glioma after multimodal treatment[J]. Chin J Nucl Med Mol Imaging, 2017, 37 (4):198-201. doi: 10.3760/cma.j.issn.2095-2848.2017.04.002[2] Kamiya-Matsuoka C, Gilbert MR. Treating recurrent glioblastoma:an update[J]. CNS Oncol, 2015, 4 (2):91-104. DOI:10.2217/cns.14.55. [3] Santra A, Kumar R, Sharma P, et al. F-18 FDG PET-CT for predicting survival in patients with recurrent glioma:a prospective study[J]. Neuroradiology, 2011, 53 (12):1017-1024. DOI:10.1007/s00234-011-0898-3. [4] Thiele F, Ehmer J, Piroth MD, et al. The quantification of dynamic FET PET imaging and correlation with the clinical outcome in patients with glioblastoma[J]. Phys Med Biol, 2009, 54 (18):5525-5539. DOI:10.1088/0031-9155/54/18/012. [5] Karunanithi S, Sharma P, Kumar A, et al. Can 18F-FDOPA PET/CT predict survival in patients with suspected recurrent glioma? A prospective study[J]. Eur J Radiol, 2014, 83 (1):219-225. DOI:10.1016/j.ejrad.2013.09.004. [6] Yamamoto Y, Ono Y, Aga F, et al. Correlation of 18F-FLT uptake with tumor grade and Ki-67 immunohistochemistry in patients with newly diagnosed and recurrent gliomas[J]. J Nucl Med, 2012, 53 (12):1911-1915. DOI:10.2967/jnumed.112.104729. [7] Schwarzenberg J, Czernin J, Cloughesy TF, et al. 3'-deoxy-3'-18F-fluorothymidine PET and MRI for early survival predictions in patients with recurrent malignant glioma treated with bevacizumab[J]. J Nucl Med, 2012, 53 (1):29-36. DOI:10.2967/jnumed.111. 092387. [8] Schiepers C, Dahlbom M, Chen W, et al. Kinetics of 3'-deoxy-3'-18F-fluorothymidine during treatment monitoring of recurrent high-grade glioma[J]. J Nucl Med, 2010, 51 (5):720-727. DOI:10.2967/jnumed.109068361. [9] Idema AJ, Hoffmann AL, Boogaarts HD, et al. 3'-Deoxy-3'-18F-fluorothymidine PET-derived proliferative volume predicts overall survival in high-grade glioma patients[J]. J Nucl Med, 2012, 53 (12):1904-1910. DOI:10.2967/jnumed.112.105544. [10] 董烨, 吴湖炳, 王全师, 等. 18F-FDG PET/CT多次显像在监测和预测非小细胞肺癌术后复发和转移中的价值[J].中华核医学与分子影像学杂志, 2014, 34 (2):81-85. DOI:10.3760/cma.j.issn.2095-2848.2014.02.001.
Dong Y, Wu HB, Wang QS, et al. Prediction of postoperative recurrence and metastasis with 18F-FDG PET/CT in patients with non-small cell lung cancer[J]. Chin J Nucl Med Mol Imaging, 2014, 34 (2):81-85. doi: 10.3760/cma.j.issn.2095-2848.2014.02.001[11] 谢彦婷, 郑容. 18F-FDG PET/CT在食管癌放疗中的应用[J].国际放射医学核医学杂志, 2013, 37 (1):42-46. DOI:10.3760/cma.j.issn.1673-4114.2013.01.012.
Xie YT, Zheng R. The application of 18F-FDG PET/CT in the radiotherapy of esophageal cancer[J]. Int J Radiat Med Nucl Med, 2013, 37 (1):42-46. doi: 10.3760/cma.j.issn.1673-4114.2013.01.012[12] 陈丹丹, 吴湖炳, 王全师, 等. 18F-FDG PET/CT在复发宫颈癌疗效评价及预后预测中的价值[J].中华核医学与分子影像学杂志, 2015, 35 (3):168-172. DOI:10.3760/cma.j.issn.2095-2848. 2015. 03.003.
Chen DD, Wu HB, Wang QS, et al. Value of 18F-FDG PET/CT in the evaluation of treatment response and prognosis for patients with recurrent uterine cervical cancer[J]. Chin J Nucl Med Mol Imaging, 2015, 35 (3):168-172. doi: 10.3760/cma.j.issn.2095-2848.2015.03.003[13] 戴云秀, 杨光杰, 王振光, 等. 18F-FDG PET/CT基线SUVmax在滤泡性淋巴瘤侵袭性、分期评价中的价值及其与中期疗效的相关性研究[J].国际放射医学核医学杂志, 2018, 42 (2):104-110. DOI:10.3760/cma.j.issn.1673-4114.2018.02.002.
Dai YX, Yang GJ, Wang ZG, et al. Evaluation of invasiveness, staging, and correlation with interim therapeutic response based on baseline 18F-FDG PET/CT SUVmax in patients with follicular lymphoma[J]. Int J Radiat Med Nucl Med, 2018, 42 (2):104-110. doi: 10.3760/cma.j.issn.1673-4114.2018.02.002[14] Colavolpe C, Chinot O, Metellus P, et al. FDG-PET predicts survival in recurrent high-grade gliomas treated with bevacizumab and irinotecan[J]. Neuro Oncol, 2012, 14 (5):649-657. DOI:10.1093/neuonc/nos012. -






 下载:
下载: