-
肺癌性淋巴管病(pulmonary lymphangitic carcinomatosis, PLC)是一种肺内或肺外恶性肿瘤转移并在肺淋巴管内弥漫性广泛生长的肺内转移癌,是肺内外肿瘤肺内转移的一种特殊类型。PLC的预后极差,50%~85%的患者生存期仅为3~6个月,且临床诊断较困难,常与肺炎、充血性心衰、肺栓塞、哮喘、结节病等间质性肺病变相混淆[1]。目前主要依靠患者的临床表现、恶性肿瘤病史、高分辨率CT和(或)薄层CT的影像学特点及随访结果进行综合确诊。我们通过回顾性分析确诊的PLC的18F-FDG PET/CT影像学特点,总结其特征性表现,探讨PET/CT对PLC的诊断价值。
-
选取2016年8月至2017年9月在我院我科行PET/CT检查并经病理结果确诊的PLC患者53例。其中男性34例、女性19例,年龄39~84岁,平均年龄(62.67±10.28)岁。53例PLC患者包括肺腺癌39例、肺鳞癌5例、肺小细胞癌5例、食管癌3例和纵隔鳞癌1例。纳入标准:①明确的恶性肿瘤病史并经病理结果证实;②肺门及纵隔高代谢淋巴结经病理证实为转移性病灶。③PLC病灶经病理证实(5例)或经高分辨率CT和(或)薄层CT检查并且结合多次随访(正规抗炎无效、肿瘤综合治疗后病灶未进展或好转等)综合证实(48例)。排除标准:疑似PLC但不符合纳入标准的病例均被排除在外。本研究获得我院伦理委员会批准,批准号:KS(Y)1779,所有患者均于检查前签署了知情同意书。
-
患者均行PET/CT+薄层屏气CT扫描。仪器为西门子Biograph mCT-S PET/CT(64排螺旋CT)。18F-FDG由上海原子科兴药业有限公司生产提供,PH值约为7.0,放化纯度>95%。受检患者检查前禁食6 h以上,血糖控制在正常水平(< 7.8 mmol/L),注射18F-FDG 3.7~5.55 MBq/kg(0.10~0.15 mCi/kg),平静休息45~60 min,扫描前排空膀胱尿液并除去身上所有影响图像质量的异物。受检患者采用仰卧位,双臂交叉环抱于头顶,先行CT定位扫描,扫描范围从颅底至股骨上1/3处,选择检查范围后进行螺旋CT扫描,扫描条件:管电压120 kV,根据管电流调节技术(CARE Dose 4D)自动调节,层厚5 mm。再行全身PET图像采集5~6个床位,采集时间为2 min/床位。利用CT扫描数据对PET图像进行衰减校正,采用TrueX+飞行时间(TOF)法重建图像,获得横断面、矢状面及冠状面的PET图像、CT图像及PET/CT融合图像。所有患者扫描后均加做胸部薄层屏气CT平扫,层厚1.0 mm,管电压120 kV,管电流110 mA,扫描时间0.5 s/圈,肺窗,重建函数为B50f medium sharp。
-
测量方法:采集好的图像传输至PACS图像后处理工作站。由1名主治及主治以上职称医师进行PLC病灶确认及CT ROI的勾画,另1名主任医师进行复核诊断及数据审核。应用西门子公司后处理软件在CT图像上勾画ROI,工作站根据以下公式计算出平均标准化摄取值(mean standardized uptake value,SUVmean)。
${\rm{SU}}{{\rm{V}}_{{\rm{mean}}}} = \frac{{{\rm{感兴趣区域活性(MBq/mL)}}}}{{{\rm{注射计量[MBq/单位体重(g)]}}}} $ SUV易受到患者体重、肺组织摄取放射性能力等因素影响,为了克服SUV测定的缺点,使病例间去除个体本底的差异,我们选择肺动脉干水平计算纵隔血池活性,然后计算ROI与纵隔血池标准化比值(standardized uptake ratios, SUR)。
${\rm{SUV}} = \frac{{{\rm{感兴趣区域活性(MBq/mL)}}}}{{{\rm{纵膈血池活性(MBq/mL)}}}} $ 测定指标:测定增厚小叶间隔肺野、对侧正常小叶间隔肺野、受累支气管血管束、对侧同节段正常支气管血管束、肿大的淋巴结以及纵隔血池的SUVmean;测定并计算增厚小叶间隔肺野、对侧正常小叶间隔肺野、受累支气管血管束及对侧同节段正常支气管血管束与纵隔血池的SUR。
-
应用SPSS19.0软件对数据进行统计学分析。计量资料采用均数±标准差(x±s)表示。当计量资料呈正态分布且方差齐时,两组数据的比较采用独立样本t检验,P < 0.05表示差异有统计学意义。
-
53例PLC患者中,PLC病灶呈弥散性发生于单侧肺患者的有28例(52%,28/53);呈局限性发生于单侧肺的有20例(39%,20/53);呈弥漫或局灶性发生于双侧肺的有5例(9%,5/53)。所有病例均见小叶间隔增厚,50例患者(94%,50/53)见支气管血管束增粗;10例患者胸膜呈串珠样增厚(18%,10/53)。18F-FDG PET/CT显像后,在目视下,51例(96%,51/53)患者见增厚小叶间隔伴放射性摄取,51例(96%,51/53)患者可见支气管血管束放射性摄取增强。51例(96%,51/53)患者可见肺门及纵隔淋巴结肿大伴放射性摄取增强;39例(73%,39/53)患者胸膜可见放射性摄取或摄取增强。
对ROI进行SUVmean测定发现,PLC患者的肺野与正常肺野比较,增厚小叶间隔所在肺野(n=58)SUVmean明显高于正常肺野(n=48)SUVmean,约是正常的3倍,差异有统计学意义(1.46±0.92 vs. 0.58±0.18,t=19.85,P < 0.01)。PLC患者累及支气管血管束(n=56)SUVmean明显高于正常支气管血管束(n=48)SUVmean,约是正常的4倍,差异有统计学意义(3.85±1.67 vs. 0.90±0.19,t=15.45,P < 0.01)。肿大肺门纵隔淋巴结(n=51)和纵隔血池(n=53)的SUVmean分别为10.55±5.86和1.79±0.66。在进行SUR测定计算后发现,增厚小叶间隔肺野/纵隔血池的SUR仍高于正常小叶间隔肺野/纵隔血池的SUR(0.84±0.38 vs. 0.40±0.21, t=12.77,P < 0.01);增粗支气管的血管束/纵隔血池的SUR也明显高于正常支气管血管束/纵隔血池的SUR(2.89±0.94 vs. 0.59±0.19,t=12.62,P < 0.01),差异均有统计学意义。
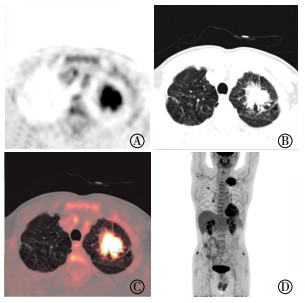
在18F-FDG PET/CT融合显像后,有2例患者CT可见小叶间隔增厚而目视未见放射性摄取,对这2例患者小叶间隔增厚肺野测定发现SUVmean和SUR均明显高于对侧正常肺野(图 1)。另外,有1例PCL患者的CT图像上未见明显支气管血管束增粗,但PET显像发现支气管血管束代谢异常增高(图 2)。支气管血管束放射性摄取增高在PLC中具有很强的特征性,典型图像见图 3。

图 1 左肺上叶腺癌患者(男性, 55岁)的PET/CT融合图像
Figure 1. PET/CT fusion images of patients with left upper lobe adenocarcinoma (male, 55 years old)
-
PLC又称肺癌性淋巴管炎,是癌细胞在肺内转移的一种特殊途径,占肺部转移瘤的6%~8%[2]。PLC的病理表现是淋巴管内充满癌细胞,呈团块状生长,使淋巴液淤滞,管腔扩张,同时伴有不同程度水肿,炎细胞浸润。
关于PLC的发病机制国外学者认为有两种途径:一种常见的机制是肿瘤微栓子经血行转移到毛细血管,随后浸润播散到肺间质和淋巴管,继而肿瘤通过淋巴管再增殖和传播;另一种少见的机制是肿瘤由已被肿瘤满载的肺门淋巴结逆行蔓延至肺内淋巴管并浸润播散到肺间质而致PLC,约占PLC患者的25%[3-4]。另有文献报道肺内的原发性恶性肿瘤(如肺癌),一般经血行直接转移种植到肺淋巴管内,进而转移至肺门淋巴结,因此肺门淋巴结不一定肿大;而肺外原发性肿瘤直接转移到肺门淋巴结,引起局部淋巴液回流障碍而致肿瘤在淋巴管内播散,故多伴有肺门淋巴结肿大[5-7]。而国内王宏伟等[8]通过尸检发现PLC的发生可分为两种情况:一是较易形成淋巴道转移的肿瘤(如肺癌、乳腺癌、胃癌等),肿瘤组织首先转移至肺门淋巴结,进而阻塞肺内的淋巴回流,最后通过肺门淋巴结逆向扩散到肺内的淋巴管中;而一些较易发生血行转移的肿瘤(如肝癌、胰腺癌等)多先经肺内血管扩散,再经血液、淋巴回流转移至肺内淋巴管内形成PLC,往往不伴有肺门淋巴结的癌转移。在PLC中肺门淋巴结是否转移与原发肿瘤在肺内或肺外并不存在明显差异,而与肿瘤首先经淋巴道还是经血行转移及肿瘤的扩散程度有关。肖燕等[9]通过尸检也发现了类似的结果。我们的研究结果发现,53例PLC患者原发癌为肺癌49例、食管癌3例、纵隔鳞癌1例,PET/CT检查显示51例有肺门、纵隔淋巴结肿大,PLC病灶呈弥散性发生于单侧肺的有28例,呈局限性发生于单侧肺的有20例,呈弥漫或局灶性发生于双侧肺的有5例。这些结果与上述国内报道的研究结果基本相同。我们发现2例PLC患者肺门及纵隔的淋巴结未见明显肿大,这是因为肺部原发肿瘤局限在一个肺叶,瘤体较大,瘤周肺野淋巴管被直接侵犯而先出现癌性淋巴管病,此时肺门及纵隔淋巴结尚未被累及。
PLC的症状主要是进行性加重的呼吸困难、干咳和咯血,临床表现并不特异,常与肺炎、充血性心衰、肺栓塞、哮喘、结节病等间质性肺病变相混淆。当肿瘤原发灶未被发现时,PLC的诊断尤为困难。PLC患者的胸部CT影像有一些相对特异性的特征:①支气管血管束增粗;②小叶间隔增厚;③胸膜不规则增厚;④肺门和纵隔淋巴结肿大[10-11]。但这些影像学特点并不仅见于PLC患者,亦可见于结节病、淋巴瘤、间质性肺炎和其他实质性肺部疾病,需要进行鉴别诊断。PET/CT在肺癌的诊断和分期、治疗反应评估和预后预测方面的作用已经十分明确[12-14]。同时PET/CT对肺淋巴管癌病也是一种无创性的、具有潜在诊断价值的方法,但国内尚未见有文献报道。2005年Digumarthy等[15]最早报道了7例PLC患者的FDG摄取分布情况,其后Acikgoz等[16]报道了5例PLC患者的PET显像。但在上述两个研究中仅单独进行了PET显像而没有同时做CT断层扫描和融合显像。虽然这两个研究也另外做了CT扫描,但体位、呼吸运动以及疾病的进展都可能对PET和CT的诊断一致性造成影响。2010年Prakash等[17]报道了35例PLC患者的PET/CT显像特点,结果显示PET/CT诊断PLC的特异度为100%,灵敏度为86%,PLC每一侧肺的SUV显著高于对侧正常肺。
本研究结果发现PLC患者所有CT影像均见小叶间隔增厚,50例患者可见支气管血管束增粗,10例患者胸膜呈串珠样增厚,这些结果与Oikonomou和Prassopoulos[18]的报道相似。我们在进行18F-FDG PET/CT融合显像后,在目视下发现有51例患者可见增厚小叶间隔伴放射性摄取,有2例患者CT可见小叶间隔增厚而18F-FDG PET/CT融合显像后目视未见放射性摄取,这是因为原发肿瘤在肺野内直接引发局部淋巴管阻塞,癌细胞侵犯入淋巴管内出现PLC,而肿瘤的高放射性摄取导致周边肺野癌性淋巴管病灶摄取难以被目视法观察到。这种情况也在Prakash等[17]的研究中被观察到,进而导致其报道的PET/CT诊断PLC的灵敏度仅为86%。我们对这2例患者小叶间隔增厚肺野测定的SUVmean和SUR均明显高于对侧正常肺野。另外,我们发现51患者可见支气管血管束放射性摄取增强,1例PCL患者在CT图像上未见明显支气管血管束增粗,但PET显像显示支气管血管束代谢异常增高。这说明PLC在支气管血管束受累早期,CT尚未能观察到支气管血管束串珠样增粗增厚的改变,而PET从代谢的方面就已经可以发现其受累的范围及程度,所以PET/CT融合显像的诊断可以更全面、更早期的发现和评估PLC病灶。国外有研究仅测定PLC肺野的SUVmean,结果显示PLC肺野的SUVmean明显高于正常肺野,但并没有对增厚的小叶间隔及增粗的支气管血管束的SUVmean进行分别测量[15-17]。而我们发现增厚小叶间隔所在肺野SUVmean约是正常小叶间隔肺野的3倍,PLC累及支气管血管束SUVmean约是正常支气管血管束的4倍。在消除不同患者体重、肺组织放射性摄取差异后,增厚小叶间隔肺野/纵隔血池的SUR仍约高于正常小叶间隔肺野/纵隔血池的SUR的2倍,而增粗支气管血管束/纵隔血池的SUR则明显高于正常支气管血管束/纵隔血池的SUR近5倍。由于PLC累及支气管血管束放射性摄取明显增高且形态呈条索样,因此支气管血管束放射性摄取增高在PLC中具有很强的特征性,非常易于在PLC患者的PET/CT显像中进行目视诊断(图 3)。
综上所述,在绝大多数PLC患者的PET/CT融合显像中存在如下特征:①支气管血管束放射性浓聚,典型患者的CT图像可见支气管血管束结节样增粗;②PLC累及小叶间隔放射性摄取增高,典型患者的CT图像可见小叶间隔结节样增厚;③肺门和纵隔淋巴结肿大或显示伴放射性异常浓聚。PET/CT融合显像可以更全面、更早地发现和诊断PLC病灶,结合局部SUVmean和SUR的测定可进一步提高PET/CT融合显像对PCL病灶诊断的准确率。
18F-FDG PET/CT在肺癌性淋巴管病的影像学特征及诊断价值
Imaging features and diagnostic value of 18F-FDG PET/CT in pulmonary lymphangitic carcinomatosis
-
摘要:
目的探讨肺癌性淋巴管病(PLC)18F-FDG PET/CT的影像学特征及其诊断价值。 方法回顾性分析我院2016年8月至2017年9月临床确诊的53例PLC患者,均行PET/CT+薄层屏气CT扫描。利用CT扫描数据对PET图像进行衰减校正,采用TrueX+飞行时间法重建图像并进行分析、总结。测定各感兴趣区的平均标准化摄取值(SUVmean)并计算标准化比值(SUR),比较不同区域的SUVmean和SUR的差异。 结果53例PLC患者中,51例(96%,51/53)可见增厚小叶间隔伴放射性摄取,增厚小叶间隔所在肺野SUVmean明显高于正常肺野,差异有统计学意义(1.46±0.92 vs.0.58±0.18,t=19.85,P < 0.01);增厚小叶间隔肺野/纵隔血池的SUR高于正常小叶间隔肺野/纵隔血池的SUR,差异有统计学学意义(0.84±0.38 vs.0.40±0.21,t=12.77,P < 0.01)。51例(96%,51/53)可见支气管血管束放射性摄取增强。PLC累及支气管血管束SUVmean明显高于正常支气管血管束,差异有统计学意义(3.85±1.67 vs.0.90±0.19,t=15.45,P < 0.01)。增粗支气管血管束/纵隔血池的SUR高于正常支气管血管束/纵隔血池的SUR(2.89±0.94 vs.0.59±0.19,t=12.62,P < 0.01)。51例(96%,51/53)可见肺门及纵隔淋巴结肿大伴放射性摄取增强。 结论典型PLC患者的PET/CT融合显像特征为支气管血管束增粗伴放射性浓聚;PLC累及小叶间隔结节样增厚伴放射性摄取增高;肺门和纵隔淋巴结肿大或显示伴放射性异常浓聚。PET/CT融合显像结合局部SUVmean和SUR的测定,不但可以更早地诊断PLC病灶,而且可以提高对PCL病灶诊断的准确率。 -
关键词:
- 肺肿瘤 /
- 正电子发射断层显像计算机体层摄影术 /
- 癌性淋巴管炎
Abstract:ObjectiveTo explore the imaging features and diagnostic value of 18F-FDG PET/CT in pulmonary lymphangitic carcinomatosis(PLC). MethodsRetrospective analysis on 53 PLC cases was performed. The patients underwent PET/CT+ thin breath hold CT scanning. The PET images were attenuated by CT scanning data and reconstructed by TrueX+time of flight method. The mean standardized uptake value(SUVmean) of each region of interest was measured, and the standardized uptake ratios(SUR) value was calculated. The difference of the SUVmean and SUR values in different regions was compared. ResultsAmong the 53 patients with PLC, 51(96%, 51/53) displayed interlobular septal thickening of the interlobular septa with radioactive uptake, and the lung SUVmean was significantly higher than that of the normal lung field(1.46±0.92 vs. 0.58±0.18, t=19.85, P < 0.01). The interlobular septal thickening lung/mediastinal blood pool SUR was higher than that of the normal septal lung/mediastinal blood pool SUR(0.84±0.38 vs. 0.40±0.21, t=12.77, P < 0.01), and 51 cases(96%, 51/53) manifested bronchovascular bundle uptake enhancement. The SUVmean of PLC involving bronchovascular bundle was significantly higher than that of normal bronchovascular bundle(3.85±1.67 vs. 0.90±0.19, t=15.45, P < 0.01). The SUR of the thickened bronchi vascular bundle/mediastinal blood pool was higher than that of the normal bronchovascular bundle/mediastinal blood pool SUR(2.89±0.94 vs. 0.59±0.19, t=12.62, P < 0.01). In 51 cases(96%, 51/53), the swelling of the hilum and mediastinal lymph nodes was enhanced with radioactivity. ConclusionsPET/CT fusion imaging of typical patients with PLC is characterized by the thickening of bronchial vascular bundles with radioactive concentration and thickening of the interlobular septal nodules with increased uptake of radioactivity. Moreover, the hilar and mediastinal lymph nodes were enlarged or normal with abnormal concentration of radioactivity. PET/CT fusion imaging combined with local SUVmean and SUR can measurements not only enables the early and accurate diagnosis of PLC lesions. -
-
[1] Charest M, Armanious S. Prognostic implication of the lymphangitic carcinomatosis pattern on perfusion lung scan[J]. Can Assoc Radiol J, 2012, 63(4):294-303. DOI:10.1016/j.carj.2011.04.004. [2] Bhattacharya PK, Jamil M, Khonglah Y, et al. A Rare Case of Pulmonary Lymphangitic Carcinomatosis in a Young Adult with Carcinoma Stomach[J]. J Clin Diagn Res, 2017, 11(8):OD07-OD09. DOI:10.7860/JCDR/2017/27352.10397. [3] Lee SJ, Lee J, Yu SJ, et al. Timely diagnosis of pulmonary artery tumor embolism by ultrasound-guided transbronchial needle aspiration[J]. Thorac Cancer, 2014, 5(2):184-187. DOI:10.1111/1759-7714.12062. [4] Gorshein E, Burger R, Ferrari A, et al. Dramatic mixed response of lymphangitic pulmonary metastases in newly diagnosed prostate cancer[J]. Urol Ann, 2017, 9(3):278-280.DOI:10.4103/UA.UA_21_17. [5] Moubax K, Wuyts W, Vandecaveye V, et al. Pulmonary lymphangitic carcinomatosis as a primary manifestation of gastric carcinoma in a young adult: a case report and review of the literature[J/OL]. BMC Res Notes, 2012, 5: 638[2018-01-01]. https: //www. ncbi. nlm. nih. gov/pmc/articles/PMC3519516. DOI: 10.1186/1756-0500-5-638. [6] Vattimo AV, Burroni L, Bertelli P, et al. The 'fragmented' scintigraphic lung pattern in pulmonary lymphangitic carcinomatosis secondary to breast cancer[J]. Respiration, 1998, 65(5):406-410. DOI:10.1159/000029304. [7] Kashitani N, Eda R, Masayoshi T, et al. Lobar extent of pulmonary lymphangitic carcinomatosis. Tl-201 chloride and Tc-99m MIBI scintigraphic findings[J]. Clin Nucl Med, 1996, 21(9):726-729. doi: 10.1097/00003072-199609000-00011 [8] 王宏伟, 陆江阳, 王晓虹, 等.肺淋巴管癌病8例尸检临床病理学观察[J].诊断病理学杂志, 2005, 12(3):174-177. DOI:10.3969/j.issn.1007-8096.2005.03.005.
Wang HW, Lu JY, Wang XH, et al. Clinicopathological features of pulmonary lymphangitic carcinomatosis:a report of 8 autopsied cases[J]. Chin J Diagn Pathol, 2005, 12(3):174-177. doi: 10.3969/j.issn.1007-8096.2005.03.005[9] 肖燕, 王海燕, 王宏伟, 等.肺淋巴管癌病误诊病例回顾性分析[J].中国肺癌杂志, 2007, 10(1):54-57.
Xiao Y, Wang HY, Wang HW, et al. Misdiagnosis analysis of pulmonary lymphomatosis carcinomatous[J]. Chin J Lung Cancer, 2007, 10(1):54-57.[10] Oikonomou A, Prassopoulos P. Mimics in chest disease:interstitial opacities[J]. Insights Imaging, 2013, 4(1):9-27. DOI:10.1007/s13244-012-0207-7. [11] Godbole R, Ghatol A, Betancourt J, et al. Pulmonary Tumor Thrombotic Microangiopathy:Clinical, Radiologic, and Histologic Correlation[J]. J Clin Imaging Sci, 2015, 5:44. DOI:10.4103/2156-7514.161978. [12] Park SB, Choi JY, Moon SH, et al. Prognostic value of volumetric metabolic parameters measured by[18F]fluorodeoxyglucose-positron emission tomography/computed tomography in patients with small cell lung cancer[J]. Cancer Imaging, 2014, 14:2. DOI:10.1186/1470-7330-14-2. [13] Chung HW, Lee KY, Kim HJ, et al. FDG PET/CT metabolic tumor volume and total lesion glycolysis predict prognosis in patients with advanced lung adenocarcinoma[J]. J Cancer Res Clin Oncol, 2014, 140(1):89-98. DOI:10.1007/s00432-013-1545-7. [14] Ooi H, Chen CY, Hsiao YC, et al. Fluorodeoxyglucose Uptake in Advanced Non-small Cell Lung Cancer With and Without Pulmonary Lymphangitic Carcinomatosis[J]. Anticancer Res, 2016, 36(8):4313-4320. [15] Digumarthy SR, Fischman AJ, Kwek BH, et al. Fluorodeoxyglucose positron emission tomography pattern of pulmonary lymphangitic carcinomatosis[J]. J Comput Assist Tomogr, 2005, 29(3):346-349. doi: 10.1097/01.rct.0000163952.03192.ef [16] Acikgoz G, Kim SM, Houseni M, et al. Pulmonary lymphangitic carcinomatosis(PLC):spectrum of FDG-PET findings[J]. Clin Nucl Med, 2006, 31(11):673-678. DOI:10.1097/01.rlu.0000242210. 99022.fd. [17] Prakash P, Kalra MK, Sharma A, et al. FDG PET/CT in assessment of pulmonary lymphangitic carcinomatosis[J]. AJR Am J Roentgenol, 2010, 194(1):231-236. DOI:10.2214/AJR.09.3059. [18] Oikonomou A, Prassopoulos P. Mimics in chest disease:interstitial opacities[J]. Insights Imaging, 2013, 4(1):9-27. DOI:10.1007/s13244-012-0207-7. -





 下载:
下载: