-
放射性核素显像是术前甲状旁腺诊断的主要检查方法,1989年自99Tcm-MIBI作为显像剂应用以来,围绕其所开展的扫描技术主要有单核素双时相技术和双核素(99Tcm-MIBI/ 99TcmO4-)减影技术。2009年版欧洲核医学指南[1]指出,双核素减影技术和SPECT/CT融合技术在检出甲状旁腺功能亢进症(简称甲旁亢)的灵敏度优于单核素双时相技术。因不同显像技术的单独或联合应用,有关甲状旁腺放射性核素显像灵敏度(34%~100%)的各类报道存在很大差异[2-3]。另外,患者纳入或排除标准的不同也是其原因之一[4-5]。本研究的目的是在常规双时相平面显像的基础上联合减影平面显像和(或)SPECT/CT融合显像,评价联合显像对于甲旁亢患者术前病灶诊断的增益价值。
-
2015年3月至2016年3月序贯纳入本院甲旁亢患者28例,其中,男性8例、女性20例,年龄27~80岁,平均年龄(54±14)岁,其中包括21例原发性甲旁亢患者和7例继发性甲旁亢患者。所有患者均在行甲状旁腺放射性核素显像前2~3 d测定血清甲状旁腺激素(parathyroid hormone, PTH)、血钙等,术后1个月再次测定血清PTH及血钙,随访12个月以上。所有患者无失访。
-
采用德国西门子Symbia T2 SPECT/CT扫描仪,配低能高分辨率平行孔准直器。99TcmO4-注射液由原子高科股份有限公司提供,注射用99Tcm-MIBI由江苏省原子医学研究所江原制药厂提供。
-
(1)静脉注射99TcmO4-40~60 MBq,20 min后行前位甲状腺静态扫描。采集参数:矩阵256×256,能峰140 keV,窗宽15%,使用低能高分辨率平行孔准直器,采集时间5 min。(2)早期相:叮嘱患者体位不动,再次静脉注射99Tcm-MIBI 600 MBq,5 min后,行静态扫描,采集参数设置同前,采集时间10 min。(3)早期相结束后,立即行SPECT/CT融合显像,SPECT采集时间15 s/帧,矩阵128×128。在SPECT采集区域内使用CARE Dose 4D自动毫安秒技术进行CT扫描,电压110 keV,扫描层厚为2 mm。(4)延迟相:99Tcm-MIBI注射120 min时,行延迟显像,采集参数设置同早期相,采集时间10 min。(5)减影相:99TcmO4-图像和99Tcm-MIBI早期相图像采用我科图像后处理Syngo软件进行减影。
接受检查前所有患者均签署了知情同意书。
-
处理完成后的图像,按照双时相平面显像(双时相)、减影平面显像(减影相)、SPECT/CT融合显像(SPECT/CT融合相)、双时相联合减影平面显像、双时相联合SPECT/CT融合显像、减影平面显像联合SPECT/CT融合显像、双时相联合减影相和SPECT/CT融合显像(全部联合相)等7种阅片方式在盲法的条件下分别进行独立分析和判断。
图像诊断标准:在早期相和延迟相甲状腺区域均出现异常放射性浓聚区,判定为双时相平面显像阳性;SPECT显像表现为异常放射性浓聚区,经同机CT融合后相应位置CT图像上可见软组织密度结节并排除甲状腺结节,判定为SPECT/CT融合显像阳性;在减影处理完成后图像中甲状腺区域的任何放射性浓聚区,拟判定为减影相平面显像阳性。对于双时相联合减影平面相或(和)SPECT/CT融合显像,联合图像互相参考,其中任意一种图像显示阳性病灶,该联合图中所显示的浓聚区判定为联合显像阳性。
图像分析由两位20年以上工作经验的核医学医师分别进行诊断,结果不一致时由第3位医师(中级以上医师)进行判定。
-
以病理结果为金标准,分别计算各显像技术诊断试验的评价指标。采用SPSS 17.0软件进行统计学分析。计量数据以x ± s表示,采用配对卡方检验(McNemar test)比较各显像技术检出病灶的数据,其他数值型变量采用Wilcoton秩和检验。P < 0.05表示差异有统计学意义。
-
原发性和继发性甲旁亢患者的术前PTH水平均高于正常值(0.6~12 pmol/L),两者血清PTH水平差异无统计学意义。由表 1可知,术前原发性甲旁亢患者符合高钙血症的临床生化表现,而继发性甲旁亢患者由于肾衰导致的低钙血症也与表 1统计的数据相符,术后随访甲旁亢患者的血清PTH、血钙水平均在正常范围内。
组别 血清甲状旁腺素(pmol/L) 血钙(mmol/L) 术前 术后 术前 术后 原发性甲旁亢患者(n=21) 102.4±88.8 6.8±3.1 2.9±0.3 2.9±0.3 继发性甲旁亢患者(n=7) 98.2±53.6 8.8±5.1 1.9±0.2 2.1±0.3 注:表中,血清甲状旁腺激素、血钙值均为术前2耀3 d及术后6个月的随访值。甲旁亢:甲状腺功能亢进症。 表 1 28例甲状旁腺功能亢进症患者术前和术后血清甲状旁腺素和血钙水平
Table 1. Serum levels of parathyroid hormone and blood calcium in 28 patients with hyperparathyroidism before and after operation
-
28例患者中发现可疑性结节55处,其中40处甲旁亢病灶组织(19处腺瘤、20处增生、1处腺癌),15处非甲旁亢病灶组织(1处甲状腺腺瘤样增生、7处结节性甲状腺肿、3处结节性甲状腺肿合并桥本甲状腺炎、2处甲状腺腺瘤、2处桥本甲状腺炎伴重度异型增生)。术后测量腺瘤病灶的平均最大直径为(2.2±1.2)cm,最大直径范围0.6~5.0 cm;增生病灶的平均最大直径为(1.3±0.6)cm,最大直径范围为0.5~2.7 cm。腺瘤病灶的最大直径明显大于增生病灶,且差异有统计学意义(T=234,P=0.01)。
-
不同显像技术对28例甲旁亢患者的诊断效能见表 2。在40处甲旁亢病灶组织和15处非甲旁亢病灶组织中,双时相分别检出19处病灶和2处阳性浓聚灶,其灵敏度、特异度分别为47.5%(19/40)、86.7%(13/15)。双时相诊断甲旁亢病灶为阴性结果的患者中,减影相检出其他5处病灶,提高了病灶检出的灵敏度(60.0% vs. 47.5%),差异有统计学意义(χ2=2.716,P=0.125)。在15处非甲旁亢病灶中,减影相检出4处阳性浓聚灶,由于假阳性浓聚灶的增多,减影相的特异度降低为73.3%(11/15),与双时相相比,多检出2处假阳性浓聚灶(桥本甲状腺炎伴重度异型增生)。SPECT/CT融合相检出甲旁亢病灶组织26处、非甲旁亢浓聚灶1处,SPECT/CT融合相检出的1处假阳性浓聚灶(甲状腺腺瘤样增生)在双时相和减影相上也均表现为阳性浓聚灶。
显像技术 甲旁亢患者(n=28) 原发性甲旁亢患者(n=21) 继发性甲旁亢患者(n=7) 灵敏度 特异度 准确率 灵敏度 特异度 准确率 灵敏度 特异度 准确率 双时相 47.5(19/40) 86.7(13/15) 58.2(32/55) 57.1(13/23) 81.8(9/11) 64.7(22/34) 36.8(6/17) 100.0(4/4) 47.6(10/21) 减影相 60.0(24/40) 73.3(11/15) 63.6(35/55) 76.2(17/23) 63.6(7/11) 70.5(24/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) SPECT/CT融合相 65.0(26/40)a 93.3(14/15)b 72.7(40/55) 85.7(20/23) 90.9(10/11) 88.2(30/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) 双时相+减影相 62.5(25/40)a 73.3(11/15) 65.4(36/55) 80.9(19/23) 63.6(7/11) 76.4(26/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) 双时相+SPECT/CT融合相 65.0(26/40)a 93.3(14/15) 72.7(40/55) 85.7(20/23) 90.9(10/11) 88.2(30/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) 减影相+SPECT/CT融合相 67.5(27/40)a 93.3(14/15) 74.8(41/55) 90.4(21/23) 90.9(10/11) 91.2(31/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) 联合显像 67.5(27/40)a 93.3(14/15) 74.8(41/55) 90.4(21/23) 90.9(10/11) 91.2(31/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) 注:双时相:双时相平面显像;减影相:减影平面显像;SPECT/CT融合相:SPECT/CT融合显像;双时相+减影相:双时相平面显像联合减影平面显像;双时相+SPECT/CT:双时相平面显像联合SPECT/CT融合显像;减影相+SPECT/CT:减影平面显像联合SPECT/CT融合显像;联合显像:双时相平面显像联合减影平面显像及SPECT/CT融合显像。a:与双时相平面显像比较,灵敏度的差异均有统计学意义(χ2=5.024、2.716、5.024、6.635、6.635,均P < 0.05);b:与双时相平面显像比较,特异度的差异有统计学意义(χ2=4.432,P= 0.04)。甲旁亢:甲状旁腺功能亢进症;SPECT/CT:单光子发射计算机体层摄影术。 表 2 不同显像技术对28例甲旁亢患者的诊断效能(%)
Table 2. Diagnostic efficiency of different imaging techniques in 28 patients with hyperparathyroidism(%)
将双时相联合减影相分析,检出甲旁亢病灶25处、非甲旁亢病灶4处;将双时相联合SPECT/CT融合相分析,检出甲旁亢病灶26处、非甲旁亢病灶1处;双时相联合SPECT/CT融合相较双时相联合减影相多检出1处甲旁亢病灶,该腺瘤病灶位于近左叶下极处,直径<1 cm,在平面显像上表现为阴性病灶,而在SPECT/CT断层融合显像上表现为阳性病灶。
减影相联合SPECT/CT融合相与全部联合相诊断效能相同,检出甲旁亢病灶27处、非甲旁亢病灶1处,减影相联合SPECT/CT融合相与双时相联合SPECT/CT融合相比较,同样多检出1处甲旁亢病灶,主要是由于该患者2年前行甲状腺腺瘤切除术,因颈部解剖结构显像不清晰,在SPECT/CT相上表现为阴性病灶,而在减影相上表现为阳性病灶。减影相联合SPECT/CT融合相与双时相的灵敏度和特异度比较均有提高(67.5% vs. 47.5%;93.3% vs. 86.7%),差异均有统计学意义(χ2=6.635,P=0.02;χ2=4.432,P=0.04),
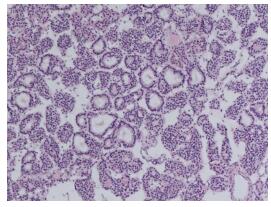
本研究中,4例原发性甲旁亢患者在注射99Tcm-MIBI 5 min时扫描,病灶处出现显像剂的快速浓聚,120 min时该浓聚灶显影减淡,术后病理证实为非典型甲状旁腺腺瘤(图 1)。典型病例见图 2、图 3。

图 1 原发性甲状旁腺功能亢进症患者(女性,58岁)术后病理图(×40,苏木精-伊红染色) 图中,镜下组织见异型细胞增生,腺瘤样排列,细胞核深染,间质血管丰富,诊断结果为非典型甲状旁腺腺瘤。
Figure 1. Postoperative pathological image of a patient with primary hyperthyroidism (×40, hematoxylin-eosin staining)

图 2 原发性甲状旁腺功能亢进患者(女性,58岁)99Tcm-MIBI平面显像图 图中,A:注射99Tcm-MIBI后5 min时(早期相)示甲状腺左叶下极见显像剂聚集(黑色箭头);B:注射99Tcm-MIBI后120 min时(延迟相)示甲状腺左叶下极显像剂聚集区减淡(黑色箭头);C:注射99TcmO4- 20 min时,正常甲状腺显像;D:将图A与图C进行数字化减影(减影相),显示甲状腺左叶下极见显像剂聚集,为甲状旁腺功能亢进病灶。MIBI:甲氧基异丁基异腈;99TcmO4-:99m锝高锝酸钠。
Figure 2. 99Tcm-MIBI planar images of a patient with primary hyperparathyroidism
-
在本研究中,双时相平面显像对28例甲旁亢患者病灶检出的灵敏度为47.5%,其中21例原发性甲旁亢患者病灶检出的灵敏度为57.1%,7例继发性甲旁亢患者病灶检出的灵敏度为36.8%。Adalet等[6]报道双时相对原发性甲旁亢患者病灶检出的灵敏度为71.0%,对继发性甲旁亢患者病灶检出的灵敏度仅为25.0%。另有文献同样报道双时相对继发性甲旁亢患者病灶检出的灵敏度(36.6%)较低[7]。因此,本研究结果符合临床中常用的双时相技术对原发性甲旁亢患者病灶检出的灵敏度高于继发性甲旁亢患者的普遍观点。
本研究在原发性甲旁亢的基础上纳入继发性甲旁亢患者,得出双时相联合减影相及SPECT/CT融合相病灶检出的灵敏度和特异度分别为67.5%和93.3%,该结果与近期一项国外研究同样对甲旁亢患者行联合显像的结论相似(灵敏度为70.6%, 特异度为98.0%)[8],双时相联合减影相及SPECT/CT融合相对甲旁亢患者的术前诊断效能优于单独使用双时相(67.5% vs. 47.5%),差异有统计学意义。
另外,本研究发现双时相联合减影相对甲旁亢患者病灶检出的灵敏度和特异度分别为62.5%和73.3%。双时相联合SPECT/CT融合相对病灶检出的灵敏度和特异度为65.0%和93.3%。两者的灵敏度均低于减影相联合SPECT/CT融合相或全部联合相的灵敏度(67.5%),但三者之间的灵敏度差异无统计学意义。就病灶检出的特异度而言,双时相联合减影相低于其他联合显像方式(73.3% vs. 93.3%),差异有统计学意义。因此,我们认为双时相联合SPECT/CT融合相、减影相联合SPECT/CT融合相、全部联合显像相对甲旁亢病灶的诊断效能相同。由于减影相联合SPECT/CT融合相的诊断效能等同于全部联合相,因此对于甲旁亢患者的术前诊断,减影相联合SPECT/CT融合相可以代替全部联合相,减少患者检查的等待时间。
双时相联合SPECT/CT融合相或减影相联合SPECT/CT融合相优于单独使用双时相,主要是由于SPECT/CT融合显像和减影平面显像分别有各自的显像技术优势和不足。SPECT/CT融合可以提供精准的三维影像学信息,增加甲旁亢病灶检出的灵敏度,Monzen等[9]报道了SPECT/CT融合显像可以检出甲状旁腺腺瘤的最大直径为0.6 cm,而平面显像只能检出腺瘤的最大直径为1.0~1.2 cm。本研究中1例腺瘤病灶位于右叶近下极处(最大直径为0.6 cm),在平面显像上表现为阴性病灶,在SPECT/CT融合显像上则表现为阳性显像剂浓聚灶。
本研究中SPECT/CT融合相的灵敏度高于减影相(65.0% vs. 60.0%),但差异无统计学意义。其原因可能与样本量较小相关,但是当颈部解剖学结构不清晰或合并甲状腺疾病影响SPECT/CT融合相的定性定位诊断时,减影相可以利用99TcmO4-单独被甲状腺摄取的原理,检出由甲状腺结节摄取99Tcm-MIBI引起的假阳性病灶以及非典型腺瘤对于99Tcm-MIBI快速清除所引起的假阴性病灶[10-11]。本研究中1例位于近左叶下极处的甲状旁腺腺瘤,因该患者有甲状腺腺瘤切除手术史,颈部SPECT/CT解剖结构显像不清晰表现为假阴性病灶,但在减影相上由于99TcmO4-未被甲状旁腺腺瘤摄取而表现为阳性病灶。本研究中减影相中3例假阳性病灶,术后经病理证实为桥本甲状腺炎,因此单独的依靠减影相进行定位诊断有一定的错误风险,图像的标准化以及患者体位的移动都能造成图像错误地阅读。造成99Tcm-MIBI核素显像假阳性结果主要是由甲旁亢患者合并甲状腺疾病引起[12],甲状腺结节、甲状腺炎对于99Tcm-MIBI的摄取明显高于正常的甲状腺组织。一项回顾性研究分析了116例合并甲状腺疾病的原发性甲旁亢患者,在99Tcm-MIBI双时相平面显像的基础上,加做99TcmO4-甲状腺显像,可以提高病灶的检出率,降低假阳性病灶的数目[13]。本研究中减影相较双时相有更高的灵敏度,当甲状旁腺瘤伴发结节性甲状腺肿时,减影相可以排除部分结节性甲状腺肿,但也存在特异度降低的问题。本研究因病例数较少,研究结果显示联合显像特异度较单独显像并未降低。Shafiei等[14]研究结果发现,SPECT/CT融合显像较双时相平面显像在甲状腺结节的鉴别方面也提高了病灶检出的灵敏度。
联合显像发挥了各自显像技术的优势,对可疑病灶相互验证,从而提高了影像学的诊断效能。因此,本研究认为对于甲旁亢患者在常规双时相平面显像的基础上联合减影平面显像及SPECT/CT融合显像,较单独行双时相平面显像可以提高患者病灶的检出率。
SPECT/CT双时相联合减影技术诊断甲状旁腺功能亢进症的增益价值
Incremental value of SPECT/CT fusion imaging with dual-phase and dual-tracer technique in the diagnostic localization of parathyroid lesions in patients with hyperparathyroidism
-
摘要:
目的探讨在99Tcm-MIBI双时相平面显像的基础上联合减影平面显像及SPECT/CT融合显像对甲状旁腺功能亢进症(以下简称甲旁亢)患者术前诊断的增益价值。 方法2015年3月至2016年3月序贯纳入本院甲旁亢患者28例。所有患者行放射性核素显像前1~2周检测血清甲状腺旁腺激素(PTH)及血钙值。静脉注射99TcmO4-40~60 MBq后行甲状腺99TcmO4-显像;待采集结束后,再次静脉注射99Tcm-MIBI 600 MBq,行早期99Tcm-MIBI平面显像,后行SPECT/CT融合显像。在行99Tcm-MIBI延迟平面显像后,获得减影平面显像。以病理诊断结果为金标准,计算各显像技术的诊断效能。显像技术检出病灶数据的比较采用配对卡方检验,其他数值型变量采用Wilcoxon秩和检验。 结果原发性和继发性甲旁亢患者术前检测PTH水平分别为(102.4±88.8)、(98.2±53.6)pmol/L,血钙水平分别为(2.9±0.3)、(1.9±0.2)mmol/L。28例甲旁亢患者共发现可疑性结节55处,其中40处甲旁亢病灶,15处非甲旁亢病灶。双时相检出19处病灶和2处阳性浓聚灶,其灵敏度为47.5%(19/40)。在双时相诊断甲旁亢病灶为阴性结果的患者中,减影相检出其他5处病灶,提高了病灶检出的灵敏度(60.0%),差异有统计学意义(χ2=2.716,P=0.125)。SPECT/CT融合显像检出甲旁亢病灶26处,将双时相和减影相联合分析,检出甲旁亢病灶25处、非甲旁亢病灶4处;将双时相联合SPECT/CT融合显像分析,检出甲旁亢病灶26处、非甲旁亢病灶1处。减影相联合SPECT/CT融合显像与全部联合显像诊断效能相同,检出甲旁亢病灶27处、非甲旁亢病灶1处,其灵敏度和特异度较双时相(67.5% vs.47.5%和93.3% vs.86.7%)提高,差异均有统计学意义(χ2=6.635,P=0.02;χ2=4.432,P=0.04)。 结论甲旁亢患者在行常规双时相平面显像的基础上联合减影平面显像及SPECT/CT融合显像,较单纯行双时相平面显像可以提高患者病灶的检出率。 -
关键词:
- 甲状旁腺功能亢进症 /
- 放射性核素显像 /
- 单光子发射计算机体层摄影术 /
- 甲状旁腺腺瘤
Abstract:ObjectiveTo investigate the increasing value of SPECT/CT fusion imaging with a dual-phase and dual-tracer technique for localizing parathyroid lesions in an unselected patient cohort with hyperparathyroidism. MethodsPatients with biochemically confirmed hyperparathyroidism were included in a prospective trial. The baseline values of all laboratory parameters were determined 1-2 weeks before 99Tcm-MIBI parathyroid scintigraphy was performed. Afterward, 40-60 MBq 99TcmO4- was injected with static thyroid image acquisition, followed by 600 MBq 99Tcm-MIBI injection. SPECT/CT was acquired immediately. With 99Tcm-MIBI additional delayed imaging were acquired. Patients were subjected to a subtraction protocol. Surgical and histological findings were used as the standard of comparison, sensitivity and specificity were calculated, and McNemar test and Wilcoton test were conducted to compare them at a significant level of 0.05. ResultsThe preoperative parathyroid hormone(PTH) levels of primary and secondary hyperparathyroidism were (102.4±88.8), (98.2±53.6) pmol/L, and the serum calcium level was (2.9±0.3), (1.9±0.2) mmol/L respectively. After surgical examination was completed, 40 enlarged parathyroid glands were found in 28 patients. Of these patients, 21 had single adenoma, and 7 had a multi-gland disease. The dual-phase technique could be used to accurately detect and diagnose parathyroid disease in 19 of 40 histological samples. The sensitivity and specificity for parathyroid disease localization were 47.5%(19/40). For those who yielded negative results and underwent the subtraction phase, five other lesions were detected, indicating an increased detection sensitivity(60.0%), the difference was significant(χ2=2.761, P=0.125). Furthermore, 26 of 40 histological samples were diagnosed with SPECT/CT fusion imaging, 25 hyperparathyroidism lesions were detected with dual-phase and subtraction-combined analysis, and 26 of 40 histological samples were accurately diagnosed with dual-phase combined with SPECT/CT fusion imaging. Subtraction-combined SPECT/CT fusion imaging and all combined scintigraphy diagnostic values exhibited the same performance. The sensitivity and specificity of the proposed method significantly improved compared with those of the dual-phase technique(67.5% vs. 47.5%, χ2=6.635, P=0.02; 93.3% vs. 86.7%, χ2=4.432, P=0.04). ConclusionFor patients with hyperparathyroidism, the detection rate of lesions by conventional dual-phase plane imaging combined with subtraction plane imaging and SPECT/CT fusion imaging was improved compared with that by single-and dual-phase plane imaging. -
图 2 原发性甲状旁腺功能亢进患者(女性,58岁)99Tcm-MIBI平面显像图 图中,A:注射99Tcm-MIBI后5 min时(早期相)示甲状腺左叶下极见显像剂聚集(黑色箭头);B:注射99Tcm-MIBI后120 min时(延迟相)示甲状腺左叶下极显像剂聚集区减淡(黑色箭头);C:注射99TcmO4- 20 min时,正常甲状腺显像;D:将图A与图C进行数字化减影(减影相),显示甲状腺左叶下极见显像剂聚集,为甲状旁腺功能亢进病灶。MIBI:甲氧基异丁基异腈;99TcmO4-:99m锝高锝酸钠。
Figure 2. 99Tcm-MIBI planar images of a patient with primary hyperparathyroidism
表 1 28例甲状旁腺功能亢进症患者术前和术后血清甲状旁腺素和血钙水平
Table 1. Serum levels of parathyroid hormone and blood calcium in 28 patients with hyperparathyroidism before and after operation
组别 血清甲状旁腺素(pmol/L) 血钙(mmol/L) 术前 术后 术前 术后 原发性甲旁亢患者(n=21) 102.4±88.8 6.8±3.1 2.9±0.3 2.9±0.3 继发性甲旁亢患者(n=7) 98.2±53.6 8.8±5.1 1.9±0.2 2.1±0.3 注:表中,血清甲状旁腺激素、血钙值均为术前2耀3 d及术后6个月的随访值。甲旁亢:甲状腺功能亢进症。 表 2 不同显像技术对28例甲旁亢患者的诊断效能(%)
Table 2. Diagnostic efficiency of different imaging techniques in 28 patients with hyperparathyroidism(%)
显像技术 甲旁亢患者(n=28) 原发性甲旁亢患者(n=21) 继发性甲旁亢患者(n=7) 灵敏度 特异度 准确率 灵敏度 特异度 准确率 灵敏度 特异度 准确率 双时相 47.5(19/40) 86.7(13/15) 58.2(32/55) 57.1(13/23) 81.8(9/11) 64.7(22/34) 36.8(6/17) 100.0(4/4) 47.6(10/21) 减影相 60.0(24/40) 73.3(11/15) 63.6(35/55) 76.2(17/23) 63.6(7/11) 70.5(24/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) SPECT/CT融合相 65.0(26/40)a 93.3(14/15)b 72.7(40/55) 85.7(20/23) 90.9(10/11) 88.2(30/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) 双时相+减影相 62.5(25/40)a 73.3(11/15) 65.4(36/55) 80.9(19/23) 63.6(7/11) 76.4(26/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) 双时相+SPECT/CT融合相 65.0(26/40)a 93.3(14/15) 72.7(40/55) 85.7(20/23) 90.9(10/11) 88.2(30/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) 减影相+SPECT/CT融合相 67.5(27/40)a 93.3(14/15) 74.8(41/55) 90.4(21/23) 90.9(10/11) 91.2(31/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) 联合显像 67.5(27/40)a 93.3(14/15) 74.8(41/55) 90.4(21/23) 90.9(10/11) 91.2(31/34) 42.1(7/17) 100.0(4/4) 52.4(11/21) 注:双时相:双时相平面显像;减影相:减影平面显像;SPECT/CT融合相:SPECT/CT融合显像;双时相+减影相:双时相平面显像联合减影平面显像;双时相+SPECT/CT:双时相平面显像联合SPECT/CT融合显像;减影相+SPECT/CT:减影平面显像联合SPECT/CT融合显像;联合显像:双时相平面显像联合减影平面显像及SPECT/CT融合显像。a:与双时相平面显像比较,灵敏度的差异均有统计学意义(χ2=5.024、2.716、5.024、6.635、6.635,均P < 0.05);b:与双时相平面显像比较,特异度的差异有统计学意义(χ2=4.432,P= 0.04)。甲旁亢:甲状旁腺功能亢进症;SPECT/CT:单光子发射计算机体层摄影术。 -
[1] Hindié E, Ugur O, Fuster D, et al. 2009 EANM parathyroid guidelines[J]. Eur J Nucl Med Mol Imaging, 2009, 36(7):1201-1216. DOI:10.1007/s00259-009-1131-z. [2] Tunninen V, Varjo P, Schildt J, et al. Comparison of five parathyroid scintigraphic protocols[J/OL]. Int J Mol Imaging, 2013, 2013: 921260[2017-11-27]. https: //www. ncbi. nlm. nih. gov/pubmed/23431436. DOI: 10.1155/2013/921260. [3] Lavely WC, Goetze S, Friedman KP, et al. Comparison of SPECT/CT, SPECT, and planar imaging with single- and dual-phase 99mTc-sestamibi parathyroid scintigraphy[J]. J Nucl Med, 2007, 48(7):1084-1089. DOI:10.2967/jnumed.107.040428. [4] Koljević Marković A, Janković MM, Marković I, et al. Parathyroid dual tracer subtraction scintigraphy:small regions method for quantitative assessment of parathyroid adenoma uptake[J]. Ann Nucl Med, 2014, 28(8):736-745. DOI:10.1007/s12149-014-0867-0. [5] Caveny SA, Klingensmith WC, Martin WE, et al. Parathyroid imaging:the importance of dual-radiopharmaceutical simultaneous acquisition with 99mTc-sestamibi and 123I[J]. J Nucl Med Technol, 2012, 40(2):104-110. DOI:10.2967/jnmt.111.098400. [6] Adalet I, Hawkins T, Clark F, et al.Thallium-technetium-subtraction scintigraphy in secondary hyperparathyroidism[J]. Eur J Nucl Med, 1994, 21(6):509-513. [7] Lai EC, Ching AS, Leong HT. Secondary and tertiary hyperparathyroidism: role of preoperative localization[J]. ANZ J Surg, 2007, 77(10):880-882. DOI:10.1111/j.1445-2197. 2007. 04264.x. [8] Berner AM, Haroon A, Nowosinska E, et al. Localization of parathyroid disease with 'sequential multiphase and dual-tracer' technique and comparison with neck ultrasound[J]. Nucl Med Commun, 2015, 36(1):45-52. DOI:10.1097/MNM.000000000000-0215. [9] Monzen Y, Tamura A, Okazaki H, et al. SPECT/CT fusion in the diagnosis of hyperparathyroidism[J]. Asia Ocean J Nucl Med Biol, 2015, 3(1):61-65. [10] Burke JF, Naraharisetty K, Schneider DF, et al. Early-phase technetium-99m sestamibi scintigraphy can improve preoperative localization in primary hyperparathyroidism[J]. Am J Surg, 2013, 205(3):269-273. DOI:10.1016/j.amjsurg.2013. 01. 001. [11] Martínez-Rodríguez I, Banzo I, Quirce R, et al. Early planar and early SPECT Tc-99m sestamibi imaging: can it replace the dual-phase technique for the localization of parathyroid adenomas by omitting the delayed phase?[J]. Clin Nucl Med, 2011, 36(9):749-753. DOI:10.1097/RLU.0b013e318217568a. [12] Nichols KJ, Tronco GG, Palestro CJ. Influence of multigland parathyroid disease on 99mTc-Sestamibi SPECT/CT[J]. Clin Nucl Med, 2016, 41(4):282-288. DOI:10.1097/RLU.0000000000001115. [13] Powell DK, Nwoke F, Goldfarb RC, et al. Tc-99m sestamibi parathyroid gland scintigraphy: added value of Tc-99m pertechnetate thyroid imaging for increasing interpretation confidence and avoiding additional testing[J]. Clin Imaging, 2013, 37(3):475-479. DOI:10.1016/j.clinimag.2012.09.017. [14] Shafiei B, Hoseinzadeh S, Fotouhi F, et al. Preoperative 99mTc-sestamibi scintigraphy in patients with primary hyperparathyroidism and concomitant nodular goiter:comparison of SPECT-CT, SPECT, and planar imaging[J]. Nucl Med Commun, 2012, 33(10):1070-1076. DOI:10.1097/MNM.0b013e32835710b6. -





 下载:
下载: