-
肺癌是临床最常见的恶性肿瘤之一,其发病率及病死率近年来呈上升趋势。其中非小细胞肺癌(non-small cell lung cancer,NSCLC)患者占70%~80%,且21%~50%的NSCLC患者诊断时已有区域淋巴结转移[1]。NSCLC患者的诊断及准确分期(尤其是纵隔淋巴结分期)对其治疗方案的制定及预后非常重要。目前应用PET/CT诊断NSCLC纵隔淋巴结转移的报道较多,但尚缺少系统性的评价。我们通过Meta分析的方法对已发表文献进行统计分析及评价,以期为PET/CT诊断NSCLC纵隔淋巴结转移的准确性判断提供循证医学证据。
-
以“PET/CT或PET-CT”、“非小细胞肺癌”和“纵隔淋巴结转移”为检索词检索万方数据库、中国知网(China National Knowledge Infrastructure,CNKI)、维普数据库;以“PET/CT”或“PET-CT”或“positron tomography/computed tomography”、“non-small cell lung cancer”或“NSCLC”和“mediastinal lymph-nodal metastasis”为检索词检索PubMed、Embase、Cochrane Library数据库;检索文献发表时间为1990年至2016年。语言限中文和英文。
-
纳入标准:①研究对象为初诊或复发未经化疗和放疗的NSCLC患者而非病灶;②有“金标准”(手术切除病理结果)证实;③研究目的为评价18F-FDG PET/CT在NSCLC纵隔淋巴结转移中的诊断价值;④能间接或直接提供完整四格表,包含真阳性、假阳性、真阴性和假阴性,且患者数≥10。排除标准:①以病灶(转移淋巴结的个数)为研究对象;②会议摘要、讲座和评述类等数据不完整的文献;③无“金标准”证实的研究;④样本量 < 10的研究。
-
由2位研究者根据纳入与排除标准独立筛选文献、提取资料,如遇分歧讨论解决。内容包括纳入研究的一般信息(如出版年份、样本量、设备名称、“金标准”、研究类型等)、四格表内容(真阳性、假阳性、真阴性、假阴性)及研究对象的年龄、性别等。
-
本研究采用QUADAS(quality assessment of diagnostic accuracy studies)评价表[2]对纳入文献进行方法学评估。该表包含14个子项(其中3项为非必须评价条目),每条以“是”、“不清楚”或“否”作出评价,分别记为1、0.5和0分。为保证文献质量,本研究仅纳入评分≥8分的文献。此外,对于评价结果不一致的数据,讨论一致后决定。
-
采用Meta-Disc 1.40软件进行统计学分析。①探讨异质性及其来源,主要评价有无阈值效应。绘制综合受试者工作特征(summary receiver operating characteristic,SROC)曲线,SROC曲线图检验若呈“肩臂”状分布,则提示存在阈值效应。也可计算灵敏度对数与(1-特异度)对数的Spearman相关系数,评价阈值效应是否存在,P>0.05表示不存在阈值效应。②评价非阈值效应。对灵敏度、特异度、阳性似然比(positive likelihood ratio,PLR)、阴性似然比(negative likelihood ratio,NLR)、诊断比值比(diagnostic odds ratio,DOR)行Cochran Q检验,分别计算P值。若P>0.05,则无异质性,采用固定效应模型;若P≤0.05,则存在异质性,采用随机效应模型。③合并灵敏度、特异度和DOR进行Cochran Q检验,计算SROC曲线的曲线下面积(area under curve,AUC)。0.5<AUC ≤0.7为诊断价值较低;0.7<AUC≤0.9为诊断价值中等;0.9以上为诊断价值较高。④对不同地区、是否接受增强扫描、是否曾患肺结核3个因素进行亚组分析,采用两样本t检验分析,对应结果以灵敏度(95%CI)和特异度(95%CI)表示。P < 0.05为差异有统计学意义。
-
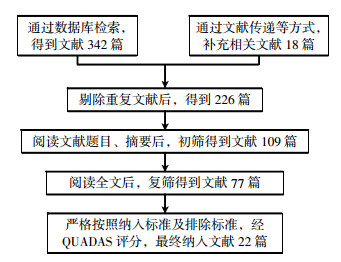
共检索到相关文献360篇,经逐层筛选后(图 1),共纳入22篇文献[3-24],包括患者2543例。纳入研究的基本特征见表 1。
第一作者 年份 国家 设备公司 总例数 真阳性/例 假阳性/例 真阴性/例 QUADAS评分/分 灵敏度(95%CI) 特异度(95%CI) 徐白萱[3] 2003年 中国 Siemens 70 10 0 56 10.5 1.00(0.69~1.00) 0.93(0.84~0.98) 杨衿记[4] 2004年 中国 GE 31 14 4 10 11 0.78(0.52~0.94) 0.77(0.46~0.95) Halpern[5] 2005年 奥地利 无 36 6 4 22 11 0.60(0.26~0.88) 0.85(0.65~0.96) Kim[6] 2007年 韩国 GE 248 110 70 47 12 0.61(0.54~0.68) 0.69(0.57~0.80) Lee[7] 2007年 韩国 GE 126 24 4 79 10 0.86(0.67~0.96) 0.81(0.71~0.88) Hwangbo[8] 2009年 韩国 Siemens 117 21 9 52 11 0.70(0.51~0.85) 0.60(0.49~0.70) Lee[9] 2009年 韩国 Philips 41 7 12 19 11.5 0.37(0.16~0.62) 0.86(0.65~0.97) 李向东[10] 2010年 中国 Siemens 158 41 8 97 10 0.84(0.70~0.93) 0.89(0.82~0.94) Tasci[11] 2010年 土耳其 Siemens 127 17 2 89 11 0.89(0.67~0.99) 0.82(0.74~0.89) Darling[12] 2011年 加拿大 无 149 19 18 101 12 0.51(0.34~0.68) 0.90(0.83~0.95) Sommer[13] 2012年 瑞士 GE 31 2 4 24 10 0.33(0.04~0.78) 0.96(0.80~1.00) Saydam[14] 2012年 土耳其 无 42 16 3 15 12 0.84(0.60~0.97) 0.65(0.43~0.84) Harders[15] 2012年 丹麦 Siemens 114 15 15 62 10 0.50(0.31~0.69) 0.74(0.63~0.83) Kuo[16] 2012年 中国 GE 102 10 9 66 9.5 0.53(0.29~0.76) 0.80(0.69~0.88) 许泽清[17] 2013年 中国 GE 130 51 17 55 11 0.75(0.63~0.85) 0.89(0.78~0.95) Koksal[18] 2013年 土耳其 Siemens 81 8 4 47 11 0.67(0.35~0.90) 0.68(0.56~0.79) Billè[19] 2013年 意大利 GE 353 28 32 280 12 0.47(0.34~0.60) 0.96(0.93~0.98) Booth[20] 2013年 英国 Philips 64 3 7 47 11 0.30(0.07~0.65) 0.87(0.75~0.95) Li[21] 2013年 中国 GE 219 49 17 112 12 0.74(0.62~0.84) 0.73(0.65~0.80) Xu[22] 2014年 中国 GE 130 57 34 28 10 0.63(0.52~0.73) 0.72(0.55~0.85) Moloney[23] 2014年 爱尔兰 GE 92 22 7 51 12 0.76(0.56~0.90) 0.81(0.69~0.90) 黄占文[24] 2015年 中国 Philips 82 26 10 39 9 0.72(0.55~0.86) 0.85(0.71~0.94) 注:总灵敏度为0.66(0.62~0.69),χ2=73.19,υ=21,P < 0.01,I2=71.3%;总特异度为0.82(0.80~0.84),χ2=129.25,υ=21,P < 0.01,I2=83.8%。QUADAS:quality assessment of diagnostic accuracy studies。 表 1 纳入文献基本信息及汇总分析指标
Table 1. Basic information of the include literature and summary analysis
-
① 阈值效应分析。SROC曲线不呈典型的“肩臂状”分布,提示不存在阈值效应;Spearman相关系数为0.21,P>0.05,亦支持不存在阈值效应。合并相关数据得到:总灵敏度为0.66(0.62~0.69),总特异度为0.82(0.80~0.84),总PLR为3.60(2.82~4.58),总NLR为0.45(0.37~0.54),总DOR为9.12(6.15~13.52),AUC为0.826。PLR对应Q值为79.50,I2=73.6%;NLR对应的Q值为65.84,I2=68.1%;DOR对应Q值为59.96,I2=65%,P < 0.05,提示存在非阈值效应引起的异质性。SROC曲线见图 2。

图 2 18F-FDG PET/CT诊断2543例NSCLC纵隔淋巴结转移的综合受试者工作特征曲线
Figure 2. The summary receiver operating characteristic curve of 18F-FDG PET/CT in the diagnosis of mediastinal lymph node metastasis in 2543 cases non-small cell lung cancer
② 亚组分析。亚洲地区的15项研究(患者1704例)与非亚洲地区的7项研究(患者839例)比较,两者PET/CT对NSCLC纵隔淋巴结转移诊断的灵敏度和特异度差异均无统计学意义[灵敏度:0.69(0.66~0.73)与0.68(0.65~0.72);特异度:0.78(0.75~0.80)与0.79(0.76~0.81),t=0.31、1.96,均P>0.05]。
患者接受增强扫描的5项研究(患者428例)与未接受增强扫描的17项研究(患者2115例)比较,两者PET/CT对NSCLC纵隔淋巴结转移诊断的灵敏度和特异度差异均无统计学意义[灵敏度:0.73(0.63~0.83)与0.63(0.58~0.81);特异度:0.81(0.71~0.88)与0.83(0.77~0.89);t=1.29、0.72,均P>0.05]。
患者有肺结核病史的4项研究(患者178例)与患者无肺结核病史的9项研究(患者1181例)比较,两者PET/CT对NSCLC纵隔淋巴结转移诊断的灵敏度差异无统计学意义[0.75(0.67~0.85)与0.71(0.66~0.75),t=1.63,P>0.05];而特异度差异有统计学意义[0.79(0.72~0.84)与0.89(0.82~0.92),t=2.98,P < 0.05]。
-
诊断纵隔淋巴结有无转移对NSCLC患者分期非常重要,会直接影响患者治疗方案的制定及疾病预后。出现纵隔淋巴结转移的患者(即处于N2或N3期)的手术机会很小,需改行放化疗方案。因此,一旦NSCLC诊断成立,必须立即明确疾病分期。
本项Meta分析共纳入文献22篇,包括2543例患者。结果显示:采用18F-FDG PET/CT诊断NSCLC纵隔淋巴结转移的总灵敏度为0.66,总特异度为0.82,说明其诊断纵隔淋巴结转移与否具有较高的特异度,而灵敏度略差,与白璐等[25]报道的结果相近。SROC曲线的AUC为0.826,表明18F-FDG PET/CT具有中等诊断价值。
本项Meta分析结果提示,研究存在非阈值效应引起的异质性,进一步的亚组分析结果显示,患者有无肺结核病史对PET/CT诊断特异度有影响。淋巴结结核是感染性病变,如果和NSCLC的转移发生在相近位置,易被误诊。CT、MR等影像学检查多是根据淋巴结大小来鉴别转移与否,一般将直径>1 cm者定义为肿大淋巴结。恶性肿瘤患者出现肿大淋巴结一般认为发生转移,但通过一系列的临床总结,笔者发现肿大的淋巴结不一定是转移[26]。除此之外,纵隔淋巴结的钙化程度及患者血糖水平也是18F-FDG PET/CT诊断NSCLC纵隔淋巴结转移的重要影响因素。转移淋巴结很少出现钙化,钙化淋巴结常为炎性病变的表现;18F-FDG PET/CT检查过程中,若患者血糖水平高于正常值,则在图像上会出现组织器官弥漫性浓聚,这会对诊断造成影响。因此,诊断医师需全面了解患者既往史。其他分组(不同地区、有无接受增强扫描)灵敏度与特异度差异均无统计学意义,说明本研究的异质性较小、可信度较高。
本研究也存在一定局限性,纳入的研究中显像剂使用剂量存在差异、仪器型号也不尽相同,相关研究结果可能存在一定的发表偏倚。综上,本项Meta分析结果表明,18F-FDG PET/CT诊断NSCLC纵隔淋巴结转移的特异度较高,可为NSCLC提供准确分期,有利于治疗方案的确定。
18F-FDG PET/CT对非小细胞肺癌纵隔淋巴结转移诊断价值的Meta分析
Diagnostic value of 18F-FDG PET/CT in the diagnosis of mediastinal lymph node metastasis in non-small cell lung cancer: a Meta-analysis
-
摘要:
目的用Meta分析的方法评估18F-FDG PET/CT对于非小细胞肺癌(NSCLC)纵隔淋巴结转移的诊断价值。 方法通过检索万方数据库、中国知网、维普数据库、PubMed、Embase、Cochrane Library数据库,根据相应的检索词,收集1990年至2016年的所有PET/CT对NSCLC纵隔淋巴结诊断的发表文献,通过严格的纳入排除标准进行筛选,提取纳入文献中PET/CT对NSCLC纵隔淋巴结诊断的灵敏度、特异度、阳性似然比(PLR)、阴性似然比(NLR)、诊断比值比(DOR)并进行分析。阈值效应分析采用计算曲线下面积;亚组分析采用t检验。 结果共纳入文献22篇,患者2543例。以患者为研究对象,总灵敏度为0.66(0.62~0.69),总特异度为0.82(0.80~0.84),总PLR为3.60(2.82~4.58),总NLR为0.45(0.37~0.54),总DOR为9.12(6.15~13.52),曲线下面积为0.826。亚组分析结果显示,患有肺结核病史的与无肺结核病史的特异度差异有统计学意义(t=2.98,P < 0.05),提示肺结核病史是影响PET/CT诊断NSCLC纵隔淋巴结转移的一个重要因素。 结论18F-FDG PET/CT是诊断NSCLC纵隔淋巴结转移的良好方法,可为NSCLC提供准确分期。 -
关键词:
- 癌, 非小细胞肺 /
- 淋巴结转移 /
- 正电子发射断层显像术 /
- 体层摄影术, X线计算机 /
- 氟脱氧葡萄糖F18 /
- Meta分析
Abstract:ObjectiveTo assess the diagnostic value of 18F-FDG PET/CT on mediastinal lymph node(MLN) metastasis in non-small cell lung cancer(NSCLC) by Meta analysis. MethodsPublications on MLN staging of NSCLC by PET/CT published from 1990 to 2016 were filtered and assessed according to the criteria from Wanfang, China National Knowledge Infrastructure, Vip database, PubMed, Embase, Cochrane Library database. Receiver operating characteristic curve analysis was applied and senstivity, specificity, positive likelihood ratio(PLR), negative likelihood ratio(NLR), diagnostic odds ratio(DOR) were calculated. The threshold effect analysis uses the area under the calculated curve. Subgroup analysis adopted t test. ResultsTwenty-two relevant literatures were enrolled (including 2543 patients). Meta analysis showed that the pooled senstivity, specificity, PLR, NLR and DOR were 0.66(0.62-0.69), 0.82(0.80-0.84), 3.60(2.82-4.58), 0.45(0.37-0.54), 9.12(6.15-13.52), respectively. Area under curve was 0.826. The results of subgroup analysis suggested that there was a statistically significant difference between the history of tuberculosis and no history of tuberculosis, and pulmonary tuberculosis was one important factor which influenced the PET/CT diagnosis of MLN metastasis in NSCLC patients. ConclusionPET/CT has a high accuracy for the MLN staging in NSCLC patients. -
表 1 纳入文献基本信息及汇总分析指标
Table 1. Basic information of the include literature and summary analysis
第一作者 年份 国家 设备公司 总例数 真阳性/例 假阳性/例 真阴性/例 QUADAS评分/分 灵敏度(95%CI) 特异度(95%CI) 徐白萱[3] 2003年 中国 Siemens 70 10 0 56 10.5 1.00(0.69~1.00) 0.93(0.84~0.98) 杨衿记[4] 2004年 中国 GE 31 14 4 10 11 0.78(0.52~0.94) 0.77(0.46~0.95) Halpern[5] 2005年 奥地利 无 36 6 4 22 11 0.60(0.26~0.88) 0.85(0.65~0.96) Kim[6] 2007年 韩国 GE 248 110 70 47 12 0.61(0.54~0.68) 0.69(0.57~0.80) Lee[7] 2007年 韩国 GE 126 24 4 79 10 0.86(0.67~0.96) 0.81(0.71~0.88) Hwangbo[8] 2009年 韩国 Siemens 117 21 9 52 11 0.70(0.51~0.85) 0.60(0.49~0.70) Lee[9] 2009年 韩国 Philips 41 7 12 19 11.5 0.37(0.16~0.62) 0.86(0.65~0.97) 李向东[10] 2010年 中国 Siemens 158 41 8 97 10 0.84(0.70~0.93) 0.89(0.82~0.94) Tasci[11] 2010年 土耳其 Siemens 127 17 2 89 11 0.89(0.67~0.99) 0.82(0.74~0.89) Darling[12] 2011年 加拿大 无 149 19 18 101 12 0.51(0.34~0.68) 0.90(0.83~0.95) Sommer[13] 2012年 瑞士 GE 31 2 4 24 10 0.33(0.04~0.78) 0.96(0.80~1.00) Saydam[14] 2012年 土耳其 无 42 16 3 15 12 0.84(0.60~0.97) 0.65(0.43~0.84) Harders[15] 2012年 丹麦 Siemens 114 15 15 62 10 0.50(0.31~0.69) 0.74(0.63~0.83) Kuo[16] 2012年 中国 GE 102 10 9 66 9.5 0.53(0.29~0.76) 0.80(0.69~0.88) 许泽清[17] 2013年 中国 GE 130 51 17 55 11 0.75(0.63~0.85) 0.89(0.78~0.95) Koksal[18] 2013年 土耳其 Siemens 81 8 4 47 11 0.67(0.35~0.90) 0.68(0.56~0.79) Billè[19] 2013年 意大利 GE 353 28 32 280 12 0.47(0.34~0.60) 0.96(0.93~0.98) Booth[20] 2013年 英国 Philips 64 3 7 47 11 0.30(0.07~0.65) 0.87(0.75~0.95) Li[21] 2013年 中国 GE 219 49 17 112 12 0.74(0.62~0.84) 0.73(0.65~0.80) Xu[22] 2014年 中国 GE 130 57 34 28 10 0.63(0.52~0.73) 0.72(0.55~0.85) Moloney[23] 2014年 爱尔兰 GE 92 22 7 51 12 0.76(0.56~0.90) 0.81(0.69~0.90) 黄占文[24] 2015年 中国 Philips 82 26 10 39 9 0.72(0.55~0.86) 0.85(0.71~0.94) 注:总灵敏度为0.66(0.62~0.69),χ2=73.19,υ=21,P < 0.01,I2=71.3%;总特异度为0.82(0.80~0.84),χ2=129.25,υ=21,P < 0.01,I2=83.8%。QUADAS:quality assessment of diagnostic accuracy studies。 -
[1] 段晓蓓, 樊卫, 许泽清, 等.基于18F-FDG PET/CT显像分析非小细胞肺癌纵隔淋巴结转移的危险因素[J].中国医学影像技术, 2012, 28(6):1135-1139.
Duan XB, Fan W, Xu ZQ, et al. Analysis of risk factors for mediastinal lymph nodes metastases in non-small cell lung cancer patients with 18F-FDG PET/CT[J]. Chin J Med Imaging Technol, 2012, 28(6):1135-1139.[2] Penny Whiting, Anne WS Rutjes, Johannes B Reitsma, 等. QUADAS的制定:用于系统评价中评价诊断性研究质量的工具[J].中国循证医学杂志, 2007, 7(4):296-306. DOI:10.3969/j.issn.1672-2531.2007.04.009.
Penny WG, Anne WSR, Johannes BR, et al. The development of QUADAS:a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews[J]. Chin J Evid-based Med, 2007, 7(4):296-306. doi: 10.3969/j.issn.1672-2531.2007.04.009[3] 徐白萱, 刘雁翎, 姚树林, 等. FDG PET对非小细胞肺癌纵隔淋巴结分期的价值[J].中国肺癌杂志, 2003, 6(3):198-200. DOI:10.3779/j.issn.1009-3419.2003.03.09.
Xu BX, Liu YL, Yao SL, et al. Value of FDG PET for mediastinal lymph node staging in non-small cell lung cancer[J]. Chin Lung Cancer, 2003, 6(3):198-200. doi: 10.3779/j.issn.1009-3419.2003.03.09[4] 杨衿记, 吴一龙, 唐安戊, 等. 18F-FDG PET诊断非小细胞肺癌纵隔淋巴结转移的初步临床研究[J].岭南现代临床外科, 2004, 4(3):215-217. DOI:10.3969/j.issn.1009-976X.2004.03.022.
Yang JJ, Wu YL, Tang AW, et al. The preliminary clinical study of 18F-FDG PET on diagnosing the metastasis of the mediastinal lymph nodes of NSCLC[J]. Lingnan Mod Clin Surg, 2004, 4(3):215-217. doi: 10.3969/j.issn.1009-976X.2004.03.022[5] Halpern BS, Schiepers C, Weber WA, et al. Presurgical staging of non-small cell lung cancer:positron emission tomography, integrated positron emission tomography/CT, and software image fusion[J]. Chest, 2005, 128(4):2289-2297. DOI:10.1378/chest.128.4.2289. [6] Kim YK, Lee KS, Kim BT, et al. Mediastinal nodal staging of nonsmall cell lung cancer using integrated 18F-FDG PET/CT in a tuberculosis-endemic country:diagnostic efficacy in 674 patients[J]. Cancer, 2007, 109(6):1068-1077. DOI:10.1002/cncr.22518. [7] Lee PC, Port JL, Korst RJ, et al. Risk Factors for occult mediastinal metastases in clinical stage Ⅰ non-small cell lung cancer[J]. Ann Thorac Surg, 2007, 84(1):177-181. DOI:10.1016/j.athoracsur.2007. 03.081. [8] Hwangbo B, Kim SK, Lee HS, et al. Application of endobronchial ultrasound-guided transbronchial needle aspiration following integrated PET/CT in mediastinal staging of potentially operable non-small cell lung cancer[J]. Chest, 2009, 135(5):1280-1287. DOI:10.1378/chest.08-2019. [9] Lee JW, Kim BS, Lee DS, et al. 18F-FDG PET/CT in mediastinal lymph node staging of non-small-cell lung cancer in a tuberculosis-endemic country:consideration of lymph node calcification and distribution pattern to improve specificity[J]. Eur J Nucl Med Mol Imaging, 2009, 36(11):1794-1802. DOI:10.1007/s00259-009-1155-4. [10] 李向东, 尹吉林, 柳伟坤, 等. PET/CT对评价非小细胞肺癌纵隔淋巴结转移的诊断价值[J].南方医科大学学报, 2010, 30(3):506-508.
Li XD, Yin JL, Liu WK, et al. Value of positron emission tomography computed tomography in the diagnosis of mediastinal lymph node metastasis of non-small cell lung cancer[J]. J South Med Univ, 2010, 30(3):506-508.[11] Tasci E, Tezel C, Orki A, et al. The role of integrated positron emission tomography and computed tomography in the assessment of nodal spread in cases with non-small cell lung cancer[J]. Interact Cardiovasc Thorac Surg, 2010, 10(2):200-203. DOI:10.1510/icvts.2009.220392. [12] Darling GE, Maziak DE, Inculet RI, et al. Positron emission tomography-computed tomography compared with invasive mediastinal staging in non-small cell lung cancer:results of mediastinal staging in the early lung positron emission tomography trial[J]. J Thorac Oncol, 2011, 6(8):1367-1372. DOI:10.1097/JTO.0b013e318220c912. [13] Sommer G, Wiese M, Winter L, et al. Preoperative staging of non-small-cell lung cancer:comparison of whole-body diffusion-weighted magnetic resonance imaging and 18F-fluorodeoxyglucose-positron emission tomography/computed tomography[J]. Eur Radiol, 2012, 22(12):2859-2867. DOI:10.1007/s00330-012-2542-y. [14] Saydam O, Gokce M, Kilicgun A, et al. Accuracy of positron emission tomography in mediastinal node assessment in coal workers with lung cancer[J]. Med Oncol, 2012, 29(2):589-594. DOI:10.1007/s12032-011-9879-y. [15] Harders SW, Madsen HH, Hjorthaug K, et al. Characterization of pulmonary lesions in patients with suspected lung cancer:computed tomography versus[18F]fluorodeoxyglucose-positron emission tomography/computed tomography[J]. Cancer Imaging, 2012, 12(3):437-446. DOI:10.1102/1470-7330.2012.0035. [16] Kuo WH, Wu YC, Wu CY, et al. Node/aorta and node/liver SUV ratios from 18F-FDG PET/CT may improve the detection of occult mediastinal lymph node metastases in patients with non-small cell lung carcinoma[J]. Acad Radiol, 2012, 19(6):685-692. DOI:10.1016/j.acra.2012.02.013. [17] 许泽清, 段晓蓓, 樊卫. 18F-FDG PET/CT显像诊断非小细胞肺癌纵隔淋巴结转移的临床价值[J].中华核医学与分子影像杂志, 2013, 33(5):381-382. DOI:10.3760/cma.j.issn.2095-2848. 2013. 05.016.
Xu ZQ, Duan XB, Fan W. Diagnostic value of 18F-FDG PET/CT for metastasis of mediastinal lymph nodes in non-small-cell lung cancer patients[J]. Chin J Nucl Med Mol Imaging, 2013, 33(5):381-382. doi: 10.3760/cma.j.issn.2095-2848.2013.05.016[18] Koksal D, Demirag F, Bayiz H, et al. The correlation of SUVmax with pathological characteristics of primary tumor and the value of tumor/lymph node SUVmax ratio for predicting metastasis to lymph nodes in resected NSCLC patients[J]. J Cardiothorac Surg, 2013, 8(1):63. DOI:10.1186/1749-8090-8-63. [19] Billè A, Okiror L, Skanjeti A, et al. The prognostic significance of maximum standardized uptake value of primary tumor in surgically treated non-small-cell lung cancer patients:analysis of 413 cases.[J]. Clin Lung Cancer, 2013, 14(2):149-156. DOI:10.1016/j.cllc.2012.04.007. [20] Booth K, Hanna GG, Mcgonigle N, et al. The mediastinal staging accuracy of 18F-fluorodeoxyglycose positron emission tomography/computed tomography in non-small cell lung cancer with variable time intervals to surgery[J]. Ulster Med J, 2013, 82(2):75-81. [21] Li S, Zheng Q, Ma Y, et al. Implications of false negative and false positive diagnosis in lymph node staging of NSCLC by means of 18F-FDG PET/CT[J/OL]. Plos One, 2013, 8(10): e78552-e78552[2017-05-03]. http://journals.plos.org/plosone/article/file?id=10.1371/journal.pone.0078552&tpe=printable. DOI: 10.1371/journal.pone.0078552. [22] Xu ZQ, Xie L, Fan W, et al. Risk factors for mediastinal lymph node metastasis in non-small-cell lung cancer by PET/CT[J]. Nucl Med Commun, 2014, 35(5):466-471. DOI:10.1097/MNM.0000000000000077. [23] Moloney F, Ryan D, McCarthy L, et al. Increasing the accuracy of 18F-FDG PET/CT interpretation of 'mildly positive' mediastinal nodes in the staging of non-small cell lung cancer[J]. Eur J Radiol, 2014, 83(5):843-847. DOI:10.1016/j.ejrad.2014.01.016. [24] 黄占文, 陈跃, 蔡亮, 等. 18F-FDG PET/CT在非小细胞肺癌纵隔淋巴结转移的诊断价值[J].泸州医学院学报, 2015, 38(4):368-370. DOI:10.3969/j.issn.1000-2669.2015.04.012.
Huang ZW, Chen Y, Cai L, et al. Role of 18F-FDG PET/CT in the evaluation of mediastinal lymph node metastasis of non-small cell lung cancer[J]. J Luzhou Med Coll, 2015, 38(4):368-370. doi: 10.3969/j.issn.1000-2669.2015.04.012[25] 白璐, 于楠, 李艳, 等.基于18F-脱氧葡萄糖PET-CT成像对非小细胞肺癌纵隔淋巴结转移识别的Meta分析[J].中华放射学杂志, 2016, 50(10):752-757. DOI:10.3760/cma.j.issn.1005-1201. 2016.10.005.
Bai L, Yu N, Li Y, et al. The value of 18F-FDG PET-CT in the diagnosis of mediastinal lymph node metastasis in non-small cell lung cancer:a Meta-analysis[J]. Chin J Radiol, 2016, 50(10):752-757. doi: 10.3760/cma.j.issn.1005-1201.2016.10.005[26] 张召奇, 赵新明, 王建方, 等. 18F-FDG PET/CT诊断非小细胞肺癌纵隔淋巴结转移[J].中国医学影像学杂志, 2014, 22(4):293-296. DOI:10.3969/j.issn.1005-5185.2014.04.014.
Zhang ZQ, Zhao XM, Wang JF, et al. 18F-FDG PET/CT in the diagnosis of mediastinal lymph node metastasis of non-small cell lung cancer[J]. Chin J Med Imaging, 2014, 22(4):293-296. doi: 10.3969/j.issn.1005-5185.2014.04.014 -






 下载:
下载: