-
肺磨玻璃结节(ground-glass nodule,GGN)是肺部常见的影像征象,在CT肺窗下表现为局灶性云雾状密度增高影、阴影内血管和支气管清晰可辨[1]。按其成分不同分为纯磨玻璃结节(pure ground-glass nodule,pGGN)和伴有实性成分的混合磨玻璃结节(mixed ground-glass nodule,mGGN)。肺GGN可是良性病变(如炎症、局灶性出血或纤维化等),也可为不同级别的肺腺癌[2]。由于其缺乏特异性,对其良恶性的鉴别一直是临床中的难题。PET/CT作为目前最先进的影像诊断技术之一,它既可以利用同机高分辨率CT(high resolution CT,HRCT)精确地显示病变的解剖学特点,又能提供病灶的18F-FDG代谢特征。但关于PET/CT对肺GGN的诊断价值仍存在较大争议,笔者回顾性分析了72例肺GGN的18F-FDG PET/CT联合同机HRCT影像学特点及代谢情况,旨在探讨18F-FDG PET/CT联合同机HRCT对肺GGN良恶性鉴别的临床应用价值。
-
收集2013年5月至2016年9月于我科行18F-FDG PET/CT检查的患者,最终有72例肺GGN患者纳入本研究,其中54例经手术病理确诊,18例经临床随访确诊(随访中将结节缩小或消失且未新增实性成分的18例均定义为炎性病变)。随访时间为0.5~2年。其中32例良性病变[男性13例、女性19例,年龄30~76岁,平均(56.8±11.9)岁],包括临床随访证实的炎性病变18例,手术病理确诊的纤维组织增生或肉芽肿9例和炎性病变5例。40例恶性病变[男性17例、女性23例,年龄42~78岁,平均(60.3±8.8)岁],包括非典型腺瘤样增生1例、原位腺癌6例、微浸润腺癌1例、浸润性腺癌32例。两组资料在性别(χ2=0.026,P > 0.05)、年龄(t=1.417,P > 0.05)之间差异无统计学意义。恶性病变的诊断采用2011年国际肿瘤研究协会/美国胸科协会/欧洲呼吸学会对肺腺癌最新分型标准[3]。
所有患者均于检查前签署了知情同意书,且本研究获得本院医学伦理委员会批准。
-
显像仪器为荷兰飞利浦GEMINI TF 64 PET/CT,18F-FDG由美国GE公司PET trace回旋加速器及化学合成模块自动合成,放化纯度>95%。HRCT扫描仪为飞利浦GEMINI TF 64 PET/CT的同机CT。
-
患者禁食禁饮6 h以上,血糖低于7.0 mmol/L;按体重静脉注射18F-FDG 3.70~5.55 MBq/kg,安静休息60 min后行全身PET/CT显像。采集条件: ① CT扫描层厚4 mm,管电压120 kV,管电流100 mA,重建层厚2 mm。② PET采集时间为2 min/床位,重建层厚4 mm。PET/CT三维图像重建通过EBW工作站完成。③ HRCT扫描选择在当全身常规CT扫描结束后应用同机GEMINI TF 64 PET/CT、屏气状态下对肺部进行单独扫描,扫描层厚0.9 mm,管电压120 kV,管电流300 mA,重建层厚为0.9 mm。
-
分别由两位有5年以上工作经验的核医学医师对图像进行判读,所有参与读图者均未知患者的诊断结果,最终结果由两位医师协商一致确定。半定量分析采用ROI技术自动测定病灶的SUVmax。无明显代谢活性增高者通过在HRCT断层图上依病灶边缘勾画ROI,在对应PET图像上读取SUVmax。在HRCT肺窗上测量结节的直径(最大病灶层面的最大长径)。
PET/CT诊断标准:利用受试者工作特征曲线(receiver operating characteristic curve,ROC)对SUVmax进行分析,得出SUVmax最佳截断值,然后进行良恶性判定。HRCT诊断标准为出现以下征象中的任意两项及两项以上者为恶性病变:混合型结节、分叶征、毛刺征、胸膜凹陷征、血管集束征、结节直径≥11 mm。PET/CT联合HRCT诊断标准:上述两种方法中任一种方法诊断为恶性即判定为恶性病变(并联试验)。
-
所有数据均采用SPSS 20.0软件进行统计分析。单因素分析根据资料的特征,即符合正态分布的计量资料采用t检验、无序分类资料采用卡方检验;多因素分析采用logistic回归分析。将结节直径及SUVmax绘制成ROC,以约登指数(YI=Sen+Spe-1)最大的切点作为临界点,得出鉴别良恶性的最佳截断值。P < 0.05表示差异有统计学意义。
-
32例良性结节(pGGN 22例、mGGN 10例)中可见分叶征2例、毛刺征1例、空泡征1例、空气支气管征1例、胸膜凹陷征3例及血管集束征1例,余良性结节无上述征象(图 1)。40例恶性结节(pGGN 3例、mGGN 37例)中可见分叶征15例、毛刺征11例、空泡征8例、空气支气管征6例、胸膜凹陷征12例及血管集束征11例(图 2)。

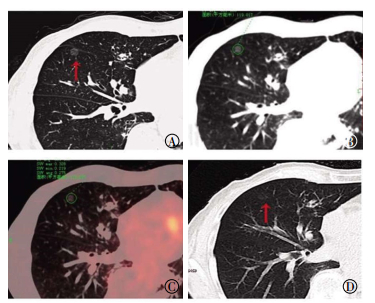
图 1 良性肺磨玻璃结节的18F-FDG PET/CT联合同机高分辨率CT图患者男性,76岁,临床随访结节缩小且未新增实性成分归纳为良性病变。图中,A:高分辨率CT于右肺中叶内侧段见直径为9 mm,边界清晰的纯磨玻璃结节(红色箭头示);B:CT横断面图像;C:PET/CT融合图像,结节代谢低于本底,通过ROI技术在CT断层图上勾画病灶边界,对应PET得出SUVmax约为0.328;D:半年后行CT复查示结节直径缩小(红色箭头所示),约5 mm。
Figure 1. 18F-FDG PET/CT combined with the same scanner high resolution CT images of benign ground-glass nodule

图 2 恶性肺磨玻璃结节的18F-FDG PET/CT联合同机高分辨率CT图患者女性,56岁,病理证实为浸润性肺癌。图中,A~B:高分辨率CT断层图上于右肺下叶见直径约16 mm、有分叶征、毛刺征、空泡征及胸膜凹陷征的混合磨玻璃结节;C~D:18F-FDG PET/CT融合横断图像,结节呈高代谢,SUVmax约为5.110。
Figure 2. 18F-FDG PET/CT combined with the same scanner high resolution CT images of malignant ground-glass nodule
单因素分析结果显示,HRCT上良恶性肺GGN直径、密度类型、分叶征、毛刺征、胸膜凹陷征及血管集束征在两组间差异均有统计学意义,而空泡征及空气支气管征在两组之间的差异无统计学意义(表 1)。多因素logistic回归分析结果显示,混合型密度是恶性肺GGN的显著预测因子(χ2=10.261,OR=23.515,P < 0.05)。将良恶性结节的直径绘制成ROC,通过曲线分析得出,以结节直径≥11 mm为评判标准的约登指数最高,曲线下面积为0.798(图 3)。HRCT对肺GGN诊断的灵敏度、特异度、准确率分别为75.0%、81.3%、77.8%(表 2)。
指标 良性组
(n=32)恶性组
(n=40)χ2值 t值 P值 肺GGN的直径/mm 9.53±4.98 16.55±6.79 4.932 < 0.001 肺GGN密度 29.425 < 0.001 单纯型 22 3 混合型 10 37 分叶征 2 15 9.626 0.002 毛刺征 1 11 7.605 0.006 空泡征 1 8 3.214 0.073 空气支气管征 1 6 1.664 0.197 胸膜凹陷征 3 12 4.585 0.032 血管集束征 1 11 7.605 0.006 SUVmax 0.88±0.91 2.38±2.24 3.884 < 0.001 注:表中,GGN:肺磨玻璃结节。 表 1 良恶性肺磨玻璃结节在高分辨率CT征象及SUVmax中的比较
Table 1. Comparison of benign and malignant ground-glass in high resolution CT signs and SUVmax

图 3 肺磨玻璃结节直径及SUVmax的受试者工作特征曲线
Figure 3. Receiver operating characteristic curve of diameter and SUVmax of pulmonary ground-glass nodules
扫描方法 灵敏度 特异度 准确率 PET/CT 82.5(33/40) 78.1(25/32) 80.6(58/72) HRCT 75.0(30/40) 81.3(26/32) 77.8(56/72) PET/CT联合HRCT 90.0(36/40) 68.8(22/32) 80.6(58/72) 注:表中,HRCT:高分辨率CT。 表 2 PET/CT、HRCT、PET/CT联合HRCT对GGN的诊断效能分析(%)
Table 2. Diagnostic efficacy analysis of PET/CT, HRCT and PET/CT combined with the same scanner HRCT for GGN (%)
-
良、恶性组肺GGNs的SUVmax分别为0.88±0.91,2.38±2.24;恶性组SUVmax明显高于良性组,差异有统计学意义(表 1)。将两组的SUVmax绘制成ROC,以约登指数最大时所对应的值为最佳临界值,当SUVmax≥0.9时,其评估肺GGN为恶性的灵敏度、特异度及曲线下面积分别为82.5%、78.1%、0.821(图 3)。18F-FDG PET/CT对肺GGN诊断的灵敏度、特异度、准确率分别为82.5%、78.1%、80.6%。18F-FDG PET/CT联合HRCT对肺GGN诊断的灵敏度、特异度、准确率分别为90.0%、68.8%、80.6%(表 2)。
-
近年来,随着HRCT在肺部应用的普及,GGN的检出率逐渐增高,尤其是pGGN,但对其良恶性的鉴别一直是临床上的难题。已有报道称肺GGN多为早期原发性肺腺癌的CT表现形式[4-5],因此明确肺GGN的诊断对指导临床具有重要意义。目前临床上可用于明确诊断的一些方法如经皮穿刺活检、纤维支气管镜、直视下胸腔镜检查以及开胸活检等均属于有创手段,且存在取材困难等问题,大部分患者不愿意接受,综合考虑,实际临床工作中仍以影像学检查手段为主。其中18F-FDG PET/CT检查被认为是诊断肺内非实性结节的有效影像学方法[6]。
-
尽管普通CT扫描已具有良好的分辨力,但大部分肺GGN在5 mm层厚CT影像上往往显像不清晰,甚至不显像。Fleischner指南[7]中提到,在厚层5 mm的CT影像上,由于容积效应等因素的影响,容易把较小的实性结节误认为非实性结节,而在1 mm的薄层影像上又被证实为实性结节。因此,为了准确评估病灶的形态特征,推荐层厚1 mm的HRCT。
本研究结果显示,随着结节直径的增加,其恶性可能性越大。将良恶性结节直径绘制成ROC,得出良恶性病灶的直径截断值为11 mm。同样有文献报道,病灶越小,良性的可能性越大,尤其是5 mm以下者绝大部分为良性,如果直径超过10 mm,其恶性结节的可能性可达88.7%[8]。Eguchi等[9]通过对101例表现为GGN的肺腺癌患者的研究结果表明,应用ROC分析得出区别浸润性腺癌与原位腺癌结节大小的最佳截断值为11 mm,间接说明结节越大,恶性程度越高。
结节密度类型对病灶良恶性的鉴别亦有重要价值。本研究中,40例恶性结节中37例(90%)为混合型密度,多因素分析显示混合型密度也是恶性肺GGN的显著预测因子,这可能与纳入标准中的浸润性病变数目较多有关。Yanagawa等[10]提出肺GGN病灶中实性成分含量越多,疾病预后越差。与之相符,张善华等[11]的研究也支持肺GGN中磨玻璃成分越少,恶性程度越大。因此当结节内出现实性成分时,需高度警惕恶性的可能,并采取积极的处理措施。
Fan等[12]通过对82例肺GGN影像特征研究,最终得出病灶的边缘(分叶征、毛刺征)、内部结构(空泡征、支气管截断征)及周围改变(胸膜凹陷征、血管集束征)等对于良、恶性肺GGNs的鉴别具有重要意义。Inoue等[13]研究也得出与之类似结果。本研究中,恶性结节中分叶征、毛刺征、胸膜凹陷征及血管集束征等征象所占比例明显高于良性组,差异有统计学意义。而空泡征及空气支气管征在两组间差异无统计学意义。
总之,由于受各种条件的制约使以上各项研究结果不尽相同,但当观察影像时仍应重点留意是否存在这些征象,这些征象的存在会为定性诊断提供一定依据。我们通过HRCT对结节征象分析,对肺GGN诊断的灵敏度、特异度、准确率分别为75.0%、81.3%、77.8%。
-
目前18F-FDG PET/CT对于肺结节良恶性的鉴别大多以SUVmax为2.5作为截断值,但是这种标准的提出是建立在实性结节的研究之上的,多数研究结果表明肺GGN在18F-FDG PET/CT上呈轻度摄取或无摄取,尤其是pGGN,因此PET对于其诊断价值尚存在很大的争议[14-15]。Chiu等[15]研究结果表明,18F-FDG PET/CT上的SUVmax在良恶性肺GGN间无明显差异。而Song等[16]的研究结果表明,随着结节磨玻璃密度成分的减少,SUVmax会升高。
在本研究中,以SUVmax≥0.9为评判指标,则PET/CT对GGN的诊断灵敏度、特异度、准确率分别为82.5%、78.1%、80.6%。王艳丽等[17]研究结果也显示,以SUVmax≥1.0为评判指标对单纯性肺GGN的诊断灵敏度、特异度、准确率分别为75.0%、90.0%、78.9%。
因此,虽然大部分肺GGN在PET/CT上代谢较低,但通过对其SUVmax半定量分析仍可间接反映结节的良恶性情况,从而对其鉴别诊断提供一定的参考。
-
18F-FDG PET/CT联合HRCT通过对结节形态学及代谢情况的评估,综合两者优势对肺GGN诊断的灵敏度、特异度、准确率分别为90.0%、68.8%、80.6%,较单独HRCT或PET/CT显像的灵敏度均有所提高,可以发现更多的恶性病灶,对患者临床早期干预有指导意义,然而由于其诊断的特异度和准确率较单独显像未见明显升高,故综合检查费用和时间等多因素考虑,PET/CT联合HRCT尚无法作为常规诊断手段。
本研究也存在以下局限性:① 本研究属于回顾性研究,样本量偏少;② 一部分结节通过临床随访明确诊断,然而仍有一部分倍增时间较长的良性或恶性病变在随访过程中大小可能保持不变。然而仅选取了结节缩小或完全消失的病灶作为良性病变,这可能造成选择样本偏倚,希望在以后的研究中尽可能纳入病理证实的病例;③ 本研究恶性病例中pGGN的病灶仅有3例(3/40),因此,没有对两组病变中pGGN与mGGN的SUVmax进行进一步分析;④ SUVmax的测定属于半定量分析,影响因素较多,可能会有一定的测量误差。而且由于缺乏延迟显像的数据,因此未对此进行分析。以上均将是我们后续待改进的。
综上所述,18F-FDG PET/CT联合HRCT通过对病变代谢情况及HRCT影像征象分析,可以提高诊断的灵敏度,有一定的临床价值。
18F-FDG PET/CT联合同机HRCT对肺磨玻璃结节的诊断价值
Value of 18F-FDG PET/CT combined with the same scanner HRCT in the diagnosis of pulmonary ground-glass nodules
-
摘要:
目的探讨18F-FDG PET/CT联合同机高分辨率CT(HRCT)对肺磨玻璃结节的诊断价值。 方法回顾性分析经手术病理或临床随访证实的72例肺磨玻璃结节患者(恶性40例、良性32例)资料,对其临床资料、影像特征、SUVmax等参数进行统计学分析。 结果单因素分析结果显示,HRCT下肺磨玻璃结节的直径(t=4.932,P < 0.001)、密度(χ2=29.425,P < 0.001)、分叶征(χ2=9.626,P=0.002)、毛刺征(χ2=7.605,P=0.006)、胸膜凹陷征(χ2=4.585,P=0.032)、血管集束征(χ2=7.605,P=0.006)及SUVmax(t=3.884,P < 0.001)在良、恶性两组间差异均有统计学意义。而性别(χ2=0.026,P=0.873)、年龄(t=1.417,P=0.161)、空泡征(χ2=3.214,P=0.073)及空气支气管征(χ2=1.664,P=0.197)在两组间差异均无统计学意义。多因素分析结果显示,混合型密度是鉴别良恶性病变的显著预测因子(χ2=10.261,OR=23.515,P < 0.05)。受试者工作特征曲线分析结果显示,以结节直径≥11 mm、SUVmax≥0.9为评判指标具有较好的鉴别精度。HRCT、PET/CT及PET/CT联合HRCT对肺磨玻璃结节诊断的灵敏度分别为75.0%、82.5%、90.0%,特异度分别为81.3%、78.1%、68.8%,准确率分别为77.8%、80.6%、80.6%。 结论18F-FDG PET/CT联合HRCT通过对肺磨玻璃结节的代谢情况及影像学分析,对其鉴别诊断有一定的临床价值,两者联合使用可以提高诊断的灵敏度。 -
关键词:
- 氟脱氧葡萄糖F18 /
- 正电子发射断层显像术 /
- 高分辨率CT /
- 磨玻璃结节 /
- 标准化摄取值
Abstract:ObjectiveTo investigate the value of 18F-FDG PET/CT combined with the same scanner high resolution CT (HRCT) in the diagnosis of pulmonary ground-glass nodules (GGNs). MethodsA total of 72 patients with pulmonary GGNs (40 cases were malignant, 32 presented benign lesions) were retrospectively analyzed and confirmed by surgical pathology or clinical follow-up.The clinical data, imaging features, maximum standardized uptake value (SUVmax) were analyzed statistically. ResultsUnivariate analysis showed significant differences in diameter (t=4.932, P < 0.001), density type (χ2=29.425, P < 0.001), lobular sign (χ2=9.626, P=0.002), spiculation sign (χ2=7.605, P=0.006), pleural indentation (χ2=4.585, P=0.032), vascular convergence (χ2=7.605, P=0.006), and SUVmax(t=3.884, P < 0.001).By contrast, no differences in gender (χ2=0.026, P=0.873), age (t=1.417, P=0.161), vacuole sign (χ2=3.214, P=0.073), and air bronchus sign (χ2=1.664, P=0.197) were observed between the two groups in HRCT.Multivariate analysis showed that mixed density was a notable predictor of malignancy (χ2=10.261, OR=23.515, P < 0.05).The receiver operating characteristic curve showed the diameter ≥ 11 mm and SUVmax ≥ 0.9 as the standard reference indexes that yielded good identification accuracy.The sensitivity of HRCT, PET/CT, and PET/CT combined with the same scanner HRCT in the diagnosis of GGNs were 75.0%, 82.5%, and 90.0%, with specificity values of 81.3%, 78.1%, and 68.8% and accuracy of 77.8%, 80.6%, and 80.6%, respectively. Conclusions18F-FDG PET/CT combined with the same scanner HRCT present certain clinical value in the differential diagnosis of GGNs by analyzing the metabolic condition and imaging characteristics.This approach can improve diagnostic sensitivity. -
图 1 良性肺磨玻璃结节的18F-FDG PET/CT联合同机高分辨率CT图患者男性,76岁,临床随访结节缩小且未新增实性成分归纳为良性病变。图中,A:高分辨率CT于右肺中叶内侧段见直径为9 mm,边界清晰的纯磨玻璃结节(红色箭头示);B:CT横断面图像;C:PET/CT融合图像,结节代谢低于本底,通过ROI技术在CT断层图上勾画病灶边界,对应PET得出SUVmax约为0.328;D:半年后行CT复查示结节直径缩小(红色箭头所示),约5 mm。
Figure 1. 18F-FDG PET/CT combined with the same scanner high resolution CT images of benign ground-glass nodule
表 1 良恶性肺磨玻璃结节在高分辨率CT征象及SUVmax中的比较
Table 1. Comparison of benign and malignant ground-glass in high resolution CT signs and SUVmax
指标 良性组
(n=32)恶性组
(n=40)χ2值 t值 P值 肺GGN的直径/mm 9.53±4.98 16.55±6.79 4.932 < 0.001 肺GGN密度 29.425 < 0.001 单纯型 22 3 混合型 10 37 分叶征 2 15 9.626 0.002 毛刺征 1 11 7.605 0.006 空泡征 1 8 3.214 0.073 空气支气管征 1 6 1.664 0.197 胸膜凹陷征 3 12 4.585 0.032 血管集束征 1 11 7.605 0.006 SUVmax 0.88±0.91 2.38±2.24 3.884 < 0.001 注:表中,GGN:肺磨玻璃结节。 表 2 PET/CT、HRCT、PET/CT联合HRCT对GGN的诊断效能分析(%)
Table 2. Diagnostic efficacy analysis of PET/CT, HRCT and PET/CT combined with the same scanner HRCT for GGN (%)
扫描方法 灵敏度 特异度 准确率 PET/CT 82.5(33/40) 78.1(25/32) 80.6(58/72) HRCT 75.0(30/40) 81.3(26/32) 77.8(56/72) PET/CT联合HRCT 90.0(36/40) 68.8(22/32) 80.6(58/72) 注:表中,HRCT:高分辨率CT。 -
[1] Lee HY, Lee KS. Ground-glass opacity nodules:histopathology, imaging evaluation, and clinical implications[J]. J Thorac Imaging, 2011, 26(2):106-118. DOI:10.1097/RTI.0b013e3181fbaa64. [2] Goo JM, Park CM, Lee HJ. Ground-glass nodules on chest CT as imaging biomarkers in the management of lung adenocarcinoma[J].AJR Am J Roentgenol, 2011, 196(3):533-543. DOI:10.2214/AJR.10.5813. [3] Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/American thoracic society/European respiratory society:international multidisciplinary classification of lung adenocarcinoma:executive summary[J]. Proc Am Thorac Soc, 2011, 8(5):381-385. DOI:10.1513/pats.201107-042ST. [4] Zhang L, Yankelevitz DF, Carter D, et al. Internal growth of nonsolid lung nodules:radiologic-pathologic correlation[J]. Radiology, 2012263(1):279-286. DOI:10.1148/radiol.11101372. [5] Saito H, Kameda Y, Masui K, et al. Correlations between thin-section CT findings, histopathological and clinical findings of small pulmonary adenocarcinomas[J]. Lung Cancer, 2011, 71(2):137-143. DOI:10.1016/j.lungcan.2010.04.018. [6] Tsushima Y, Tateishi U, Uno H, et al. Diagnostic performance of PET/CT in differentiation of malignant and benign non-solid solitary pulmonary nodules[J]. Ann Nucl Med, 2008, 22(7):571-577. DOI:10.1007/s12149-008-0160-1. [7] Naidich DP, Bankier AA, Macmahon H, et al. Recommendations for the management of subsolid pulmonary nodules detected at CT:a statement from the Fleischner Society[J]. Radiology, 2013, 266(1):304-317. DOI:10.1148/radiol.12120628. [8] Hu H, Wang Q, Tang H, et al. Multi-slice computed tomography characteristics of solitary pulmonary ground-glass nodules:Differences between malignant and benign[J]. Thorac Cancer, 2016, 7(1):80-87. DOI:10.1111/1759-7714.12280. [9] Eguchi T, Yoshizawa A, Kawakami S, et al. Tumor size and computed tomography attenuation of pulmonary pure ground-glass nodules are useful for predicting pathological invasiveness[J/OL]. PLoS One, 2014, 9(5):e97867[2017-03-06]. http://www.ncbi.nlm.nih.gov/pubmed/24846292. DOI:10.1371/journal.pone.0097867. [10] Yanagawa M, Tanaka Y, Kusumoto M, et al. Automated assessment of malignant degree of small peripheral adenocarcinomas using volumetric CT data:Correlation with pathologic prognostic factors[J]. Lung Cancer, 2010, 70(3):286-294. DOI:10.1016/j.lungcan.2010. 03.009. [11] 张善华, 王和平, 王善军, 等.肺部局灶性磨玻璃影的CT诊断[J].医学影像学杂志, 2012, 22(8):1329-1332. DOI:10.3969/j.issn.1006-9011.2012.08.027.
Zhang SH, Wang HP, Wang SJ, et al. CT diagnosis of pulmonary focal ground glass opacity[J]. J Med Imaging, 2012, 22(8):1329-1332. doi: 10.3969/j.issn.1006-9011.2012.08.027[12] Fan L, Liu SY, Li QC, et al. Multidetector CT features of pulmonary focal ground-glass opacity:differences between benign and malignant[J]. Br J Radiol, 2012, 85(115):897-904. DOI:10.1259/bjr/33150223. [13] Inoue D, Gobara H, Hiraki T, et al. CT fluoroscopy-guided cutting needle biopsy of focal pure ground-glass opacity lung lesions:diagnostic yield in 83 lesions[J]. Eur J Radiol, 2012, 81(2):354-359. DOI:10.1016/j.ejrad.2010.11.025. [14] Nam KB, Kim TJ, Park JS, et al. Long-Term Follow-Up results from PET/CT surveillance after surgical resection of lung adenocarcinoma manifesting as Ground-Glass opacity[J/OL]. Medicine(Baltimore), 2016, 95(4):e2634[2017-03-06]. DOI:10.1097/MD.0000000000002634. [15] Chiu CF, Lin YY, Hsu WH, et al. Shorter-time dual-phase FDG PET/CT in characterizing solid or ground-glass nodules based on surgical results[J]. Clin Imaging, 2012, 36(5):509-514. DOI:10. 1016/j.clinimag.2011.11.032. [16] Song SH, Ahn JH, Lee HY, et al. Prognostic impact of nomogram based on whole tumour size, tumour disappearance ratio on CT and SUVmax on PET in lung adenocarcinoma[J]. Eur Radiol, 2016, 26(6):1538-1546. DOI:10.1007/s00330-015-4029-0. [17] 王艳丽, 房娜, 曾磊, 等. 18F-FDG PET-CT联合同机HRCT对肺孤立性单纯性磨玻璃结节的诊断价值研究[J].临床放射学杂志, 2015, 34(2):212-218. DOI:10.13437/j.cnki.jcr.2015.02.012.
Wang YL, Fang N, Zeng L, et al. Evaluation of 18F-FDG PET-CT Double-Phase imaging combined with HRCT performed on the same scanner in diagnosing solitary pulmonary ground glass nodules[J]. J Clin Radiol, 2015, 34(2):212-218. doi: 10.13437/j.cnki.jcr.2015.02.012 -





 下载:
下载: