-
新型血管内皮生长因子受体Neuropilin-1(NRP-1)和整合素ανβ3在脑胶质瘤中异常表达,且其表达的水平与肿瘤恶性程度呈正相关,表明二者与肿瘤的恶性生物学行为有密切关系[1-2]。目前研究已分别证实含精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)和丙氨酸-苏氨酸-色氨酸-亮氨酸-脯氨酸-脯氨酸-精氨酸(Ala-Thr-Trp-Leu-Pro-Pro-Arg,ATWLPPR)的多肽分别能够特异性识别整合素αvβ3和NRP-1[2-3]。然而,分别单独使用RGD和ATWLPPR作为显像剂或治疗探针时存在多种问题:(1)采用单体肽作为显像剂,要求肿瘤表面的受体浓度相对正常组织器官的受体浓度达到一定水平,这种情况不会发生在所有肿瘤的生长、浸润和转移等过程中;(2)单体肽与肿瘤受体靶点结合的亲和力相对较弱,会导致肿瘤摄取不高及药物快速从标靶部位脱离;(3)某些单体肽在体内的药代动力学特性可能不理想。
我们在已有的对RGD多肽研究的基础上,针对脑胶质瘤高表达的整合素αvβ3和NRP-1受体,创造性地将环状多肽c(RGDyK)与ATWLPPR相结合,制备一种新型的双靶点融合肽探针c(RGDyK)-ATWLPPR,并对其进行18F标记,希望该融合肽在肿瘤细胞表面能同时与双靶点结合,提高多肽的肿瘤摄取以及受体-配体亲和力,以构建一种更为高效的脑胶质瘤诊断探针。我们通过一系列的体内外生物学实验,评价探针的细胞结合率、受体亲和力及肿瘤PET显像等方面的性质。同时,比较双靶点融合肽分子探针与对应单体肽分子探针在肿瘤早期诊断方面的区别和特点。
-
所有的化学试剂均购自美国Sigma-Aldrich公司。在PETtrace回旋加速器(TracerLab FxFN,美国GE Healthcare公司)上利用核反应18O(p,n)18F制得18F-,然后富集在Sep-Park light QMA柱上(QMA柱分别用10 mL 0.5 mol/L pH=8.4的NaOAc溶液和10 mL去离子水淋洗),用5 mL去离子水淋洗以除去吸附在QMA柱上的金属杂质离子,用0.2~1.0 mL生理盐水洗脱得到含18F-的生理盐水。放射性活度由CRC-25R放射性活度计(美国Captintec公司)检测。人神经胶质瘤细胞U87MG购于美国ATCC公司。BALB/C裸鼠购于中国上海斯莱克生物有限公司。鼠抗人整合素αvβ3单克隆抗体、兔抗人NRP-1单克隆抗体、异硫氰酸荧光素标记的羊抗鼠IgG和异硫氰酸罗丹明标记的羊抗兔IgG均购于美国Abcam公司。
-
多肽c(RGDyK)、ATWLPPR及c(RGDyK)-ATWLPPR由中国中肽生化有限公司合成和纯化,3种多肽分别被制备为经双功能螯合剂1,4,7-三氮杂环壬烷-1,4,7-三乙酸(1,4,7-triazacyclononane-1,4,7-triaceticacid,P-SCN-Bn-NOTA)(简称NOTA)修饰和未经NOTA修饰的两种形式。将0.2 mL溶有NOTA-多肽的无水乙腈溶液加入1.5 mL的离心管中,再向其中加入3 μL 1 mmol/L的AlCl3,用冰醋酸将pH值调至4.0。再向上述溶液中加入50 μL 925~1850 MBq含18F-的生理盐水溶液。将混合物摇匀后在100℃下反应20 min,冷却后用10 mL去离子水稀释后过C18小柱,然后再用20 mL水洗涤,最后用10 mmol/L盐酸乙醇溶液淋洗C18柱,得到纯化后的标记物。经18F标记和NOTA修饰的3种分子探针分别记为18F-FAl-NOTA-c(RGDyK)、18F-FAl-NOTA-ATWLP-PR及18F-FAl-NOTA-RGD-ATWLPPR。产品采用快速薄层层析方法测定标记率。
-
取对数生长期的人神经胶质瘤U87MG细胞以2×105个/mL接种到小玻片上,用4%多聚甲醛固定20 min。用含有1%牛血清白蛋白封闭后分别加入鼠抗人整合素αvβ3单克隆抗体(1:100)或兔抗人NRP-1单克隆抗体(1:100),4℃孵育过夜。用含0.1% Tween-20的PBS洗3次后加入异硫氰酸荧光素标记的羊抗鼠IgG或异硫氰酸罗丹明标记的羊抗兔IgG(1:200)和5 μg/mL 4,6-联脒-2-苯基吲哚溶液,室温孵育1 h,最后置于激光共聚焦显微镜(X81,日本Olympus公司)下观察荧光表达情况的变化。
从荷U87MG肿瘤裸鼠模型中取出U87MG肿瘤组织块。将处理好的肿瘤组织切片风干后,用冰丙酮溶液浸泡固定10 min,空气中干燥。1%牛血清白蛋白封闭后向其中加入鼠抗人整合素αvβ3单克隆抗体或兔抗人NRP-1单克隆抗体(1:100),4℃孵育过夜。PBS洗后加入生物素标记的第二抗体(1:200)。PBS洗后加入链霉菌抗生物素-过氧化物酶溶液50 μL。用二氨基联苯胺显色液显色3~10 min,苏木素复染,自来水冲洗返蓝,玻片常规梯度酒精脱水,二甲苯透明,中性树胶封片,晾干后置于显微镜下观察。
-
在24孔板中每孔加入5×105个U87MG细胞。分别加入18F标记的c(RGDyK)、ATWLPPR或c(RGDyK)-ATWLPPR,37℃孵育15、30、60、120 min后用0.1 mol/L NaOH溶液消化细胞。收集细胞悬液到计数管中,用γ计数器(Wallac Wizard 2480型,美国PerkinElmer公司)测量放射性计数,计算各时间点的细胞结合率。
-
测定融合肽对整合素αvβ3及NRP-1受体的半数抑制浓度(IC50)。采用Iodogen方法[4]制备125I-c(RGDyK)和125I-Tyr-ATWLPPR(125I要标记在酚羟基的侧位上,因此用酪氨酸的结构实现125I的标记)。在96孔板中每孔加入5 × 105个U87MG细胞。在125I-c(RGDyK)存在的条件下,加入递增浓度的NOTA-c(RGDyK)或NOTA-RGD-ATWLPPR(0~1000 nmol/L);在125I-Try-ATWLPPR(18 kBq/孔)存在的条件下,加入递增浓度的NOTA-ATWLPPR或NOTA-RGD-ATWLPPR(0~1000 nmol/L)。置于振荡器上振荡2 h后用0.1 mol/L NaOH溶液消化细胞。收集细胞悬液到计数管中,用γ计数器测量放射性计数。采用GraphPad Prism软件计算IC50值。
-
取4~5周龄BALB/C裸鼠24只,雌性,体重18~20 g,于右侧前肢腋部皮下接种U87MG细胞,5×106个/只,饲养于无特定病原体级动物房。2~3周后,待肿瘤平均直径达到0.8~1.0 cm时用于实验。
-
取荷U87MG肿瘤裸鼠12只,通过完全随机设计的方法分为3组,每组4只。各组裸鼠经尾静脉分别注射18F-FAl-NOTA-c(RGDyK)、18F-FAl-NOTA-ATWLPPR或18F-FAl-NOTA-RGD-ATWLPPR,于注射后30 min时进行静态micro-PET显像(Inveon Micro PET/CT,德国Siemens公司)。图像通过三维有序子集最大期望值法进行空间重构。在衰变校正的冠状面显像图中,用Inveon Research Workstation软件圈出肿瘤或主要脏器的ROI。肿瘤或脏器中的放射性浓度通过ROI区域中的平均像素值获得,乘以转换因子(单位:MBq/mL)后转换为MBq/mL。假定组织密度为1 g/mL,将ROI(MBq/mL)转化为MBq/g,然后除以注射剂量,得到PET定量的每克百分注射剂量(%ID/g)。
-
取荷U87MG人神经胶质瘤裸鼠16只,通过完全随机设计的方法分为4组,每组4只。每组在注射18F-FAl-NOTA-RGD-ATWLPPR前30 min各自先分别注射未经放射性核素标记的“冷”肽NOTA-c(RGDyK)、NOTA-ATWLPPR或NOTA-RGD-ATWLPPR(10 mg/kg),对照组注射等量的生理盐水。观察超量非标记的NOTA-c(RGDyK)、NOTA-ATWLPPR或NOTA-RGD-ATWLPPR阻断后18F-FAl-NOTA-RGD-ATWLPPR PET的肿瘤显像情况及%ID/g值。
-
实验数据用均数±标准差的形式表示。用GraphPad Prism 5.0软件计算并作图,进行融合肽、单体肽分别与整合素αvβ3及NRP-1受体的亲和力的比较,采用非线性回归分析计算IC50。采用SPSS19.0软件对3种标记物的细胞摄取、肿瘤与正常组织的%ID/g值等数据进行处理分析,采用方差分析和t检验(需满足正态分布和方差齐性的条件)对结果进行统计学分析。P < 0.05表示差异有统计学意义。
-
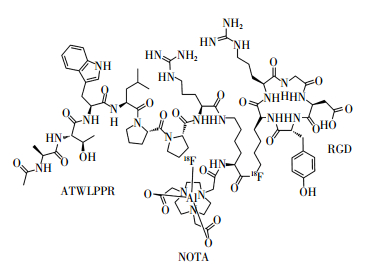
18F-FAl-NOTA-RGD-ATWLPPR的化学结构式如图 1所示。其经衰变校正后的标记率为40%~50%。放射性标记过程所需时间约30 min,无需高效液相色谱纯化。比活度约为35 GBq/μmol,经Radio-TLC(薄层层析法)检测,放射化学纯度大于95%。
-
整合素αvβ3及NRP-1受体在人神经胶质瘤U87MG细胞中的表达情况通过免疫荧光的方法进行测定。以鼠抗人整合素αvβ3单克隆抗体为一抗,其染色结果为强阳性,在共聚焦显微镜下于细胞膜及细胞质处可观察到显著的绿色荧光信号(图 2中A)。同时,以兔抗人NRP-1单克隆抗体为一抗,U87MG细胞NRP-1受体的染色结果呈阳性,在共聚焦显微镜下可观察到红色荧光信号(图 2中B)。在异种移植人神经胶质瘤组织切片中,整合素αvβ3及NRP-1受体在肿瘤组织(图 2中C、D)及肿瘤新生血管(图 2中E、F)中均呈高表达。

图 2 人神经胶质瘤U87MG细胞和组织中整合素αvβ3及NRP-1受体的免疫荧光染色结果图中,A、B分别为整合素αvβ3、NRP-1受体在U87MG细胞中的免疫荧光染色结果(×200),A呈强阳性,B呈阳性;C、D分别为整合素αvβ3、NRP-1受体在U87MG肿瘤组织切片中的免疫组化染色结果(×10);E、F分别为整合素αvβ3、NRP-1受体在肿瘤新生血管的免疫组化染色结果(×20),白色箭头所示处为肿瘤血管。整合素αvβ3及NRP-1受体在人神经胶质瘤U87MG细胞及组织中均呈高表达。NRP-1:neuropilin-1。
Figure 2. Immunofluorescent staining for integrin αvβ3 and neuropilin-1 in U87MG cells, U87MG glioma tissues and tumor vasculature
-
通过NOTA-c(RGDyK)和NOTA-RGD-ATWLPPR两种化合物与125I-c(RGDyK)竞争结合U87MG细胞表面整合素αvβ3受体,比较两种化合物与整合素αvβ3的亲和力。实验结果显示,NOTA-c(RGDyK)和NOTA-RGD-ATWLPPR两种化合物的IC50值分别为(44.75 ± 4.40)nmol/L和(58.97 ± 5.97)nmol/L,经两独立样本t检验差异无统计学意义(t=1.041,P > 0.05),表明两种化合物与整合素αvβ3的亲和力相当(图 3中A)。同理,通过NOTA-ATWLPPR和NOTA-RGD-ATWLPPR两种化合物与125I-Tyr-ATWLPPR竞争结合U87MG细胞表面整合素NRP-1受体,得到两种化合物的IC50值分别为(61.28 ± 7.34)nmol/L和(72.52 ± 5.02)nmol/L,经两独立样本t检验差异无统计学意义(t=1.125,P > 0.05),表明两种化合物与NRP-1受体的亲和力相当(图 3中B)。

图 3 NOTA-c(RGDyK)和NOTA-RGD-ATWLPPR竞争结合U87MG细胞表面整合素αvβ3和NRP-1受体结果图中,A:NOTA-c(RGDyK)和NOTA-RGD-ATWLPPR与125I-c(RGDyK)竞争结合U87MG细胞表面整合素αvβ3受体结果,log[M]中M为NOTA-c(RGDyK)或NOTA-RGD-ATWLPPR的浓度;B:NOTA-ATWLPPR和NOTA-RGD-ATWLPPR与125I-ATWLPPR竞争结合U87MG细胞表面NRP-1受体结果,log[M]中M为NOTA-ATWLPPR或NOTA-RGD-ATWLPPR的浓度;NOTA:1,4,7-三氮杂环壬烷-1,4,7-三乙酸;RGD:精氨酸-甘氨酸-天冬氨酸;ATWLPPR:丙氨酸-苏氨酸-色氨酸-亮氨酸-脯氨酸-脯氨酸-精氨酸;NRP-1:neuropilin-1。
Figure 3. Inhibition of 125I-c(RGDyK) binding to integrin αvβ3 in U87MG cells by NOTA-c(RGDyK) and NOTA-RGD-ATWLPPR (A). Inhibition of 125I-ATWLPPR binding to NRP-1 in U87MG cells by NOTA-ATWLPPR and NOTA-RGD-ATWLPPR(B).
-
U87MG肿瘤细胞对18F-FAl-NOTA-c(RGDyK)、18F-FAl-NOTA-ATWLPPR以及18F-FAl-NOTA-RGD-ATWLPPR 3种分子探针的摄取均随时间增加而升高,在120 min时达到最大值,18F-FAl-NOTA-ATWLPPR在三者中表现出最低的肿瘤摄取率(图 4)。在晚期时间点(60和120 min),融合肽18F-FAl-NOTA-RGD-ATWLPPR在U87MG细胞中的摄取率高于单体肽。

图 4 U87MG肿瘤细胞中18F-FAl-NOTA-c(RGDyK)、18F-FAl-NOTA-ATWLPPR以及18F-FAl-NOTA-RGD-ATWLPPR在不同时间点的细胞摄取结果图中,FAl:氟化铝;NOTA:1,4,7-三氮杂环壬烷-1,4,7-三乙酸;RGD:精氨酸-甘氨酸-天冬氨酸;ATWLPPR:丙氨酸-苏氨酸-色氨酸-亮氨酸-脯氨酸-脯氨酸-精氨酸。
Figure 4. Uptake of 18F-FAl-NOTA-c(RGDyK), 18F-FAl-NOTA-ATWLPPR, and 18F-FAl-NOTA-RGD-ATWLPPR in U87MG cells at different times
-
U87MG肿瘤裸鼠经尾静脉分别注射18F标记的c(RGDyK)、ATWLPPR或RGD-ATWLPPR后,在30 min时采集其冠状面及横断面图像,具有代表性的显像图见图 5中A。3种示踪剂均可清晰地显示U87MG肿瘤,图像具有较高的肿瘤/肌肉比。由于单肽分子探针仅能靶向单一的受体,18F-FAl-NOTA-c(RGDyK)及18F-FAl-NOTA-ATWLPPR PET图像中的肿瘤摄取较融合肽低。经定量分析,18F-FAl-NOTA-RGD-ATWLPPR、18F-FAl-NOTA-c(RGDyK)和18F-FAl-NOTA-ATWLPPR 3种分子探针在肿瘤中的摄取值分别为(4.86±0.48)%ID/g、(3.33±0.15)%ID/g和(2.28±0.41)%ID/g(图 5中B)。通过统计学检验,融合肽的肿瘤摄取值显著高于单体肽RGD(t=10.21,P < 0.05)和ATWLPPR(t=32.16,P < 0.05)。

图 5 荷人神经胶质瘤U87MG裸鼠行18F-FAl-NOTA-ATWLPPR、18F-FAl-NOTA-c(RGDyK)或18F-FAl-NOTA-RGD-ATWLPPR的micro-PET显像图及肿瘤摄取值比较图中,A:micro-PET显像图,箭头所指处为肿瘤所在;B:18F-FAl-NOTA-RGD-ATWLPPR、18F-FAl-NOTA-c(RGDyK)以及18F-FAl-NOTA-ATWLPPR 3种示踪剂的肿瘤摄取值比较(用%ID/g表示);FAl:氟化铝;NOTA:1,4,7-三氮杂环壬烷-1,4,7-三乙酸;RGD:精氨酸-甘氨酸-天冬氨酸;ATWLPPR:丙氨酸-苏氨酸-色氨酸-亮氨酸-脯氨酸-脯氨酸-精氨酸。
Figure 5. Representative micro-PET images and tumor uptakes of nude mice bearing subcutaneous U87MG glioma xenografts injected with 18F-FAl-NOTA-ATWLPPR, 18F-FAl-NOTA-c(RGDyK) and 18F-FAl-NOTA-RGD-ATWLPPR
我们通过阻断实验来证实融合肽18F-FAl-NOTA-RGD-ATWLPPR在U87MG肿瘤模型中与整合素αvβ3及NRP-1受体的结合能力。如图 6中A所示,当18F-FAl-NOTA-RGD-ATWLPPR与过量的ATWLPPR同时注射时,其在U87MG肿瘤中的摄取被部分抑制,肿瘤摄取值从(4.86 ± 0.48)%ID/g降低至(3.18 ± 0.35)%ID/g(下降了35%);当18F-FAl-NOTA-RGD-ATWLPPR与过量的RGD同时注射时,其摄取亦被部分抑制,肿瘤摄取值从(4.86 ± 0.48)%ID/g降低至(2.01±0.23)%ID/g(下降了59%);而当18F FAl-NOTA-RGD-ATWLPPR与过量的ATWLPPR-RGD同时注射时,其摄取被完全抑制,肿瘤摄取值从(4.86 ± 0.48)%ID/g下降至(1.04 ± 0.12)%ID/g(下降了79%)(图 6中B)。

图 6 用超量非标记的NOTA-ATWLPPR、NOTA-c(RGDyK)及NOTA-RGD-ATWLPPR阻断后,荷人神经胶质瘤U87MG裸鼠的18F-FAl-NOTA-RGD-ATWLPPR micro-PET显像图及肿瘤摄取值比较图中,A:micro-PET显像图,箭头所指处为肿瘤所在;B:18F-FAl-NOTA-RGD-ATWLPPR在U87MG肿瘤模型中对照组、NOTA-ATWLPPR阻断组、NOTA-c(RGDyK)阻断组和NOTA-RGD-ATWLPPR阻断组的肿瘤摄取值比较(以%ID/g的形式表示);FAl:氟化铝;NOTA:1,4,7-三氮杂环壬烷-1,4,7-三乙酸;RGD:精氨酸-甘氨酸-天冬氨酸;ATWLPPR:丙氨酸-苏氨酸-色氨酸-亮氨酸-脯氨酸-脯氨酸-精氨酸。
Figure 6. Representative micro-PET images and tumor uptake of nude mice bearing subcutaneous U87MG glioma xenografts injected with 18F-FAl-NOTA-RGD-ATWLPPR after a blocking dose injection of NOTA-ATWLPPR, NOTA-c(RGDyK), and NOTA-RGD-ATWLPPR
-
以RGD或ATWLPPR为基础的单靶点分子显像探针的局限性可能影响到它们在临床肿瘤显像中的广泛应用。这是由于针对单一靶点的肿瘤显像要求肿瘤组织特异性高表达某种受体,且正常组织不表达或是低表达这种受体。而在肿瘤生长过程中,肿瘤细胞表面的受体会呈现异质性和不均一性,即便同种肿瘤患者,其肿瘤组织表达的受体类型或表达水平也会不一致[5-6]。另外,一种肿瘤细胞表面也会表达两种或多种受体[7]。目前,一些相关研究已经证实双靶点或多靶点分子探针的应用确实能提高肿瘤显像诊断的准确率[8-10]。例如,Zhang等[8]在前列腺癌患者的临床研究中发现,靶向整合素αvβ3和胃泌素释放肽受体的双靶点分子探针68Ga-RGD-BBN(其中,BBN:蛙皮素)较其单体肽在前列腺癌中表现出了更高的肿瘤摄取率和诊断灵敏度。本研究中我们利用融合肽技术将c(RGDyK)和ATWLPPR这两种肿瘤的特异性靶向多肽相结合,制备出的新型双靶点融合肽探针在理论上具有以下优势:(1)部分融合肽能以双价的形式同时与细胞表面表达的不同受体结合,降低其从细胞表面受体上的解离,从而提高了多肽对受体的亲和力。(2)由于融合肽可靶向两种不同的受体,故其在一个细胞上的所有结合位点为两种不同受体数量的总和,多于单肽的结合位点,因此肿瘤对融合肽的摄取高于其对应单肽。
本研究中我们成功构建了可同时识别整合素αvβ3和血管内皮生长因子受体的双靶点分子探针(RGD-ATWLPPR),并将18F-FAl与连接NOTA的融合肽直接反应,制备出18F-FAl-NOTA-RGD-ATWLPPR,实现了18F的标记。在这一阶段的工作中,我们比较了该融合肽与对应单体肽在荷人神经胶质瘤U87MG模型中的显像特点,结果显示,与RGD和ATWLPPR单体肽相比,18F-FAl-NOTA-RGD-ATWLPPR融合肽在任何检测时间点上的肿瘤摄取值都高,并较单体肽表现出更好的显像效果,双靶点探针在肿瘤中的摄取明显提高。
阻断实验中,在注射放射性分子探针前通过过量的“冷”NOTA-c(RGDyK)或NOTA-ATWLPPR阻滞肿瘤中相应的整合素αvβ3和NRP-1受体位点,PET显像结果显示,18F-FAl-NOTA-RGD-ATWLPPR可以灵敏地对整合素αvβ3和NRP-1受体中任何一个高表达的肿瘤进行显像;而当用NOTA-RGD-ATWLPPR作为阻断剂时,可以完全阻断18F-FAl-NOTA-RGD-ATWLPPR在U87MG肿瘤中的摄取,证明融合肽的肿瘤摄取是整合素αvβ3和NRP-1受体介导的特异性结合。
尽管本研究中的双靶点融合肽较其单体肽表现出了更高的肿瘤摄取,并且在任一受体被未标记“冷”肽阻断的情况下仍能获得肿瘤的阳性显像结果,但该分子探针在将来的临床应用中也存在以下一些不足。首先,通过细胞竞争结合实验显示,融合肽与αvβ3及NRP-1受体的亲和力较其单体肽提升的幅度不够显著。分析原因,我们认为该融合肽中RGD模序与ATWLPPR模序间的谷氨酸链非常短,故该融合肽不是必定以双价的形式同时与细胞表面表达的αvβ3及NRP-1受体相结合,因此没有体现出较单体肽大幅度提高的受体亲和力。类似的结论在其他双靶点分子探针的研究中亦被报道[11-13]。同时,我们还观察到这种融合肽在肝脏中的摄取较高,明显高于对应的单体肽。因此,如何进一步提高双靶点融合肽的受体-配体结合亲和力,提高其肿瘤摄取率并延长在肿瘤中的滞留时间;如何进一步改善其在生物体内的药代动力学性质,减少其在肝脏、肾脏中的摄取,仍需进一步研究探讨。目前,已有一些相关研究通过在融合肽的两个模序之间加入药代动力学修饰分子(如聚乙二醇PEG4和聚甘氨酸Gly3)的方法,使融合肽分子中两个模序之间的距离足够长以保证融合肽能同时与细胞表面的不同受体相结合,进一步提高受体-配体结合的亲和力,使结合更为牢固,从而提高肿瘤对标记探针的摄取并延长其在肿瘤中的滞留时间[14-15]。同时,由于引入了药代动力学修饰分子,能改善标记探针从非肿瘤组织(肝、肾、肠等)的清除动力学,降低肾、肝等脏器对其的摄取。在进一步的研究中,我们亦可借鉴该种研究策略,以构建出一种更为高效的脑胶质瘤正电子成像探针。
新型αvβ3和Neuropilin-1双靶点正电子成像探针18F-FAl-NOTA-RGD-ATWLPPR用于脑胶质瘤的PET显像研究
Imaging of glioma with an integrin αvβ3 and neuropilin-1 dual-targeted PET probe 18F-FAl-NOTA-RGD-ATWLPPR
-
摘要:
目的构建可靶向αvβ3和血管内皮生长因子受体Neuropilin-1(NRP-1)双受体的正电子成像探针,并验证双靶点融合肽探针较之单靶点探针的优越性。 方法采用18F-氟化铝(18F-FAl)配合物的方法实现分子探针的18F标记。在人神经胶质瘤U87MG细胞中,检测αvβ3和NRP-1的表达水平,测定分子探针精氨酸-甘氨酸-天冬氨酸(RGD)-丙氨酸-苏氨酸-色氨酸-亮氨酸-脯氨酸-脯氨酸-精氨酸(ATWLPPR)与αvβ3/NRP-1的受体-配体亲和力。在U87MG荷瘤裸鼠模型中,测定18F标记RGD-ATWLPPR的体内肿瘤micro-PET显像特性,并且与其对应单体进行比较分析。采用方差分析和t检验对结果进行统计学分析。 结果αvβ3及NRP-1在U87MG肿瘤细胞、肿瘤组织及肿瘤新生血管中均有较高水平的表达。受体-配体亲和力测定的实验结果显示,18F-FAl-NOTA-RGD-ATWLPPR双靶点融合肽与αvβ3及NRP-1的亲和力并未明显优于其单体,但融合肽在U87MG细胞中的摄取高于相应的单体肽。Micro-PET显像结果显示,融合肽较其单体肽RGD[(4.86±0.48)% ID/g vs.(3.33±0.15)% ID/g,t=10.21,P < 0.05]和ATWLPPR[(4.86±0.48)% ID/g vs.(2.28±0.41)% ID/g,t=32.16,P < 0.05]表现出了更好的显像效果,且融合肽在αvβ3、NRP-1任一受体被未标记“冷”肽阻断的情况下仍能获得肿瘤的阳性显像结果。 结论18F-FAl-NOTA-RGD-ATWLPPR可以灵敏地对整合素αvβ3和NRP-1中任何一个受体高表达的肿瘤进行显像,并且较其单体具有更高的肿瘤摄取,但该融合肽的受体-配体亲和力还有待进一步提高。 -
关键词:
- 整合素αvβ3 /
- 神经纤毛蛋白质1 /
- 正电子发射断层显像术 /
- 分子探针
Abstract:ObjectiveArg-Gly-Asp (RGD) or Ala-Thr-Trp-Leu-Pro-Pro-Arg (ATWLPPR) peptide binds specifically to integrin αvβ3 or neuropilin-1(NRP-1) receptor, respectively.In this study, a novel heterodimer peptide probe containing both RGD and ATWLPPR was designed in one molecule.The in vitro and in vivo biological behavior of the dual-targeted imaging probe RGD-ATWLPPR was compared with its corresponding counterparts. Methods18F labeling was conducted through 18F-FAl approach.In the integrin αvβ3-positive U87MG human glioma cell line, the αvβ3/NRP-1 receptor binding affinity of RGD-ATWLPPR was tested and compared with its counterparts RGD and ATWLPPR.The tumor uptake and distribution pattern of 18F-labeled RGD-ATWLPPR through PET imaging was evaluated and compared with those of RGD and ATWLPPR.The means were compared using one-way ANOVA and t test. ResultsBoth integrin αvβ3 and NRP-1 showed high expression in U87MG glioma cells and tumor tissues.RGD-ATWLPPR exhibited similar in vitro receptor binding affinity to those of RGD and ATWLPPR.Based on the PET imaging study, 18F-labeled RGD-ATWLPPR (denoted as 18F-FAl-NOTA-RGD-ATWLPPR) demonstrated significantly higher tumor uptake than RGD[(4.86±0.48)% ID/g vs.(3.33±0.15)% ID/g, t=10.21, P < 0.05]and ATWLPPR[(4.86±0.48)% ID/g vs.(2.28±0.41)% ID/g, t=32.16, P < 0.05].In the blocking study, 18F-FAl-NOTA-RGD-ATWLPPR showed positive imaging result in the presence of excess unlabeled RGD or ATWLPPR.The tumor uptake decreased to the background level when unlabeled RGD and ATWLPPR were co-injected before administration of 18F-FAl-NOTA-RGD-ATWLPPR. ConclusionsThe dual-targeted PET probe 18F-FAl-NOTA-RGD-ATWLPPR specifically binds to either integrin αvβ3 or NRP-1 receptor and could be a promising PET imaging agent for NRP-1-/αvβ3+and NRP-1+/αvβ3-tumors.The receptor-binding affinity of RGD-ATWLPPR must be further improved. -
Key words:
- Integrin αvβ3 /
- Neuropilin-1 /
- Positron-emission tomography /
- Molecular probes
-
图 2 人神经胶质瘤U87MG细胞和组织中整合素αvβ3及NRP-1受体的免疫荧光染色结果图中,A、B分别为整合素αvβ3、NRP-1受体在U87MG细胞中的免疫荧光染色结果(×200),A呈强阳性,B呈阳性;C、D分别为整合素αvβ3、NRP-1受体在U87MG肿瘤组织切片中的免疫组化染色结果(×10);E、F分别为整合素αvβ3、NRP-1受体在肿瘤新生血管的免疫组化染色结果(×20),白色箭头所示处为肿瘤血管。整合素αvβ3及NRP-1受体在人神经胶质瘤U87MG细胞及组织中均呈高表达。NRP-1:neuropilin-1。
Figure 2. Immunofluorescent staining for integrin αvβ3 and neuropilin-1 in U87MG cells, U87MG glioma tissues and tumor vasculature
图 3 NOTA-c(RGDyK)和NOTA-RGD-ATWLPPR竞争结合U87MG细胞表面整合素αvβ3和NRP-1受体结果图中,A:NOTA-c(RGDyK)和NOTA-RGD-ATWLPPR与125I-c(RGDyK)竞争结合U87MG细胞表面整合素αvβ3受体结果,log[M]中M为NOTA-c(RGDyK)或NOTA-RGD-ATWLPPR的浓度;B:NOTA-ATWLPPR和NOTA-RGD-ATWLPPR与125I-ATWLPPR竞争结合U87MG细胞表面NRP-1受体结果,log[M]中M为NOTA-ATWLPPR或NOTA-RGD-ATWLPPR的浓度;NOTA:1,4,7-三氮杂环壬烷-1,4,7-三乙酸;RGD:精氨酸-甘氨酸-天冬氨酸;ATWLPPR:丙氨酸-苏氨酸-色氨酸-亮氨酸-脯氨酸-脯氨酸-精氨酸;NRP-1:neuropilin-1。
Figure 3. Inhibition of 125I-c(RGDyK) binding to integrin αvβ3 in U87MG cells by NOTA-c(RGDyK) and NOTA-RGD-ATWLPPR (A). Inhibition of 125I-ATWLPPR binding to NRP-1 in U87MG cells by NOTA-ATWLPPR and NOTA-RGD-ATWLPPR(B).
图 4 U87MG肿瘤细胞中18F-FAl-NOTA-c(RGDyK)、18F-FAl-NOTA-ATWLPPR以及18F-FAl-NOTA-RGD-ATWLPPR在不同时间点的细胞摄取结果图中,FAl:氟化铝;NOTA:1,4,7-三氮杂环壬烷-1,4,7-三乙酸;RGD:精氨酸-甘氨酸-天冬氨酸;ATWLPPR:丙氨酸-苏氨酸-色氨酸-亮氨酸-脯氨酸-脯氨酸-精氨酸。
Figure 4. Uptake of 18F-FAl-NOTA-c(RGDyK), 18F-FAl-NOTA-ATWLPPR, and 18F-FAl-NOTA-RGD-ATWLPPR in U87MG cells at different times
图 5 荷人神经胶质瘤U87MG裸鼠行18F-FAl-NOTA-ATWLPPR、18F-FAl-NOTA-c(RGDyK)或18F-FAl-NOTA-RGD-ATWLPPR的micro-PET显像图及肿瘤摄取值比较图中,A:micro-PET显像图,箭头所指处为肿瘤所在;B:18F-FAl-NOTA-RGD-ATWLPPR、18F-FAl-NOTA-c(RGDyK)以及18F-FAl-NOTA-ATWLPPR 3种示踪剂的肿瘤摄取值比较(用%ID/g表示);FAl:氟化铝;NOTA:1,4,7-三氮杂环壬烷-1,4,7-三乙酸;RGD:精氨酸-甘氨酸-天冬氨酸;ATWLPPR:丙氨酸-苏氨酸-色氨酸-亮氨酸-脯氨酸-脯氨酸-精氨酸。
Figure 5. Representative micro-PET images and tumor uptakes of nude mice bearing subcutaneous U87MG glioma xenografts injected with 18F-FAl-NOTA-ATWLPPR, 18F-FAl-NOTA-c(RGDyK) and 18F-FAl-NOTA-RGD-ATWLPPR
图 6 用超量非标记的NOTA-ATWLPPR、NOTA-c(RGDyK)及NOTA-RGD-ATWLPPR阻断后,荷人神经胶质瘤U87MG裸鼠的18F-FAl-NOTA-RGD-ATWLPPR micro-PET显像图及肿瘤摄取值比较图中,A:micro-PET显像图,箭头所指处为肿瘤所在;B:18F-FAl-NOTA-RGD-ATWLPPR在U87MG肿瘤模型中对照组、NOTA-ATWLPPR阻断组、NOTA-c(RGDyK)阻断组和NOTA-RGD-ATWLPPR阻断组的肿瘤摄取值比较(以%ID/g的形式表示);FAl:氟化铝;NOTA:1,4,7-三氮杂环壬烷-1,4,7-三乙酸;RGD:精氨酸-甘氨酸-天冬氨酸;ATWLPPR:丙氨酸-苏氨酸-色氨酸-亮氨酸-脯氨酸-脯氨酸-精氨酸。
Figure 6. Representative micro-PET images and tumor uptake of nude mice bearing subcutaneous U87MG glioma xenografts injected with 18F-FAl-NOTA-RGD-ATWLPPR after a blocking dose injection of NOTA-ATWLPPR, NOTA-c(RGDyK), and NOTA-RGD-ATWLPPR
-
[1] Wu H, Chen H, Sun Y, et al. Imaging integrin αvβ3 positive glioma with a novel RGD dimer probe and the impact of antiangiogenic agent(Endostar) on its tumor uptake[J]. Cancer Lett, 2013, 335(1) 75-80. DOI:10.1016/j.canlet.2013.01.053. [2] Chen H, Niu G, Wu H, et al. Clinical application of radiolabeled RGD peptides for PET imaging of integrin αvβ3[J]. Theranostics, 2016, 6(1):78-92. DOI:10.7150/thno.13242. [3] Miyauchi JT, Chen D, Choi M, et al. Ablation of neuropilin 1 from glioma-associated microglia and macrophages slows tumor progression[J]. Oncotarget, 2016, 7(9):9801-9814. DOI:10.18632/oncotarget.6877. [4] Tuszynski GP, Knight LC, Kornecki E, et al. Labeling of platelet surface proteins with 125I by the iodogen method[J]. Anal Biochem, 1983, 130:166-170. DOI:10.1016/0003-2697(83)90664-4. [5] Capello A, Krenning EP, Bernard BF, et al. Anticancer activity of targeted proapoptotic peptides[J]. J Nucl Med, 2006, 47(1):122-129. DOI:10.1158/1535-7163. [6] Liu Z, Yan Y, Chin FT, et al. Dual integrin and gastrin-releasing peptide receptor targeted tumor imaging using 18F-labeled PEGylated RGD-bombesin heterodimer 18F-FB-PEG3-Glu-RGD-BBN[J]. J Med Chem, 2009, 52(2):425-432. DOI:10.1021/jm801285t. [7] Liu SL, Liu HG, Jiang H, et al. One-step radiosynthesis of 18F-AlF-NOTA-RGD2 for tumor angiogenesis PET imaging[J]. Eur J Nucl Med Mol Imaging, 2011, 38(9):1732-1741. DOI:10.1007/s00259-011-1847-4. [8] Zhang J, Niu G, Lang L, et al. Clinical translation of a dual integrin αvβ3-and Gastrin-Releasing peptide Receptor-Targeting PET radiotracer, 68Ga-BBN-RGD[J]. J Nucl Med, 2017, 58(2):228-234. DOI:10.2967/jnumed.116.177048. [9] Chen Q, Ma Q, Chen M, et al. An exploratory study on 99mTc-RGD-BBN peptide scintimammography in the assessment of breast malignant lesions compared to 99mTc-3P4-RGD2[J/OL]. PLoS One, 2015, 10(4):e0123401[2017-03-08]. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0123401. DOI:10.1371/journal.pone.0123401. [10] Fan D, Zhang X, Zhong L, et al. 68Ga-labeled 3PRGD2 for dual PET and Cerenkov luminescence imaging of orthotopic human glioblastoma[J]. Bioconjug Chem, 2015, 26(6):1054-1060. DOI:10.1021/acs.bioconjchem.5b00169. [11] Yan Y, Chen K, Yang M, et al. A new 18F-labeled BBN-RGD peptide heterodimer with a symmetric linker for prostate cancer imaging[J]. Amino Acids, 2011, 41(2):439-447. DOI:10.1007/s00726-010-0762-5. [12] Yan Y, Chen X. Peptide heterodimers for molecular imaging[J].Amino Acids, 2011, 41(5):1081-1092. DOI:10.1007/s00726-010-0546-y. [13] Liu Z, Huang J, Dong C, et al. 99mTc-labeled RGD-BBN peptide for small-animal SPECT/CT of lung carcinoma[J]. Mol Pharm, 2012, 9(5):1409-1417. DOI:10.1021/mp200661t. [14] Liu Z, Niu G, Shi J, et al. 68Ga-labeled cyclic RGD dimers with Gly3 and PEG4 linkers:promising agents for tumor integrin αvβ3 PET imaging[J]. Eur J Nucl Med Mol Imaging, 2009, 36(6):947-957. DOI:10.1007/s00259-008-1045-1. [15] Jin X, Liang N, Wang M, et al. Integrin imaging with 99mTc-3PRGD2 SPECT/CT shows high specificity in the diagnosis of lymph node metastasis from Non-Small cell lung cancer[J]. Radiology, 2016, 281(3):958-966. DOI:10.1148/radiol.2016150813. -






 下载:
下载: