-
肺癌是最常见的恶性肿瘤,其中,非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌中最高发的(约占80%)。放疗是治疗NSCLC的一种主要治疗方式,但是,辐射抵抗是限制放疗被广泛应用的主要原因[1-2]。改变肿瘤细胞中特定的基因表达水平以影响肿瘤的放射敏感性是提高放疗疗效的一个有效方法,基因治疗与放疗联合使用会成为有前景的肿瘤治疗策略[3-4]。B7-H3蛋白于2001年首次被发现并被克隆,其是B7共刺激分子家族中的一员,具有调节T细胞介导的免疫反应的功能[5]。越来越多的研究揭示B7-H3蛋白可以抑制T细胞的增殖,减少其细胞因子的释放和转录因子的活化[6-7]。在正常组织中,B7-H3蛋白低表达[8]而在多种恶性肿瘤中都呈高表达,包括胰腺癌[9]、前列腺癌[10-11]、肾细胞癌[12-13]、NSCLC[14]等。但B7-H3蛋白在NSCLC中的临床意义和预后价值仍存在一定争议[15-17]。我们通过研究人为降低B7-H3基因表达对γ射线辐射诱导的人类肺癌A549细胞的凋亡和细胞周期的影响,探讨B7-H3在调节肺癌细胞放射敏感性中的作用。
-
人肺癌A549细胞(由中国医学科学院肿瘤医院詹启敏教授实验室馈赠)用含10%胎牛血清的DMEM培养液在5% CO2的37℃恒温培养箱中培养,待细胞生长浓度约为80%时进行传代亚培养。选择处于对数生长期的A549细胞进行实验。
-
转染前1 d,将细胞接种于六孔板中,每孔加入2 mL无抗生素培养基,使细胞密度达到50%;取2 μL/孔Lipofectamine 3000与50 μL Opti-MEM(减血清培养基)混匀,室温下孵育5 min;取2 μL /孔siRNA与50 μL Opti-MEM混匀,室温孵育5 min。将以上2种混合液混匀,室温放置30 min,即为siRNA转染液。将siRNA转染液加入待转染A549细胞液中,轻轻混匀,培养6 h后将培养基换成含血清的完全培养基。转染成功的细胞称为siB7-H3转染组。
-
实验分为4组,即对照组、siB7-H3转染组、照射组、照射+siB7-H3转染组。其中,对照组为转染了阴性siB7-H3的A549细胞;siB7-H3转染组为转染了靶向B7-H3蛋白siRNA的A549细胞;照射组为经过照射的A549细胞;照射+siB7-H3转染组为经过照射的转染了靶向B7-H3蛋白siRNA的A549细胞。照射组、照射+siB7-H3转染组的照射条件为137Cs γ射线照射源(Autocell40,加拿大原子能有限公司),一次性照射,照射剂量为4 Gy,剂量率为1 Gy/min。
-
将对照组、siB-H3转染组的细胞用细胞裂解液冰上裂解,提取总蛋白,采用BCA法进行蛋白定量。取各组等量蛋白用SDS-PAGE凝胶电泳分离,恒流180 mA湿转1 h至PVDF膜,用含5%脱脂奶粉的TBST(Tris-HCl缓冲盐溶液+非离子型去污剂Tween)缓冲液室温封闭1 h后,分别加入小鼠抗人B7-H3蛋白抗体(1 : 1000稀释)和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(1 : 6000稀释)内参抗体,4℃孵育过夜。次日用TBST洗涤3次,每次10 min,并在摇床上振摇,加入辣根酶标记山羊抗小鼠IgG(H + L)(1 : 5000稀释),室温孵育1 h后TBST洗涤3次,每次10 min。用化学发光法显色,凝胶成像系统采集成像(ChemiDoc MP型号,美国BIO-RAD公司)。以上所用试剂均购自英国Abcam公司。
-
收集瞬时转染24 h的A549细胞,Trizol法提取细胞总RNA,用反转录试剂盒反转录mRNA生成cDNA,用PCR扩增试剂盒检测对照组、siB7-H3转染组中B7-H3 mRNA的表达,选择GAPDH作为mRNA的内参。扩增条件:恒温段:50℃、2 min,95℃、10 min;循环段:95℃、15 s,60 ℃、1 min;熔解段:95℃、15 s,60℃、1 min,95℃、15 s,循环40次,数据采用2-ΔΔCt法进行分析。以下为引物序列:
GAPDH引物
正向:5’-GGAGCGAGATCCCTCCAAAAT-3’
反向:5’-GGCTGTTGTCATACTTCTCATGG-3’
B7-H3引物
正向:5’-AGGGCAGCCTATGACATTCCC-3’
反向:5’-AGCTCCTGCATTCTCCTCCTCA-3’
-
经过照射的细胞继续培养48 h。将对照组、siB7-H3转染组、照射组、照射+siB7-H3转染组的细胞弃掉培养液,胰酶消化后将细胞吹打均匀,4℃下离心(离心半径10 cm,2000 r/min)10 min后弃上清。使用预冷PBS洗2遍,加入预冷75%乙醇充分重悬细胞,4℃条件固定过夜。离心(离心半径10 cm,2000 r/min)10 min后弃上清,收集固定细胞,预冷PBS洗2遍。用0.5 mL PBS重悬细胞,加入浓度为10 mg/mL核糖核酸酶A 10 μL于37℃水浴中消化30 min,再加入浓度为1 mg/mL的碘化丙啶(propidium iodide,PI)(购自美国BD公司)10 μL后,在冰浴中避光染色30 min,流式细胞仪检测。
-
经过照射的细胞继续培养48 h,将对照组、siB7-H3转染组、照射组、照射+siB7-H3转染组的细胞弃掉培养液,用不含EDTA的胰酶消化,离心(离心半径10 cm,2000 r/min)10 min后收集悬浮细胞,预冷PBS洗涤细胞,调整每管细胞浓度为1×106个/mL,依次加入Annexin V-FITC(磷脂结合蛋白V-异硫氰酸荧光素)和PI试剂,室温避光15 min,流式细胞仪(BD Accuri C6型号,美国BD公司)检测。
-
采用GraphPad Prism 5.0统计软件对数据进行统计学分析。计量资料以“x±s”表示,数据均符合正态分布且方差齐,两组间比较采用配对t检验。P<0.05表示差异有统计学意义。
-
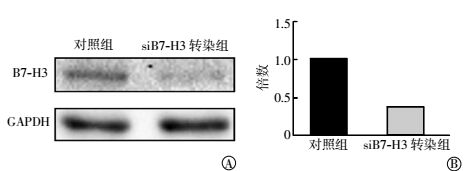
Western blotting法和实时定量PCR方法检测B7-H3蛋白和mRNA的改变,如图 1中A所示,与对照组相比,siB7-H3转染组细胞中的B7-H3蛋白水平明显降低。实时定量PCR结果经2-ΔΔCt分析后显示,siB7-H3转染组细胞中的siB7-H3 mRNA表达量也明显低于对照组细胞(图 1中B),且表达量的差异有统计学意义(t=-4.222,P=0.013)。这些实验结果表明,siB7-H3转染确实可以有效地降低siB7-H3蛋白和mRNA表达水平。
-
如图 2所示,流式细胞仪分析结果显示,B7-H3表达水平的降低导致A549细胞的G0/G1期细胞阻滞,S和G2/M期细胞数量减少(图 2中B)。正如预期的,4 Gy γ射线照射后48 h,A549细胞出现轻微的G0/G1期阻滞和明显的G2/M期细胞阻滞(图 2中C)。而在siB7-H3转染的细胞,照射后不仅导致明显的G2/M周期阻滞,而且也有明显的G0/G1期阻滞(图 2中D)。

图 2 流式细胞仪检测siB7-H3对肺癌A549细胞的细胞周期的影响图中, A:对照组;B:siB7-H3转染组;C:照射组;D:照射+siB7-H3转染组。
Figure 2. Effects of siB7 -H3 on cell cycle progression of lung cancer A549 cells with flow cytometer. Un-irradiated (A) and 4Gy-irradiated (C) A549 cells without transfection; Un-irradiated (B) and 4Gy-irradiated (D) A549 cells transfected with siB7-H3.
-
采用Annexin-V和PI双染色的流式细胞检测方法观察了B7-H3降低对A549细胞辐照引起细胞凋亡的影响。Annexin-V和PI双染色流式细胞检测典型结果解析为:左下为活细胞,左上为坏死细胞,而右象限均为凋亡细胞,其中右上象限为晚凋,右下为早凋(图 3)。如图 3所示,当对数生长的A549细胞受到4 Gy γ射线照射,细胞的坏死率(从2.59%上升至14.88%)和凋亡率(从7.73%上升至17.94%)明显增加(表 1)。siB7-H3转染组与对照组相比,降低B7-H3蛋白表达,A549细胞的坏死率和凋亡率无明显改变;照射+siB7-H3转染组与照射组相比,B7-H3蛋白的降低没有明显改变辐照诱导的细胞坏死率和凋亡率(图 3和表 1)。

图 3 流式细胞仪检测siB7-H3对肺癌A549细胞凋亡的影响图中, A:对照组;B:siB7-H3转染组;C:照射组;D:照射+siB7-H3转染组;AnnexinV-FITC:磷脂结合蛋白V-异硫氰酸荧光素;PI:碘化丙啶。
Figure 3. Effects of siB7-H3 on apoptosis of irradiated A549 cells with flow cytometer. Un-irradiated (A) and 4Gy-irradiated (C) A549 cells without transfection; Un-irradiated (B) and 4Gy-irradiated (D) A549 cells transfected with siB7-H3.
组别 活细胞率/% 坏死率/% 凋亡率/% 对照组 89.68 02.59 07.73 siB7-H3转染组 89.77 02.51 07.71 照射组 67.18 14.88 17.94 照射+ siB7-H3转染组 69.67 11.34 18.99 注:siB7-H3转染组为转染了靶向B7-H3蛋白的siRNA的肺癌A549细胞。 表 1 siB7-H3对肺癌A549细胞凋亡的影响
Table 1. Effects of siB7-H3 on apoptosis of irradiated lung cancer
-
放疗通过电离辐射直接或间接损伤细胞的DNA,导致DNA双链断裂,进而启动一系列生物效应导致细胞死亡。然而,无论是正常细胞还是肿瘤细胞都有完善的DNA损伤修复系统,该系统既是正常细胞维持自身基因组稳定的保护和防御机制,同时也是肿瘤细胞对放疗抵抗的重要机制之一[18]。分子靶向治疗是现阶段肿瘤治疗的一个新趋向,将其与放疗结合,可以在增强放射敏感性的同时减少不良反应,改善患者预后,降低病死率[19]。
本研究结果显示,给予A549肺癌细胞4 Gy γ射线的照射,细胞发生了轻微的G0/G1期检查点阻滞和明显的G2/M期检查点阻滞,提示辐照导致的细胞DNA损伤启动了典型的细胞周期阻滞,允许细胞在进入下一个细胞周期分裂之前进行DNA损伤修复。而非常有趣的是敲降B7-H3的A549细胞,给予相同剂量照射,除了细胞发生了明显的G2/M期阻滞外,也出现明显的G0/G1期阻滞。显然,照射导致敲降B7-H3的A549细胞有明显的G0/G1期阻滞的可能性有2种情况:(1)B7-H3表达水平的降低可能直接作用G0/G1细胞周期,解除了其对细胞G0/G1检查点其他控制蛋白的抑制作用,从而提示B7-H3可能是G0/G1检查点的重要调节蛋白。(2)B7-H3表达水平的降低可能导致辐射引起的G2/M检查点的中断(disruption),换句话说,辐照敲降B7-H3的A549细胞出现的G0/G1期细胞数量的增加可能原因是来自辐照导致的第一个细胞周期的G2/M检查点阻滞中断而进入第二个细胞周期的G0/G1期。我们已知,细胞调控周期蛋白异常、细胞周期检查点缺陷是肿瘤发生的根本原因,通过对它的研究,将帮助我们在临床上实现对肿瘤的预测、预警及早期诊断。G2/M检查点是由p53激活Gadd45α(生长抑制及DNA损伤诱导基因45α)蛋白所控制的,在没有p53的肺癌细胞中,hnRNPA0(人异质性胞核核糖核蛋白)可稳定编码Gadd45α的mRNA。而启动G1/S的检查点,p53激活p21细胞周期蛋白依赖性激酶抑制剂蛋白。当p53缺失时,hnRNPA0可稳定编码p27(p21的一个备份)蛋白的mRNA。总之,Gadd45α和p27可帮助癌细胞中止细胞周期,并修复DNA,继续分裂。因此,我们目前正在开展的工作就是通过分别采用G0/G1期驱动蛋白抑制剂以及M期驱动蛋白抑制剂,深入研究B7-H3是影响G0/G1检查点还是影响G2/M检查点,从而导致G2/M检查点阻滞的中断。在机制研究方面,B7-H3是直接影响细胞周期检查点,还是通过p53依赖或者p53非依赖性信号通路调节而影响细胞周期检查点,这些也是我们研究的内容。实际上,已有研究结果揭示B7-H3与p53之间确实存在密切关系[20]。
辐射导致敲降B7-H3的A549细胞明显的G0/G1期阻滞,提示B7-H3在调节肺癌细胞放射敏感性上存在两种截然不同的作用。如果是发生第一种假设的细胞周期阻滞,B7-H3可能参与提高辐照导致DNA损伤的修复,则导致细胞辐射耐受性的增加。但是,如果是第二种细胞周期阻滞改变的发生,由于B7-H3导致辐照诱导的G2/M期阻滞中断,则可能导致肺癌细胞辐射敏感性的提高。因此,无论是哪一种情况的发生都提示了B7-H3通过参与辐射诱导的肿瘤细胞周期阻滞,从而在肿瘤细胞的放射敏感性调节中起到重要作用。
此外,我们也发现B7-H3蛋白水平的降低并不对辐射诱导的细胞坏死和凋亡产生明显的影响,而B7-H3蛋白是否参与辐射引导的细胞自噬等其他细胞凋亡模式的发生,这是我们目前正在进行的研究。
综上所述,通过本研究,我们首次发现B7-H3蛋白参与了调控辐射诱导的细胞周期阻滞,提示B7-H3在肺癌细胞放射敏感性的调节中起着重要作用。细胞周期调控蛋白异常和细胞周期检查点缺陷或中断是肿瘤发生和发展的关键因素,也可作为临床肿瘤诊断的重要标志物。同时,细胞周期检查点缺陷或中断也是研究包括放疗在内的肿瘤特异性治疗的靶点。因此,深入研究B7-H3蛋白作为重要的肿瘤放射治疗敏感性调控的新靶点具有重要意义和临床价值。
降低B7-H3蛋白对受照肺癌细胞A549细胞周期和凋亡的影响
Study on the effects of B7-H3 down-regulation on cell cycle and apoptosis of lung cancer A549 cells
-
摘要:
目的观察用小干扰RNA(siRNA)敲降B7-H3蛋白的表达对人肺癌细胞A549的细胞周期和凋亡的影响。 方法培养人肺癌A549细胞,将B7-H3蛋白siRNA瞬时转染于A549细胞(称为siB7-H3转染组)。实验分为4组,即对照组、siB7-H3转染组、照射组、照射+siB7-H3转染组。采用137Cs γ射线一次性照射,照射剂量为4 Gy;用Western blotting法和实时定量PCR分别检测B7-H3蛋白和mRNA的表达;流式细胞仪检测细胞周期和细胞凋亡的改变。 结果与对照组相比,siB7-H3转染组的B7-H3蛋白水平明显降低,mRNA表达量也明显低于对照组且差异有统计学意义(t=-4.222,P=0.013)。siB7-H3转染组细胞的G0/G1期细胞阻滞,S和G2/M期细胞数量减少;与对照组相比,照射组出现轻微的G0/G1期阻滞和明显的G2/M期细胞阻滞,照射+siB7-H3转染组的G0/G1、G2/M期均有明显的阻滞。照射后48 h,与对照组相比,照射组细胞的坏死率和凋亡率明显升高,siB7-H3转染组和照射+siB7-H3转染组的坏死率和凋亡率均无明显改变。 结论降低肺癌A549细胞中B7-H3蛋白表达水平可明显增加辐射诱导的G0/G1期阻滞,从而提示B7-H3表达水平的改变可能通过调节G0/G1细胞周期检查点而对肺癌细胞放射敏感性产生重要的调节功能。 Abstract:ObjectiveTo explore the effects of B7-H3 down-regulation on cell cycle and apoptosis in lung cancer A549 cells. Method Human lung cancer cell line A549 were cultured. siB7-H3 RNA which can specifically silence the expression of B7-H3 protein was transfected into A549 cells. 137Cs γ-ray irradiation was used with a single dose of 4 Gy. Experiments included control group, siB7-H3 transfected group, irradiation group, and irradiation+siB7-H3 transfected group. After transfected with siB7-H3, Western blotting and quantitative real-time PCR assays were used to detect the expression of B7-H3 protein and mRNA in A549 cells. The cell cycle and apoptosis of A549 cells following 4 Gy irradiation were detected by flow cytometry. ResultsThe protein and mRNA expression of B7-H3 were significantly decreased in A549 cells transfected with siB7-H3 compared with the control group, and the differences between the two groups were statistically significant(t=-4.222, P=0.013). siB7-H3 transfection induced significant effect on cell cycle with increase of G0/G1 phase arrest and reduction of S and G2/M phase population. A mild enhanced G0/G1 phase arrest and an obvious enhanced G2/M phase arrest of irradiation group were detected compared with the control group. An enhanced G0/G1 and G2/M phase arrest of irradiation+siB7-H3 transfected group were detected compared with the control group. Compared with the control group, the necrosis and apoptosis induction of the irradiated group significantly increased at 48 h after irradiation. However, No significant alterations of necrosis and apoptosis induction were observed between irradiation group and irradiation+ siB7-H3 transfected group. ConclusionsDown-regulation of B7-H3 can significantly elevated the G0/G1 arrest in A549 cells following radiation. This conclusion indicated that the alteration of B7-H3 expression could play a key role in the regulation of the radiosensitivity of lung cancer via mediating the G0/G1 check point. -
Key words:
- Lung neoplasms /
- Carcinoma, non-small-cell lung /
- Cell cycle /
- Apoptosis /
- B7-H3 /
- siRNA
-
图 2 流式细胞仪检测siB7-H3对肺癌A549细胞的细胞周期的影响图中, A:对照组;B:siB7-H3转染组;C:照射组;D:照射+siB7-H3转染组。
Figure 2. Effects of siB7 -H3 on cell cycle progression of lung cancer A549 cells with flow cytometer. Un-irradiated (A) and 4Gy-irradiated (C) A549 cells without transfection; Un-irradiated (B) and 4Gy-irradiated (D) A549 cells transfected with siB7-H3.
图 3 流式细胞仪检测siB7-H3对肺癌A549细胞凋亡的影响图中, A:对照组;B:siB7-H3转染组;C:照射组;D:照射+siB7-H3转染组;AnnexinV-FITC:磷脂结合蛋白V-异硫氰酸荧光素;PI:碘化丙啶。
Figure 3. Effects of siB7-H3 on apoptosis of irradiated A549 cells with flow cytometer. Un-irradiated (A) and 4Gy-irradiated (C) A549 cells without transfection; Un-irradiated (B) and 4Gy-irradiated (D) A549 cells transfected with siB7-H3.
表 1 siB7-H3对肺癌A549细胞凋亡的影响
Table 1. Effects of siB7-H3 on apoptosis of irradiated lung cancer
组别 活细胞率/% 坏死率/% 凋亡率/% 对照组 89.68 02.59 07.73 siB7-H3转染组 89.77 02.51 07.71 照射组 67.18 14.88 17.94 照射+ siB7-H3转染组 69.67 11.34 18.99 注:siB7-H3转染组为转染了靶向B7-H3蛋白的siRNA的肺癌A549细胞。 -
[1] Gomez-Casal R, Bhattacharya C, Ganesh N, et al. Non-small cell lung cancer cells survived ionizing radiation treatment display cancer stem cell and epithelial-mesenchymal transition phenotypes[J/OL]. Mol Cancer, 2013, 12(1):94[2017-02-01]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3751356/pdf/1476-4598-12-94.pdf.DOI:10.1186/1476-4598-12-94" target="_blank">10.1186/1476-4598-12-94">https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3751356/pdf/1476-4598-12-94.pdf.DOI:10.1186/1476-4598-12-94. [2] 李景涛, 邓垒, 张文珏, 等.广泛期小细胞肺癌胸部IMRT后发生放射性肺炎的危险因素分析[J].国际放射医学核医学杂志, 2016, 40(2):100-105. DOI:10.3760/cma.j.issn.1673-4114. 2016.02. 003.
Li JT, Deng L, Zhang WJ, et al. Risk factor analysis for predicting radiation pneumonitis in extensive stage small cell lung cancer patients receiving IMRT thoracic radiotherapy[J]. Int J Radiat Med Nucl Med, 2016, 40(2):100-105. doi: 10.3760/cma.j.issn.1673-4114.2016.02.003[3] Ma W, Ma CN, Li XD, et al. Examining the effect of gene reduction in miR-95 and enhanced radiosensitivity in non-small cell lung cancer[J]. Cancer Gene Ther, 2016, 23(2/3):66-71. DOI:10.1038/cgt.2016.2. [4] Torres-Roca JF, Stevens CW. Predicting response to clinical radiotherapy:past, present, and future directions[J]. Cancer Control, 2008, 15(2):151-156. [5] Chapoval AI, Ni J, Lau JS, et al. B7-H3:a costimulatory molecule for T cell activation and IFN-gamma production[J]. Nat Immunol, 2001, 2(3):269-274. DOI:10.1038/85339. [6] Ling V, Wu PW, Spaulding V, et al. Duplication of Primate and rodent B7-H3 immunoglobulin V-and C-like domains:divergent history of functional redundancy and exon loss[J]. Genomics, 2003, 82(3):365-377. DOI:10.1016/S0888-7543(03)00126-5. [7] Prasad DV, Nguyen T, Li Z, et al. Murine B7-H3 is a negative regulator of T cells[J]. J Immunol, 2004, 173(4):2500-2506. DOI:10.4049/jimmunol.173.4.2500. [8] Sun M, Richards S, Prasad DV, et al. Characterization of mouse and human B7-H3 genes[J]. J Immunol, 2002, 168(12):6294-6297. DOI:10.4049/jimmunol.168.12.6294. [9] Yamato I, Sho M, Nomi T, et al. Clinical importance of B7-H3 expression in human pancreatic cancer[J]. Br J Cancer, 2009, 101(10):1709-1716. DOI:10.1038/sj.bjc.6605375. [10] Roth TJ, Sheinin Y, Lohse CM, et al. B7-H3 ligand expression by prostate cancer:A novel marker of prognosis and potential target for therapy[J]. Cancer Res, 2007, 67(16):7893-7900. DOI:10.1158/0008-5472.CAN-07-1068. [11] Zang X, Thompson RH, Al-Ahmadie HA, et al. B7-H3 and B7x are highly expressed in human prostate cancer and associated with disease spread and poor outcome[J]. Proc Natl Acad Sci U S A, 2007, 104(49):19458-19463. DOI:10.1073/pnas.0709802104. [12] Crispen PL, Sheinin Y, Roth TJ, et al. Tumor cell and tumor vasculature expression of B7-H3 predict survival in clear cell renal cell carcinoma[J]. Clin Cancer Res, 2008, 14(16):5150-5157. DOI:10.1158/1078-0432.CCR-08-0536. [13] Qin XJ, Zhang HL, Ye DW, et al. B7-H3 is a new cancer-specific endothelial marker in clear cell renal cell carcinoma[J/OL]. Onco Targets Ther, 2013, 6:1667-1673[2017-02-01]. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3833620/pdf/ott-6-1667.pdf.DOI:10.2147/OTT.S53565" target="_blank">10.2147/OTT.S53565">https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3833620/pdf/ott-6-1667.pdf.DOI:10.2147/OTT.S53565. [14] Sun Y, Wang Y, Zhao J, et al. B7-H3 and B7-H4 expression in non-small-cell lung cancer[J]. Lung Cancer, 2006, 53(2):143-151. DOI:10.1016/j.lungcan.2006.05.012. [15] Schneider T, Hoffmann H, Dienemann H, et al. Non-small cell lung cancer induces an immunosuppressive phenotype of dendritic cells in tumor microenvironment by upregulating B7-H3[J]. J Thorac Oncol, 2011, 6(7):1162-1168. DOI:10.1097/JTO.0b013e31821c-421d. [16] Boland JM, Kwon ED, Harrington SM, et al. Tumor B7-H1 and B7-H3 expression in squamous cell carcinoma of the lung[J]. Clin Lung Cancer, 2013, 14(2):157-163. DOI:10.1016/j.cllc.2012.05. 006. [17] Jin YJ, Zhang P, Li J, et al. B7-H3 in combination with regulatory T cell is associated with tumor progression in primary human non-small cell lung cancer[J/OL]. Int J Clin Exp Pathol, 2015, 8(11):13987-13995[2017-02-01]. http://europepmc.org/backend/ptpmcrender.fcgi?accid=PMC4713496&blobtype=pdf. [18] Ding J, Miao ZH, Meng LH, et al. Emerging cancer therapeutic opportunities target DNA-repair systems[J]. Trends Pharmacol Sci, 2006, 27(6):338-344. DOI:10.1016/j.tips.2006.04.007. [19] Kaliberov SA, Kaliberova LN, Yari H, et al. Retargeted adenoviruses for radiation-guided gene delivery[J]. Cancer Gene Ther, 2016, 23(9):303-314. DOI:10.1038/cgt.2016.32. [20] Lehmann BD, Paine MS, Brooks AM, et al. Senescence-associated exosome release from human prostate cancer cells[J]. Cancer Res. 2008, 68(19):7864-7871. DOI:10.1158/0008-5472.CAN-07-6538. -






 下载:
下载: