-
放射性肠损伤(radiation enteritis,RE)是盆腔、腹腔等肿瘤进行放疗后常见的并发症,肠道正常组织对射线的耐受性较肿瘤组织差,放疗可造成正常组织的放射性损伤,形成RE,其发生率可达5%~17%[1-2]。RE的发病机制复杂,目前仍无有效的临床治疗手段。角质细胞生长因子(keratinocyte growth factor,KGF)从属于成纤维细胞生长因子家族(FGFs),参与组织器官发育、促进细胞分化、增殖及创伤愈合[3],具有抗凋亡作用,在肿瘤的发生、发展中起重要作用[4]。研究表明,KGF预防给药可以明显降低辐射引起的小肠组织损伤[5]。而关于电离辐射作用后对小鼠十二指肠组织KGF基因是否有影响以及KGF对十二指肠放射损伤修复的分子机制还需进一步研究。我们通过研究电离辐射作用后小鼠十二指肠组织KGF表达的变化及其对电离辐射作用后结缔组织生长因子(connective tissue growth factor,CTGF)基因和凋亡相关基因Bcl-2表达的影响,进一步揭示KGF在防治RE中的分子机制,为其预防及治疗提供理论依据。
-
KGF(重庆富进生物医药有限公司);动物组织总RNA提取试剂盒(北京天根生化科技有限公司);Prime ScriPtTM RT reagent Kit和SYBR® Premix Ex TaqTM Ⅱ实时荧光定量PCR试剂(大连宝生物工程有限公司)。60Co治疗机(GWGP-80,中国核动力研究院)。
-
SPF级昆明小鼠,雌雄各半,6~8周龄,体重26~28 g,购于中国食品药品检定研究院国家啮齿类实验动物种子中心,生产许可证号:SCXK(京)2014-0013,饲养于中国辐射防护研究院GLP中心动物实验室。
将实验动物按照随机数表法分为对照组、照射组和治疗组,每组10只,雌雄各半。治疗组于照射前2 d及照射后3 d腹腔注射KGF,给药剂量为6 mg/kg,对照组和照射组仅注射生理盐水。
-
对照组不给予照射,照射组与治疗组均接受腹腔8 Gy照射。照射源为60Co治疗机,照射野为全腹(胸骨剑突至耻骨联合),源皮距80 cm,剂量率为0.678 Gy/min。
-
照射后第15天,将各实验组小鼠空腹12 h后颈椎脱臼处死,解剖小鼠取出完整的十二指肠组织,4%甲醛溶液固定1周后,经无水乙醇脱水、石蜡包埋后制作RE病理切片,苏木精-伊红染色法进行染色。
-
完整的十二指肠组织加入裂解液研磨,提取总RNA,反转录cDNA,利用实时荧光定量PCR分析KGF对CTGF、Bcl-2基因mRNA表达水平的影响。对照组基因表达量为1,以△△Ct法进行相对定量分析各个基因mRNA水平。
-
实验数据采用统计学分析软件IBM SPSS Statistics V21.0进行分析。计量资料符合正态分布,以x±s表示;两组间差异采用独立样本t检验。P < 0.05表示差异有统计学意义。
-
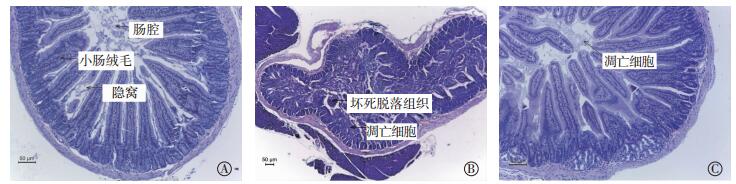
光镜下观察,对照组十二指肠肠绒毛、隐窝结构完整,排列整齐(图 1中A);照射组十二指肠病理结果出现绒毛萎缩、变短或脱落,肠腔内充满坏死脱落的组织,腺窝可见较多凋亡细胞(图 1中B);治疗组肠绒毛组织结构完整,腺窝可见少量凋亡细胞(图 1中C),这表明KGF能够有效减少放射性损伤。
-
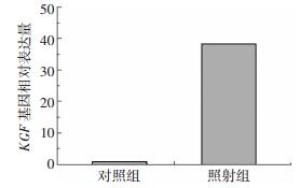
KGF有修复受损黏膜的功能,我们利用8 Gy γ射线照射小鼠腹腔后,十二指肠组织中KGF基因表达量显著增高,是对照组的38倍(图 2),差异有统计学意义(t=-125.55,P < 0.05),这表明机体通过KGF的高表达来修复电离辐射造成的损伤。
-
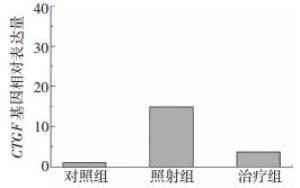
电离辐射可进一步通过炎性相关因子引起肠上皮细胞的损伤,治疗组CTGF基因表达与照射组相比显著下调,差异有统计学意义(t=4.89,P < 0.05);但照射组、治疗组中CTGF基因表达量均高于对照组,差异有统计学意义(t=-6.55,-3.10,均P < 0.05),结果见图 3。
-
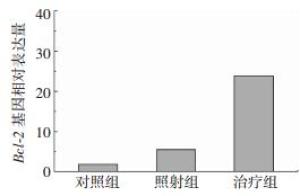
利用荧光定量PCR检测凋亡相关基因Bcl-2,结果显示,KGF给药后凋亡相关基因Bcl-2表达量与照射组相比显著上调,差异有统计学意义(t=-20.96,P < 0.05),且照射组与治疗组中Bcl-2基因表达量均显著高于对照组(t=-6.69、-40.65,均P < 0.05),这表明KGF对细胞凋亡起到了抑制作用,结果见图 4。
-
KGF从属于成纤维细胞生长因子(FGFs)家族,又称FGF-7,参与组织器官发育、促进上皮细胞生长增殖及创伤愈合、具有抗凋亡作用,在肿瘤的发生、发展中起重要作用[3-4]。通常KGF在损伤修复过程中大量表达,外用能有效地促进创面再上皮化[6]。我们检测了电离辐射照射后小鼠十二指肠组织中KGF基因mRNA表达水平,结果显示,电离辐射能够诱导实验动物自身KGF基因表达水平显著升高,这是因为在辐射刺激下,成纤维细胞通过分泌KGF促进细胞的增殖、迁移以及黏膜上皮细胞的再生,以减轻放射损伤。Krishnan等[7]给予葡聚糖硫酸钠(DSS)诱导的肠道损伤小鼠KGF治疗,显微镜下也观察到隐窝完整、上皮轻度缺损以及炎症浸润减轻,说明KGF具有改善和缓解溃疡,减轻损伤的功效。同时,我们通过病理切片能够观察到,给予KGF的治疗组肠绒毛组织结构完整,而照射组肠绒毛萎缩、变短、脱落明显,这也说明KGF能够有效降低放射性损伤,进一步揭示KGF在放射性十二指肠损伤防护作用中的分子机制。
CTGF通过激活Ras/Raf/ERK等信号通路进一步促进成纤维细胞分裂增殖及胶原沉积,最终促进纤维化的发生与发展[8]。CTGF同时具有诱导凋亡的作用,还可以专一介导转化因子β1的促纤维化作用[9-10]。有文献报道,CTGF作为介导转化因子β1的下游效应介质,在生理状态下几乎不表达,而在肺纤维化过程中表达明显升高,且与肺纤维化程度呈正相关[11]。同时CTGF还可以通过自分泌的方式增强肠道肌纤维母细胞的活化,引起辐射剂量依赖的胶原合成增加促进纤维化[12]。从研究结果发现,电离辐射能够诱导CTGF基因相对表达量升高,而KGF治疗组与照射组相比,CTGF基因表达显著下调,说明KGF能够有效抑制肠损伤的纤维化进程,对RE起到有效的防护作用。刘小菁等[13]利用RNA干扰技术来抑制CTGF基因的表达,发现能够明显抑制人肺成纤维细胞的增殖及表型转化。通常在生理状态下,CTGF几乎不表达,而在纤维化过程中其表达水平明显增高,且与纤维化程度呈正相关[11, 14],而抑制CTGF的表达能阻止纤维化系列反应进程[15-16]。因此,CTGF的表达水平能够有效地反映KGF对肠损伤的修复情况。
正常肠上皮细胞存在凋亡现象,通过清除衰老细胞来维持上皮的完整性,是肠上皮细胞更新的生理过程[17]。Bcl-2基因是重要的凋亡相关基因,能够抑制或阻断多种因素引起的细胞凋亡。本研究结果显示,γ射线照后15 d小鼠十二指肠组织Bcl-2基因表达显著升高,这可能是由于细胞进入恢复期,细胞凋亡逐渐降低导致的。病理结果也显示,照射组肠绒毛处可见凋亡细胞,通过高表达Bcl-2基因来抑制凋亡。KGF具有抗凋亡的作用,可通过抑制凋亡相关因子的表达和增加Bcl-2的表达来减少细胞凋亡。Wildhaber等[18]研究KGF对凋亡的作用,发现营养缺乏致肠上皮细胞凋亡的小鼠中,KGF降低了细胞的凋亡,且上调了Bcl-2 mRNA的表达。同时我们发现,治疗组与照射组相比,Bcl-2基因表达显著上调,同时,光镜下观察治疗组只可见少量凋亡细胞,这主要是由于KGF对凋亡的抑制作用造成的。
综上所述,KGF能够有效降低生物放射性损伤,并可能通过下调CTGF基因修复电离辐射造成的损伤,通过调节凋亡相关基因Bcl-2的表达水平来降低细胞凋亡。我们认为KGF可减轻辐射引起的肠损伤,在RE防护中起到了一定作用,提示KGF有望成为新的放射防护药物,为RE的预防及治疗提供了实验依据,但深入的分子机制仍需进一步研究。
KGF对电离辐射后十二指肠中CTGF和Bcl-2基因表达的影响
The influence of KGF on CTGF and Bcl-2 gene in duodenal tissue induced by radiation
-
摘要:
目的 观察角质细胞生长因子(KGF)对电离辐射后十二指肠结缔组织生长因子(CTGF)、凋亡相关基因Bcl-2表达的影响,初步探讨KGF在肠道损伤中的分子机制。 方法 将昆明小鼠按随机数表法分为对照组、照射组、治疗组,每组10只。对照组不给予照射,照射组与治疗组给予剂量率为0.678 Gy/min、吸收剂量8 Gy的腹腔γ射线照射;治疗组在照射前2 d及照射后3 d均腹腔注射KGF,给药量为6 mg/kg。照射后第15天处死小鼠,取十二指肠组织做病理切片并观察病理表现;采用荧光定量PCR方法检测十二指肠组织中KGF、CTGF及Bcl-2基因的表达水平。计量资料以x±s表示;两组间差异采用独立样本t检验,P < 0.05表示差异有统计学意义。 结果 对照组十二指肠肠绒毛、隐窝结构完整,排列整齐;照射组十二指肠出现绒毛萎缩、变短或脱落,部分腺窝和绒毛处可见少量凋亡细胞;治疗组肠绒毛组织结构完整,腺窝可见少量凋亡细胞。照射组十二指肠组织中KGF、CTGF、Bcl-2基因表达量上调,与对照组相比差异具有统计学意义(t=-125.55、-6.55、-6.69,均P < 0.05)。与照射组相比,治疗组CTGF基因表达量显著下调、Bcl-2基因表达量显著上调,差异均有统计学意义(t=4.89,-20.96,均P < 0.05)。 结论 KGF可能通过下调CTGF基因修复电离辐射造成的损伤,并且可能通过调节Bcl-2凋亡相关基因的表达水平来降低细胞凋亡。 Abstract:Objective To observe the effects of keratinocyte growth factor(KGF) on connective tissue growth factor(CTGF) and B-cell lymphoma 2(Bcl-2) gene expressions in radiation-induced duodenal tissue, and to investigate the molecular mechanism of KGF in radiation-induced intestinal injuries. Methods Using the stochastic indicator method, Kunming mice were randomly divided into control, radiation, and treatment groups, each with 10 mice. The control group did not undergo the radiation process. The radiation group and treatment group underwent abdominal cavity irradiation with a dose rate of 0.678 Gy/min and an absorbed dose of 8 Gy with γ-ray. For 2 d before and 3 d after irradiation, KGF with a dose of 6 mg/kg was administered via intraperitoneal injection to the KGF treatment group. All mice were executed 15 d after irradiation, after which the duodenal tissue pathological slices were captured. Quantitative polymerase chain reaction was used to detect the KGF, CTGF, and Bcl-2 gene relative expressions in duodenal tissue. The measurement data were x±s. The two groups were compared using independent samples t-test, and P < 0.05 indicated that the difference was statistically significant. Results For the control group, the duodenum intestinal villus and crypt structure were complete. For the radiation group, villi atrophy was shorter or fell off, and parts of the crypt and villi were observed in few apoptotic cells. For the treatment group, the organizational structure was complete, and a small amount of crypt can be seen in apoptotic cells. Compared with the control group, KGF, CTGF, and Bcl-2 gene expressions significantly increased after irradiation(t=-125.55, -6.55, -6.69, all P < 0.05). Compared with the radiation group, the gene expression of CTGF was significantly down-regulated(t=4.89, P < 0.05), and that of Bcl-2 was significantly up-regulated in the treatment group(t=-20.96, P < 0.05). Conclusions The model of acute radioactive duodenitis was successfully established. KGF repair damage was caused by ionizing radiation through down-regulating CTGF gene, and reduce apoptosis was caused by the regulation of the expression levels of the apoptosis-related Bcl-2 gene. -
-
[1] 董凯, 毕伟.放射性肠炎并发肠梗阻的外科治疗[J].中国临床实用医学, 2008, 2(11):35-36.
Dong K, Bi W.Radioactive enteritis concurrent intestinal obstruction surgical treatment[J].Chin Clin Prac Med, 2008, 2(11):35-36.[2] Leadon SA.Repair of DNA Damage Produced by Ionizing Radiation:A Minireview[J].Semin Radiat Oncol, 1996, 6(4):295-305.DOI:10.1053/SRAO00600295. [3] 于程程, 贾春娥, 陈凤华, 等.细胞因子在急性放射病治疗中研究进展[J].中国职业医学, 2012, 39(5):437-439.
Yu CC, Jia CE, Chen FH, et al.Study progress of cytokines in treatment of acute radiation sickness[J].Chin Occupational Med, 2012, 39(5):437-439.[4] 单菲. KGF在成纤维细胞促进表皮细胞增殖作用中的研究[D]. 济南: 山东大学, 2011.
Shan F.The study on fibroblasts promoting epidermis cells proliferation by KGF[D].Jinan:Shandong University, 2011.[5] 李佳, 王月英, 胡斌, 等. 角质细胞生长因子对小鼠放射性肠损伤的治疗作用[J/OL]. 中华临床医师杂志: 电子版, 2013, 7(13): 5953-5955[2016-12-20].
Li J, Wang YY, Hu B, et al.Keratinocyte growth factor treatment prevents radiation-induced intestinal damage in a mouse model[J/OL].Chin J Clin (Electronic Edition), 2013, 7(13):5953-5955[2016-12-20].[6] Kim K, Mcbride WH.Modifying radiation damage[J].Curr Drug Targets, 2010, 11(11):1352-1365.DOI:10.2174/1389450111009011352. [7] Krishnan K, Arnone B, Buchman A.Intestinal growth factors:potential use in the treatment of inflammatory bowel disease and their role in mucosal healing[J].Inflamm Bowel Dis, 2011, 17(1):410-422.DOI:10.1002/ibd.21316. [8] Yarnold J, Brotons MC.Pathogenetic mechanisms in radiation fibrosis[J].Radiother Oncol, 2010, 97(1):149-161.DOI:10.1016/j.radonc.2010.09.002. [9] Silver FH, Devore D, Siperko LM.Invited review:role of mechanophysiology in aging of ECM:effects of changes in mechanochemical transduction[J].J Appl Physiol (1985), 2003, 95(5):2134-2141.DOI:10.1152/japplphysiol.00429.2003. [10] Akhurst RJ, Hata A.Targeting the TGF beta signalling pathway in disease[J].Nat Rev Drug Discov, 2012, 11(10):790-811.DOI:10.1038/nrd3810. [11] Chen CM, Wang LF, Chou HC, et al.Up-regulation of connective tissue growth factor in hyperoxia-induced lung fibrosis[J].Pediatr Res, 2007, 62(2):128-133.DOI:10.1203/PDR.0b013e3180987202. [12] 邱啸臣, 张博, 李元新.慢性放射性肠炎的研究进展[J].大连医科大学学报, 2015, 37(3):306-310.DOI:10.11724/jdmu.2015.03.25.
Qiu XC, Zhang B, Li YX.Research progress in chronic radiation enteritis[J].J Dalian Med Univ, 2015, 37(3):306-310. doi: 10.11724/jdmu.2015.03.25[13] 刘小菁, 吴文超, 陈槐卿.CTGF基因沉默对肺成纤维细胞增殖及表型转化的影响[J].生物医学工程学杂志, 2008, 25(2):407-412.DOI:10.3321/j.issn:1001-5515.2008.02.037.
Liu XJ, Wu WC, Chen HQ.Effects of CTGF gene silencing on the proliferation and myofibroblast differentiation of human lung fibroblasts[J].J Biomed Eng, 2008, 25(2):407-412. doi: 10.3321/j.issn:1001-5515.2008.02.037[14] Westbury CB, Yarnold JR.Radiation fibrosis-current clinical and therapeutic perspectives[J].Clin Oncol (R Coll Radiol), 2012, 24(10):657-672.DOI:10.1016/j.clon.2012.04.001. [15] Ikawa Y, Ng PS, Endo K, et al.Neutralizing monoclonal antibody to human connective tissue growth factor ameliorates transforming growth factor-beta-induced mouse fibrosis[J].J Cell Physiol, 2008, 216(3):680-687.DOI:10.1002/jcp.21449. [16] Li G, Xie Q, Shi Y.Inhibition of connective tissue growth factor by siRNA prevents liver fibrosis in rats[J].J Gene Med, 2006, 8(7):889-900.DOI:10.1002/jgm.894. [17] Ohmori S, Shiraki K, Sugimoto K, et al.High expression of CD34-positive sinusoidal endothelial cells is a risk factor for hepatocellular carcinoma in patients with HCV-associated chronic liver diseases[J].Hum Pathol, 2001, 32(12):1363-1370.DOI:10.1053/hupa.2001.29678. [18] Wildhaber BE, Yang H, Teitelbaum DH.Total parenteral nutrition-induced apoptosis in mouse intestinal epithelium:modulation by keratinocyte growth factor[J].J Surg Res, 2003, 112(2):144-151. doi: 10.1016/S0022-4804(03)00160-4 -






 下载:
下载: