-
目前, 我国癌症的发病率和病死率仍在不断攀升, 放疗仍然在临床肿瘤治疗中占据着不可替代的重要地位[1]。然而, 常规的放疗对患者的辐射面积较大, 并且用于穿透人体组织所需的放射性剂量较高, 因此对人体的正常组织会造成很大的非特异性辐射损伤[2-4]。现阶段, 基于125I的放射性粒子植入治疗技术被广泛应用于乳腺癌、皮肤癌、前列腺癌和宫颈癌等癌症的治疗, 即通过影像引导将密封载体中的放射性核素粒子(简称为放射籽源)穿刺植入到肿瘤组织内, 利用其释放的低能量γ射线杀死肿瘤细胞, 从而达到治疗癌症的目的[5-6]。虽然此手段在临床肿瘤治疗中取得了良好的效果, 并且不良反应较小, 但是125I放射籽源为钛合金外壳, 植入后不能被人体吸收, 同时植入部位可有短时烧灼感, 不利于后续的再次植入治疗。因此, 本实验利用具有渗透性的、能够原位注射的温敏水凝胶(PECT-RGD凝胶, 其中, PECT为含环醚侧基聚己内酯-聚乙二醇三嵌段共聚物; RGD为含有精氨酸-甘氨酸-天冬氨酸的短肽)为基础, 通过物理作用将131I标记的透明质酸[131I-HA-API, 其中, HA为透明质酸, API为1-(3-氨丙基)咪唑]负载到PECT-RGD凝胶中, 形成的新型放疗制剂能够原位注射到肿瘤组织, 形成凝胶制剂后能够实现对肿瘤组织的持久的特异性放疗; 简便、快捷的注射及良好的成胶特性一方面解决了植入时所带来的不便, 另一方面能够使131I长时间稳定在凝胶内, 不会因凝胶快速降解导致131I扩散至非肿瘤组织, 进而避免其对正常组织带来不良作用。
-
131I放射性核素(放射性比活度为185 GBq/mg)购自美国PE公司; 氯胺-T、焦亚硫酸钠购自北京鼎国昌盛生物技术有限公司; N, N′-二环己基碳酰亚胺(N, N′-Dicyclohexylcarbodiimide, DCC)、N-羟基琥珀酰亚胺(N-Hydroxysuccinimide, NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐[1-(3-Dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride, EDC·HCl]、4-二甲氨基吡啶(4-dimethylaminopyridine, DMAP)、API购自百灵威科技有限公司; HA相对分子质量为7000, 购自山东福瑞达医药集团公司; 多肽RGD购自上海吉尔生化有限公司; 其他化学试剂均购于希恩思生化科技有限公司。PECT由中国医学科学院生物医学工程研究所王伟伟副研究员惠赠。肝癌细胞HepG2为实验室自有。ICR小鼠, SPF级(无特定病原体级), 雌性, 平均体重为(20.0±0.5) g, 购自军事医学科学院[许可证号:SCXK-(军)2007-004], 所有动物实验均遵循《实验动物保护条例》。
-
1H核磁共振波谱仪(VARIAN Unity Plus 400 MHz, Varian Instruments, 美国); 全波长酶标仪(VARIOSKAN FLASH, Thermo scientific, 美国); 全自动γ计数仪(2470 WIZARD2, PerkinElmer, 美国); 放射性薄层色谱扫描仪(AR-2000, Bioscan公司, 美国); 放射性小动物活体成像系统(IS In Vivo FX, Care-stream Health公司, 美国)。
-
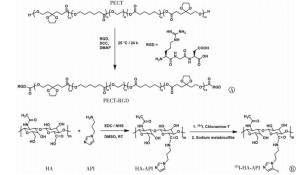
PECT-RGD的合成是通过PECT末端的羟基(-OH)与多肽RGD上的羧基(-COOH)之间的酯化反应得到的, 具体合成路线如图 1中A所示。称取1.17 g PECT、300 mg DCC、177 mg DMAP和175 mg RGD置于100 mL单口瓶中, 加入30 mL N, N-二甲基甲酰胺(DMF)溶解, 室温下反应24 h。待反应结束后, 用冰乙醚反复沉淀, 过滤, 真空干燥, 得到PECT-RGD。通过1H核磁共振波谱仪对聚合物PECT-RGD进行化学结构表征。
-
称取50 mg PECT-RGD置于小瓶, 充分溶解于生理盐水中, 使其浓度为体系的25%(w/w)。然后将小瓶置于恒温水浴锅中加热至正常生理温度(37℃)。将小瓶取出进行翻转, 观察小瓶内溶液的流动情况, 倒置小瓶30 s内不流动定义为凝胶状态。PECT凝胶的制备方法均同上。
首先, 用含10%胎牛血清、100 U/mL青霉素和链霉素的RMPI 1640培养肝癌细胞HepG2, 置于37℃、5% CO2、饱和湿度的细胞培养箱中培养。然后采用MTT法, 将对数生长期的HepG2细胞按照每孔5000个的密度接种到96孔板中, 常规培养24 h。之后, 每孔加入不同浓度的聚合物PECT-RGD和PECT, 继续培养24 h。每孔加入25 μL MTT溶液, 孵育4 h后弃去培养基, 每孔加入100 μL无水二甲基亚砜(dimethyl sulfoxide, DMSO), 室温孵育15~20 min, 振荡培养板, 用全波长酶标仪在570 nm波长处检测各孔的光吸收值, 计算细胞相对增殖百分率。
-
首先通过酰胺化反应将API接枝到HA的侧链上, 具体合成路线如图 1中B所示。具体方法如下, 称取240 mg HA置于25 mL单口瓶中, 加入5 mL DMSO, 在80℃条件下加热4 h将其充分溶解。然后将反应瓶冷却至室温, 加入118 mg EDC·HCl和142 mg NHS, 再继续搅拌2 h活化羧基。随后, 将77 mg API溶解于1 mL无水DMSO中, 并逐滴加入到反应瓶中, 室温条件下继续反应24 h。待反应结束后, 将反应液置于截留相对分子质量为3500的透析袋内, 以超纯水作为透析液, 透析72 h, 除去DMSO。最后将透析袋中的溶液真空冷冻干燥, 得到HA-API。利用1H核磁共振波谱仪对其进行化学结构表征。第二步, 通过氯胺T法对HA-API进行放射性同位素131I标记。称取50 mg HA-API溶解于2 mL磷酸盐缓冲液(pH=8.5, 5 mmol)中, 加入10 μL放射性131I溶液和25 μL氯胺T溶液(2 mg/mL), 室温震荡反应3 min, 再加入50 μL焦亚硫酸钠溶液(10 mg/mL)用以终止反应。将反应物用甲醇反复沉淀, 高速离心3次(离心力15 000×g), 每次离心5 min, 最终得到纯化的131I-HA-API。通过放射性薄层色谱扫描仪和全自动γ计数仪检测标记物的标记率以及纯化后的131I-HA-API的放化纯度。
-
称取50 mg PECT-RGD和1 mL的131I-HA-API (10 mg/mL)置于小瓶中, 充分溶解于生理盐水中, 制备出浓度体系为25%(w/w)的131I@PECT-RGD溶液。此溶液在紫外线杀菌灯下照射30 min用于灭菌。取50 mg/mL的131I@PECT-RGD溶液, 用注射器抽取0.2 mL注射到ICR小鼠皮下, 分别于给药后1、14和21 d用放射性小动物活体成像系统对小鼠体内植入的凝胶进行成像, 分析凝胶的体内稳定性及降解情况。
-
按照步骤1.2.4常规培养大量HepG2细胞, 随后在5×107的细胞密度下皮下接种于ICR小鼠右前肢腋下, 共接种30只。常规饲养肿瘤模型小鼠, 待肿瘤体积约为100 mm3时, 将小鼠简单随机分为3组(PBS组、131I@PECT凝胶组、131I@PECT-RGD凝胶组), 每组10只。然后, 分别将0.2 mL灭菌的PBS、131I@PECT凝胶、131I@PECT-RGD凝胶皮下注射到肿瘤组织周围, 每隔2 d分别测量小鼠的肿瘤体积和体重指标, 测量至第20天时, 用水合氯醛麻醉致死小鼠, 取肿瘤组织进行苏木精-伊红染色[7], 观察不同治疗组的肿瘤损伤及坏死程度。肿瘤体积的计算方法如下:
肿瘤体积(mm3)=肿瘤长径×肿瘤短径的平方/2
-
应用SPSS 19.0软件对数据进行统计学分析, 符合正态分布计量的数据用x±s表示, 并采用单因素方差分析数据, 进行LSD-t检验。P < 0.05表示差异有统计学意义。
-
PECT-RGD的1H核磁谱图如图 2中A所示。PECT中氢原子的化学位移在谱图中都有归属, 与文献中的报道一致[8]。同时, 化学位移2.9 ppm附近出现RGD中亚甲基的特征峰, 证明成功合成了PECT-RGD。通过计算相应峰面积比, 得到RGD的修饰率约为13%。
HA-API的1H核磁图谱如图 2中B所示, 化学位移7.0~8.5 ppm处为API上咪唑环上芳香氢的特征峰, 证明API与HA连接成功[9]。
-
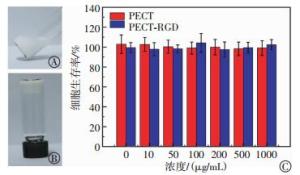
采用小瓶翻转法验证131I@PECT-RGD的形成, 结果如图 3中A、B所示。131I@PECT-RGD溶液在室温条件下呈现可流动的流体状态(图 3中A), 而当加热至37℃后, 其溶液转变为不流动的半固体凝胶状态。细胞毒性实验结果表明, 细胞在浓度高达1000 μg/mL的PECT和PECT-RGD中培养后仍保持着接近100%的生存率(图 3中C)。
-
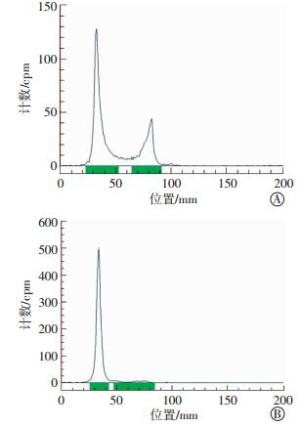
131I-HA-API的标记率见图 4中A, 经软件微积分计算其标记率为73.1%, 经过甲醇沉淀, 高速离心纯化后的131I-HA-API的纯度见图 4中B, 经软件微积分计算其纯度为98.6%, 满足后续试验的需求。
-
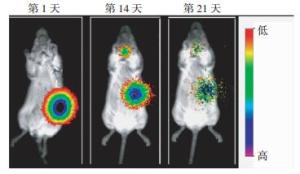
131I@PECT-RGD凝胶在ICR小鼠体内的稳定性结果如图 5所示, 注射的131I@PECT-RGD凝胶一直稳定滞留在注射部位; 直到第14天, 131I经历了约2个半衰期后开始降解(甲状腺处见同位素信号), 但注射部位的凝胶仍具有较高的放射性信号, 且未向注射临近部位扩散; 在第21天发现凝胶注射部位的放射性信号开始明显减少并向周围扩散。
-
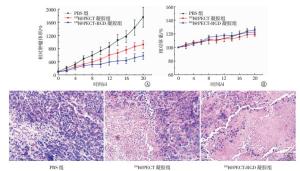
131I@PECT-RGD凝胶体内抗肿瘤效率的结果见图 6, 与PBS对照组比较, 131I@PECT-RGD凝胶组和131I@PECT凝胶组均呈现较高的抗肿瘤效率, 差异有统计学意义(F=71.968, P < 0.05);新型渗透性131I@PECT-RGD凝胶组与131I@PECT凝胶组比较, 差异同样也具有统计学意义(t=7.276, P < 0.05)。通过监测小鼠的体重指标来判断是否对小鼠产生不良作用或毒性, 如图 6中B所示, 3组小鼠体重差异无统计学意义(F=3.878, P > 0.05)。
通过苏木精-伊红染色比较研究不同治疗组别的肿瘤组织坏死程度, 结果见图 6中C, PBS组仅出现一小部分坏死, 而经过131I@PECT-RGD凝胶和131I@PECT凝胶治疗的肿瘤组织均呈现了不同程度的坏死, 其中渗透性131I@PECT-RGD凝胶治疗后的肿瘤细胞基本坏死, 且增殖区域少见。
-
温敏性凝胶作为一种局部给药系统, 在肿瘤化疗方面展现了非常好的应用前景[10]。与系统给药相比, 这种温敏性凝胶溶液可以在给药部位原位形成凝胶, 从而长时间地持续释放药物, 提高给药部位的药物浓度, 并降低药物在体内的系统循环, 增强药物治疗效果并降低药物所带来的不良反应或毒性。本研究利用PECT修饰肿瘤细胞靶向短肽RGD, 用来构建渗透性温敏凝胶, 然后负载放疗剂131I标记的透明质酸(131I-HA-API), 实现对肿瘤的持续放疗。
小瓶翻转实验结果表明, 131I@PECT-RGD的成胶温度接近人体正常的体温(37℃), 这种良好的从溶液到凝胶的转变行为能够保证凝胶的体内可注射性及良好的体内稳定性。同时, 细胞毒性实验结果证明了构成凝胶的聚合物呈现出了良好的细胞相容性, 这是因为组成凝胶的材料是基于PEG和脂肪性聚酯(PCL)的两亲性共聚物, 它们都是被美国食品药品监督管理局批准可用于人体的生物医药材料[11-13]。
体内稳定性及降解实验结果表明, 131I@PECT-RGD凝胶可以在小鼠体内稳定存在两周以上, 因此可以阻止凝胶内部负载的131I向正常组织扩散, 从而有效降低放疗剂所带来的不良反应或毒性。在第3周时, 放射性信号的降低说明凝胶在小鼠体内开始发生自降解, 这是因为构成凝胶的PECT两亲性共聚物能够在体内发生水解反应和酶解反应, 被逐渐降解为水溶性高分子PEG和水溶性小分子、二聚体和低聚物等。因此, 这种能够在体内自降解的温敏性凝胶不会对组织产生蓄积毒性, 具有良好的生物相容性。
体内抗肿瘤实验结果表明, 利用凝胶负载放疗剂131I能够很好地实现对肿瘤组织的植入治疗。更重要的是, 131I@PECT-RGD凝胶的放疗效果明显优于131I@PECT凝胶, 这是因为修饰在131I@PECT-RGD凝胶中的肿瘤靶向短肽RGD是整合素及其配体蛋白相互作用的识别位点, 能够与肿瘤细胞表面过量表达的某些整合素(比如αvβ3) 特异性结合[14], 从而使凝胶向肿瘤深层组织渗透, 因此131I射线更容易杀伤肿瘤组织。同时, 在放疗期间小鼠体重与PBS组比较没有明显变化, 说明利用这种凝胶对小鼠的肿瘤进行植入治疗, 不良反应很小。
本课题制备的渗透性131I@PECT-RGD凝胶可以作为一种简便、高效、安全的放疗方法, 为新型放疗剂的设计和开发提供了新的研究思路和方向。未来我们将通过生化指标、血液参数以及脏器指数等进一步深入研究其生物安全性及局部放疗引起的系统毒性, 同时通过化学修饰等方法进一步提高131I的负载率及优化治疗剂量, 为其作为肿瘤植入治疗剂的临床应用提供重要的理论依据。
新型渗透性水凝胶作为载体用于肿瘤的放射性核素植入治疗
New permeable hydrogel for tumor radiotherapy in situ
-
摘要:
目的设计并合成一类新型的渗透性水凝胶,通过物理作用负载放疗剂,用于肿瘤的植入治疗。 方法通过酯化反应合成聚合物PECT-RGD(其中,PECT为含环醚侧基聚己内酯-聚乙二醇三嵌段共聚物;RGD为含有精氨酸-甘氨酸-天冬氨酸的短肽),通过酰胺化反应和氯胺T法制备131I标记的透明质酸,核磁共振氢谱(1H-NMR)对其化学结构进行表征;沉淀离心纯化法对标记的透明质酸进行分离纯化;小瓶翻转法验证凝胶的形成;MTT法研究聚合物材料的细胞毒性;利用放射性小动物活体成像系统研究小鼠体内植入的凝胶的体内稳定性及降解情况;通过抑制肿瘤生长体积和肿瘤组织切片研究131I@PECT-RGD凝胶的体内抗肿瘤效率。 结果聚合物PECT-RGD没有细胞毒性;在正常生理体温(37℃)下能够形成稳定的凝胶,并且可以在体内发生自降解;与PBS组相比,注射131I@PECT-RGD凝胶组和131I@PECT凝胶组均呈现较高的抗肿瘤效率,与PBS组比较差异有统计学意义(F=71.968,P < 0.05);131I@PECT-RGD凝胶组与131I@PECT凝胶组比较,抗肿瘤效率之间的差异也具有统计学意义(t=7.276,P < 0.05);3组小鼠体重差异无统计学意义(F=3.878,P > 0.05);HE染色结果显示,注射PBS组的肿瘤组织仅出现小部分坏死,注射131I@PECT凝胶组的肿瘤组织大部分坏死,注射131I@PECT-RGD凝胶组的肿瘤组织基本坏死。 结论131I@PECT-RGD凝胶能够原位注射到肿瘤组织,具有良好的生物相容性、自降解性和抗肿瘤效果,是一种非常有应用前景的肿瘤局部放疗方法。 Abstract:ObjectiveTo design and synthesize a novel permeable hydrogel loaded with a radiation agent for the implantation radiotherapy of tumors. MethodsThe polymer PECT-RGD[PECT:poly(ε-caprolactone-co-1, 4, 8-trioxa[4.6]spiro-9-undecanone)-poly(ethylene glycol)-poly(ε-caprolactone-co-1, 4, 8-trioxa[4.6]spiro-9-undecanone); RGD:Arg-Gly-Asp] was synthesized by esterification reaction, and an 131I-labeled hyaluronic acid was prepared by amidation reaction and chloramine-T method. The chemical structure of them was characterized by 1H-NMR, and the 131I-labeled hyaluronic acid was isolated and purified by precipitation and centrifugation. Hydrogel formation was verified by vial flipping experiment, and the cytotoxicity of the polymer materials was evaluated by MTT assay. The in vivo stability and degradation of the injected hydrogel were studied using a radioactive small animal live imaging system. The in vivo antitumor effect of the 131I@PECT-RGD hydrogel was investigated by inhibiting tumor growth volume and tumor tissue section. ResultsThe polymer PECT-RGD was non-cytotoxic and could form a stable hydrogel under the normal physiological temperature(37℃). This hydrogel is capable of self-degradation in vivo. Compared with the PBS group, the 131I@PECT-RGD hydrogel and the 131I@PECT gel showed significantly higher anti-tumor efficiency (P < 0.05, F=71.968). A significant difference in anti-tumor efficiency was found between the 131I@PECT and 131I@PECT-RGD hydrogels (P < 0.05, t=7.276). No significant difference in body weight was found among the three groups (P > 0.05, F=3.878). HE staining showed that only a small part of the tumor tissue was necrotic in the PBS group, whereas a large part of the tumor tissue was necrotic in the 131I@PECT group; the tumor tissue of the 131I@PECT-RGD group was generally necrotic. ConclusionsThe 131I@PECT-RGD hydrogel could be injected into tumor tissue in situ and display great biocompatibility, self-degradation ability, and anti-tumor activity. Thus, this hydrogel has potential applications in local radiotherapy. -
Key words:
- Neoplasms /
- Hydrogel /
- Radioisotopes /
- Brachytherapy
-
-
[1] De MO, Vakaet LL, De GT, et al. Radiotherapy of prostate cancer with or without intensity modulated beams:a planning comparison[J]. Int J Radiat Oncol Biol Phys, 2000, 47(3):639-648. doi: 10.1016/S0360-3016(00)00419-3 [2] Moding EJ, Kastan MB, Kirsch DG. Strategies for optimizing the response of cancer and normal tissues to radiation[J]. Nat Rev Drug Discov, 2013, 12(7):526-542. DOI:10.1038/nrd4003. [3] Bentzen SM. Preventing or reducing late side effects of radiation therapy:radiobiology meets molecular pathology[J]. Nat Rev Cancer, 2006, 6(9):702-713. doi: 10.1038/nrc1950 [4] 李功祥, 李险峰.放化疗相关性肺损伤的研究进展[J].国际放射医学核医学杂志, 2010, 34(4):237-241. DOI:10.3760/cma.j.issn.
1673-4114. 2010. 04. 013. Li GX, Li XF. Proress research on of chemoradiotherapy-ralated lung injury[J]. Int J Radiat Med Nucl Med, 2010, 34(4):237-241. doi: 10.3760/cma.j.issn[5] 张淼. 新型碘125籽源核芯的设计与制备研究[D]. 合肥: 中国科学技术大学, 2016: 6-16.
Zhang M. Design and fabrication of new 125I brachytherapy source[D]. Hefei:University of Science and Technology of China, 2016:6-16.[6] 朱晓珉, 方文岩, 陈军, 等. CT导向下125I粒子植入治疗难治生肺癌的疗效观察[J].国际放射医学核医学杂志, 2011, 35(2):114-117. DOI:10.3760/cma.j.issn.
1673-4114. 2011. 02. 012. Zhu XM, Fang WY, Chen J, et al. CT guided interstitial 125I seed implantation treatment of refractory lung cancer[J]. Int J Radiat Med Nucl Med, 2011, 35(2):114-117. doi: 10.3760/cma.j.issn[7] Zhang Y, Yang C, Wang W, et al. Co-delivery of doxorubicin and curcumin by pH-sensitive prodrug nanoparticle for combination therapy of cancer[J/OL]. Sci Rep, 2016, 6:21225[2017-01-19]. https://www.ncbi.nlm.nih.gov/pubmed/26876480. DOI:10.1038/srep21225. [8] Wang W, Deng L, Liu S, et al. Adjustable degradation and drug release of a thermosensitive hydrogel based on a pendant cyclic ether modified poly(ε-caprolactone) and poly(ethylene glycol) co-polymer[J]. Acta Biomater, 2012, 8(11):3963-3973. DOI:10. 1016/j.actbio.2012.07.021. [9] Huang P, Zhang Y, Wang W, et al. Co-delivery of doxorubicin and 131I by thermosensitive micellar-hydrogel for enhanced in situ synergetic chemoradiotherapy[J]. J Control Release, 2015, 220(Pt A):456-464. DOI:10.1016/j.jconrel.2015.11.007. [10] Wang WW, Deng LD, Xu SX, et al. A reconstituted "two into one" thermosensitive hydrogel system assembled by drug-loaded amphiphilic copolymer nanoparticles for the local delivery of paclitaxel[J]. J Mater Chem B, 2013, 1(4):552-563. DOI:10.1039/c2tb00068g. [11] Dhar S, Gu FX, Langer R, et al. Targeted delivery of cisplatin to prostate cancer cells by aptamer functionalized Pt(Ⅳ) prodrug-PLGA-PEG nanoparticles[J]. Proc Natl Acad Sci U S A, 2008, 105(45):17356-17361. DOI:10.1073/pnas.0809154105. [12] Wu J, Zheng Z, Li G, et al. Control of silk microsphere formation using polyethylene glycol(PEG)[J/OL]. Acta Biomater, 2016, 39:156-168[2017-01-19]. http://www.sciencedirect.com/science/article/pii/S1742706116302379. DOI:10.1016/j.actbio.2016.05.019. [13] Gong C, Shi S, Dong P, et al. Synthesis and characterization of PEG-PCL-PEG thermosensitive hydrogel[J]. Int J Pharm, 2009, 365(1/2):89-99. DOI:10.1016/j.ijpharm.2008.08.027. [14] Liu J, Deng H, Liu Q, et al. Integrin-targeted pH-responsive micelles for enhanced efficiency of anticancer treatment in vitro and in vivo[J]. Nanoscale, 2015, 7(10):4451-4460. DOI:10.1039/c4nr07435a. -





 下载:
下载: