-
恶性肿瘤是我国乃至全球主要的公共健康问题,在我国癌症致死占所有疾病死因的1/4[1]。传统的癌症治疗方法主要包括手术治疗、化疗及放疗等。非实体瘤、全身广泛转移的癌症等不能进行有效的手术治疗及放疗,同时化疗因不良反应大、特异性差、疗效低,难以满足临床治疗的需求。随着对恶性肿瘤发病机理研究的不断深入,针对特定致癌基因、蛋白或受体的分子靶向治疗取得了明显效果,相较普通化疗,靶向治疗的特异性强、疗效显著,同时不良反应明显减小,已逐渐成为临床肿瘤治疗的重要手段之一。其中,表皮生长因子受体(epithelial growth factor receptor,EGFR)因分布广泛、生理作用重要而备受关注[2-3],成为最早实现分子靶向治疗的靶点。
PET显像是21世纪初新兴的无创性分子显像方式,其利用正电子核素标记的葡萄糖、核酸、抗体、小分子等物质作为显像剂,通过病灶对显像剂的摄取来反映其代谢或结合情况,可反映病变的基因、分子、代谢及功能状态,将微观复杂的生物过程(如基因表达、突变、信号传导、蛋白表达等)变成直观图像,可实现活体、动态、实时成像,具有高特异度、高灵敏度的特点[4]。PET显像技术在肿瘤、脑、心脏等疾病及药物研究中应用广泛。其中,靶向EGFR的PET显像研究受到临床医师的普遍关注,众多靶向EGFR的PET显像剂被开发利用,笔者回顾总结了靶向EGFR的小分子类PET显像剂,并对其应用前景进行了展望。
-
EGFR由胞外区、跨膜区和胞内区组成,目前靶向EGFR的药物主要有两种:一种是竞争结合胞外配体结合区域的单克隆抗体;另一种是在胞内与ATP竞争性结合EGFR磷酸化位点的小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)(即EGFR-TKI)。在过去的十多年间,美国食品与药品管理局(Food and Drug Administration,FDA)批准上市了靶向EGFR的3种单克隆抗体和6种小分子TKI(表 1),同时有上百种类似药物处于临床研发阶段。但是由于个体分子遗传背景不同,导致该类药物的临床疗效存在较大的个体差异。如西妥昔单抗和帕尼单抗仅适用于无突变的鼠类肉瘤病毒癌基因(KRAS)野生型患者[5],研究表明EGFR-TKI的临床疗效与EGFR的过表达及突变密切相关,EGFR突变是预测TKI疗效的重要指标[6]。如何检测这种个体差异,并逐步实现个体化治疗是目前靶向EGFR肿瘤治疗面临的一个重要问题。
药物名称 商品名 靶点 适应证 西妥昔单抗(Cetunmab) Erbitux EGFR 结直肠癌 帕尼单抗(Panitumumab ) Vectibix EGFR 结直 耐昔妥株单抗(Necitumumab ) Portrazza EGFR 非小细胞肺癌 吉非替尼(Gefitrnib) Iressa EGFR 非小细胞肺癌 埃罗替尼(Erlotinib) Tarceva EGFR 非小细胞肺癌、胰腺癌 拉帕替尼(Lapatmib) Tykerb EGFR: HER-2 乳腺癌 凡德他尼(Vandetanib ) Caprelsa VEGFR: EGFR 甲状腺癌 阿法替尼(Afatinib) Gilotrif EGFR: HER-2 非小细胞肺癌 奥斯替尼(Osimertinib) Tagrisso EGFR 非小细胞肺癌 注:表中,EGFR:表皮生长因子受体;VEGFR:血管内皮生长因子受体;HER-2: 人表皮生长因子受体2。 表 1 美国食品与药品管理局批准的表皮生长因子受体靶向药物
Table 1. Anti-cancer drugs targeting EGFR approved by Food and Drug Administration
目前有效地评估EGFR表达水平和检查EGFR突变最常用的方法主要有PCR-直接测序法、PCR-TaqMan法,其余还有变性高效液相色谱法、蝎形探针扩增阻滞突变系统法、PCR-单链构象多态性法、酶切富集PCR法等[7-8]。但上述方法均需要取肿瘤组织或者外周血样本,具有创伤性。并且由于肿瘤状态的不均一性,小量组织或血液样本的检测结果并不总代表原发灶的生物学特点。另外由于某些特殊肿瘤原发部位难以或者无法取得病理标本,导致为明确基因突变情况的患者在多程治疗后,难以采用基因突变的检测结果预测EGFR-TKI的疗效。因此,目前急需寻找一种准确、实时、无创、在线检测EGFR表达水平和突变情况的方法,以指导临床治疗。靶向EGFR的特异性PET显像使得活体、实时、无创检测EGFR表达水平及突变情况的分子成像成为可能,可为临床中进行分子靶向药物敏感个体的筛选、实时疗效监测及预后评估提供准确、直观的影像学依据。
-
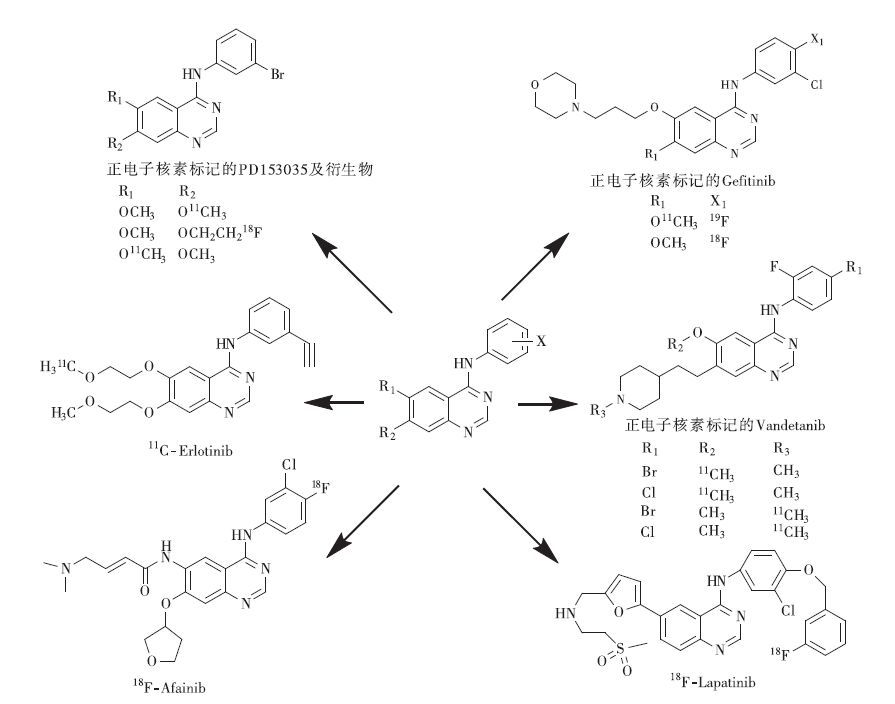
小分子TKI能可逆或者不可逆地与ATP竞争EGFR胞内区酪氨酸激酶磷酸化位点,继而抑制EGFR的酪氨酸磷酸化及下游信号通路传导。目前多种抑制剂被开发合成,已有6种靶向EGFR的TKI通过FDA认证并用于临床治疗。与此同时,正电子核素标记的TKI作为肿瘤示踪剂的研究受到广泛关注,这类PET显像剂大多是喹唑啉衍生物(图 1)。
-
PD153035(AG1517)即4-(3-溴苯氨基)-6,7 双甲氧喹唑啉,1998年曾作为抗癌药物进入FDA一期临床实验,11C标记的PD153035是研究最早的小分子TKI类PET显像剂。早在PET显像技术刚开发应用的20世纪90年代,瑞典卡罗林斯卡医学院的Elander及其团队就利用11C-碘代甲烷亲核取代反应合成了11C-PD153035,并进行了动物体内生物学分布研究[9-10]。后续他们又进行了11C-PD153035在体内的代谢研究,发现显像剂在肝脏的氧化分解作用对其在体内的生物学分布有影响,同时11C标记的位置与显像剂的稳定性及体内分布有直接关联[11-12],这导致用于EGFR的定量检测的显像方法存在一定的局限。国内于金明院士团队对11C-PD153035显像剂摄取与EGFR表达的相关性、体内生物学分布等进行了研究,并进行了竞争抑制实验,结果发现其靶向摄取与EGFR的表达呈正相关,对于EFGR表达阳性的肿瘤PET显像具有较大的应用潜力[13-14]。他们招募了志愿者进行临床研究,对9例非小细胞肺癌患者进行了全身PET/CT扫描,发现肿瘤特异性摄取较高,肾脏、肝脏摄取率分别为23%、19%,显像剂在肺部浓聚,适合胸部肿瘤显像[15]。后来进行的23例经Erlotinib治疗的非小细胞肺癌患者的11C-PD153035 PET/CT显像研究发现,短期(1~2周)治疗时,显像SUVmax较高者用药存活时间较长,SSUVmax较低者存活时间较短,他们认为11C-PD153035 PET/CT显像对小分子TKI敏感个体用药具有一定的指导意义;但长期(6周)药物治疗后,11C-PD153035 PET/CT显像SSUVmax与基线SSUVmax、总生存时间及无疾病进展生存期无相关性,故不能用于监测靶向治疗效果[16]。
-
Gefitinib是第一代用于临床的小分子TKI,因其与EGFR具有较高的亲和性,引起了分子影像研究者的兴趣,其中正电子核素标记的显像剂研究众多。DeJesus等[17]和Murali等[18]首先用18F通过3步放化反应标记Gefitinib作为靶向EGFR的正电子显像剂。Seimbille等[19]也报道了Gefitinib及其类似物的18F放射性标记方法,并进行了生物学分布及荷瘤鼠模型PET显像,但由于所研究肿瘤细胞株有限,在U87-EGFR、U87、H3255、H1975 4种动物模型中未见肿瘤特异性摄取[20]。Läppchen等[21]在前人基础上完成了18F-Gefitinib的全自动合成,在总合成时间2.5 h内,得到了放化纯度大于99%、比活度为14.1 GBq/μmol、放化产率为17.2%的18F-Gefitinib。2006年两位研究者几乎同时分别报道了通过11C-三氟甲磺酸甲酯(MeOTf)合成11C-Gefitinib[22-23]。Zhang等[24]通过11C-碘代甲烷(MeI)合成了11C-Gefitinib,通过体外实验发现,11C-Gefitinib在纤维肉瘤细胞中有特异性摄取,在纤维肉瘤荷瘤鼠体内实验中发现,11C-Gefitinib在体内(肿瘤、肝脏、肾脏、血液)稳定,肿瘤靶向性好、摄取较高,肿瘤/血值、肿瘤/肌肉值分别达6.0和5.0。Kawamura等[25]和Vlaming等[26]利用正电子核素标记Gefitinib,通过PET显像,无创、定量研究p-糖蛋白、乳腺癌耐药性蛋白在Gefitinib脑部用药中的重要作用,结果发现Gefitinib在Abcb1a/1b和Abcg2阴性和被抑制的小鼠模型脑部有较高摄取,这对指导在脑部疾病(肿瘤、阿尔兹海默症等)用药中如何克服血脑屏障的影响研究具有重要意义。
-
Erlotinib是局部晚期或转移性非小细胞肺癌的三线治疗药物,同时也可以用于胰腺癌治疗,是FDA批准的第二个小分子TKI。2009年,Memon等[27]首次报道了11C-Erlotinib的标记,并选取了3种对Erlotinib药物敏感性不同的肺癌细胞(A549、NCI1358、HCC827)模型进行PET显像,结果显示只有对Erlotinib 敏感的HCC827肿瘤摄取高,对Erlotinib不敏感的NCI1358无摄取,11C-Erlotinib可用于区别对Erlotinib敏感的肿瘤模型,具有筛选Erlotinib敏感个体的应用潜力。随后,他们进行了一些临床11C-Erlotinib显像研究,先是对1例32岁EGFR基因19号外显子突变的伴有脑部转移的非小细胞肺癌患者进行显像,发现脑部转移灶对11C-Erlotinib具有特异性摄取[28]。Weber等[29]随后又对13例Erlotinib治疗的非小细胞肺癌患者进行了11C-Erlotinib PET显像研究,发现11C-Erlotinib 在4例患者体内的1处或多处肺癌或淋巴转移部位浓聚,而18F-FDG PET显像没能发现这些病灶,4例中除1例患者死亡外,其余3例患者经Erlotinib治疗后病情均有一定程度的改善。美国耶鲁大学的Petrulli等[30]研究了11C-Erlotinib在胶质瘤和非小细胞肺癌肿瘤模型中的显像,结果表明显像对于EGFR的表达测定和Erlotinib在肿瘤内部作用机理研究具有较好的指导意义。Abourbeh等[31]研究了4种EGFR表达不同的非小细胞肺癌(HCC827、NCI-H3255、NCI-H1975、QG56)模型鼠的11C-Erlotinib显像,结果发现EGFR基因19号外显子缺失型HCC827明显摄取11C-Erlotinib,21号外显子L858R突变型NCI-H3255有摄取,而L858R与T790双重突变型NCI-H1975及野生型QG56模型均无摄取,这与4种细胞对Erlotinib的敏感性结果一致。Traxl等[32]也研究了11C-Erlotinib 在Abcb1a/1b和Abcg2野生及缺失模型鼠中的显像,得出了与Kawamura等[25]和Vlaming等[26]研究Gefitinib相符的结果。Bahce等[33]研究了5例EGFR基因19号外显子缺失和5例未缺失的非小细胞肺癌患者的11C-Erlotinib显像,发现缺失者能特异性摄取11C-Erlotinib,这能指导Erlotinib的临床靶向用药;该研究组还进行了11C-Erlotinib临床定量评价的模型研究,结果发现11C-Erlotinib定量研究最佳模型为未校正血浆代谢的可逆双室模型,同时也可用较简单的全血池的肿瘤/血池值模型进行研究[34];另外他们还研究了11C-erlotinib在非小细胞肺癌患者Erlotinib治疗前后的PET显像,发现Erlotinib治疗组的肿瘤分布容积变得不可信,但可用注射后40~60 min的肿瘤/静脉血值或肿瘤/动脉血值来作为简化的扫描参数,同时发现肿瘤/静脉血值低于肿瘤/动脉血值,故这两个比值不能通用[35]。笔者对18F标记的Erlotinib进行了一些研究,目前已成功通过“点击化学”方法以2-18F-氟叠氮乙烷为前体标记Erlotinib[36],进一步的研究正在进行中。
-
Tykerb(Lapatinib)是英国葛兰素史克公司研发的一种口服的小分子EGFR可逆性的TKI,能同时靶向EGFR和人表皮生长因子受体2两个靶点。Basuli等[37]通过3-18F-氟苄基溴中间体合成了18F-Lapatinib,放化产率为8%~12%,总合成时间140 min,但是未作18F-Lapatinib的相关体内外生物评价报道。2015年Saleem等[38]通过格氏反应得到11C-氟苄基碘中间体并对Lapatinib进行了11C标记,随后进行了6例人表皮生长因子受体2高表达的乳腺癌患者(其中3例发生了脑转移)的11C-Lapatinib PET显像研究,结果显示11C-Lapatinib在体内稳定,并且脑转移病灶处11C-Lapatinib摄取明显高于正常脑组织。
-
Vandetanib是一种小分子多靶点TKI,能同时作用于肿瘤细胞的EGFR、血管内皮生长因子受体及受体酪氨酸激酶(RET),还可抑制其他酪氨酸激酶以及丝氨酸/苏氨酸激酶。早在2011年Gao等[39]就通过11C-MeOTf标记合成了O-11C-Vandetanib、N-11C-Vandetanib、O-11C-chloro-Vandetanib、N-11C-chloro-Vandetanib。另外11C标记的Vandetanib类似物(R)-N-(4-溴-2氟苯基)-6-甲氧基-7-((1-11C-甲基-3-哌啶基)甲氧基)-4-喹唑啉胺((R)-[11C]PAQ)、64Cu标记的Vandetanib单体及二聚体也被报道用于靶向血管内皮细胞生长因子受体的肿瘤PET显像[40-41]。但靶向EGFR的Vandetanib PET显像目前暂无体内外生物评价报道。
-
Afatinib是FDA 2013年批准的一种EGFR和人表皮生长因子受体2酪氨酸激酶的不可逆抑制剂,适用于晚期非小细胞肺癌及HER2阳性的晚期乳腺癌患者。它是第二代高效、双重、非可逆的TKI。临床研究显示,伴有常见EGFR突变类型的大多数(61%)患者在接受Afatinib治疗后,肿瘤体积显著缩小、肿瘤进展时间较晚、患者生存期较长,Afatinib是一种新型的比较有前途的靶向药物[42]。Slobbe等[43]通过3步放化反应合成18F-Afatinib,放化产率达17%左右,并进行了稳定性、体内分布及荷瘤鼠显像的研究。另外,他们还进行了18F-Afatinib与11C-Erlotinib在3种(EGFR基因19号外显子缺失型HCC827、L858R/T790双重突变型NCI-H1975及野生型A549)肺癌肿瘤模型鼠中的显像对比研究,结果发现HCC827模型鼠肿瘤摄取较高,野生型A549稍微有摄取,NCI-H1975几乎无摄取,HCC827的阳性摄取与之前的研究结果符合[44]。
-
除了上述喹唑啉类药物被用于正电子核素标记外,还有多种含4-氨基喹唑啉母环的喹唑啉类衍生物被用于显像研究,其中,对4-[(3-碘苯基)氨基]-喹唑啉-6-丙烯酰胺(4-(3-iodophenyl)amino-quinazoline-6-yl-acrylamide,IPQA)的研究较多。Pal等[45]先后报道了124I-Morpholino-IPQA、18F-PEG6-IPQA的合成,并研究了后者在非人源哺乳动物中的生物摄取、体内分布[46],同时该研究团队还对肺癌细胞模型进行了显像研究,发现在EGFR突变型肿瘤中呈阳性摄取,对小分子TKI的用药具有指导意义[47-48]。Medina等[49]还发现脂质体纳米颗粒作载体可促进124I-Morpholino-IPQA在活体内的靶向摄取。Yeh等[50]研究发现124I-Morpholino-IPQA在EGFR突变型(L858R、E746-A750缺失)非小细胞肺癌H1299肿瘤模型中摄取较高,但显像剂的水溶性差及肝脏摄取较高的缺点需进一步改进。
另外,正电子核素标记多种喹唑啉衍生物(ML01~ML08)的研究众多。其中,Mishani及其团队对此类显像剂进行了长期深入的研究,结果发现ML01被细胞内高浓度ATP竞争性地快速清除;ML03代谢快、生物利用度低、肿瘤聚集量少,均不适合作为靶向EGFR的PET显像剂[51-53];11C、18F标记的ML04体内生物学分布稳定、代谢率低,肿瘤/血液值、肿瘤/肌肉值均显示适合分子显像[54-56]。他们还尝试过用124I标记ML06~ML08[57],用PEG改性增加化合物水溶性,减少肝脏摄取[58-60]。其他研究者也对这类显像剂进行了大量研究探讨[61-65]。另外目前国内也有北京师范大学、哈尔滨医科大学、浙江大学等单位的研究者进行相关研究,并申报了国内专利保护[66-70]。但综合比较发现ML04的靶向性高、生物学分布好,最具临床应用潜力,但目前尚未见其临床应用报道。
此外,Pisaneschi等[71]还报道了18F通过“点击化学”方法标记3-氰基喹啉作为PET显像剂,实验发现其肿瘤靶向性好,体内生物学分布稳定,肝脏摄取不高,比较适合用于EGFR表达较高的肿瘤PET显像。
-
分子靶向治疗是肿瘤治疗的方向,EGFR是其中的重要靶点,大量临床研究表明靶向EGFR的PET显像是可行的,各种类型的显像剂的设计和显像研究取得了不错的阶段性成果,但是目前靶向EGFR显像仍存在一些缺陷:如肝脏、肠道摄取过高,不能进行腹部肿瘤显像;血液及周围组织的摄取增大了显像本底值,加大了患者照射剂量;另外,此类放射性探针的广谱性不强,在一定程度上限制了其应用。未来的显像剂研发及优化应着重于:①运用药效基团设计,改进小分子类抑制剂结构,进一步提高其肿瘤特异性;②尽可能开发正电子核素标记的Lapatinib、Vandetanib、Afatinib类多靶点显像剂,拓宽显像剂的适用范围;③在不影响肿瘤靶向性前提下增加显像剂的水溶性,降低肝脏、肠道摄取,为腹部肿瘤的显像提供可能;④拓宽此类显像剂的应用范围,如利用其穿透血脑屏障研究脑部有关病变等。如此,未来的靶向EGFR的PET显像能准确、实时、灵敏地提供EGFR的表达情况,为临床EGFR靶向药物筛选敏感个体、评价治疗效果、预测预后提供可靠的科学依据;亦能指导新型EGFR靶向药物的研发筛选、药效评价,为医药企业节省研发成本;同时若将正电子核素替换为治疗用核素,可进行肿瘤的局部放疗,或者达到显像与放疗一起实现的诊疗一体化,为肿瘤治疗提供新的思路,促进精准医疗的发展。
靶向表皮生长因子受体小分子类PET显像剂研究进展
PET imaging agents of small molecules inhibitors targeting EGFR
-
摘要: 表皮生长因子受体(EGFR)在多种癌症的发生发展中起着重要作用,目前已有多种EGFR靶向药物被美国食品与药品管理局批准用于临床,但因个体敏感程度不同,总体疗效偏低。研究表明EGFR高表达或突变患者对靶向药物敏感,因此明确EGFR表达水平和突变状态对临床用药有重要指导意义。PET成像技术能实现分子水平无创显像,并能通过SUV进行半定量研究,使得在体内无创明确EGFR表达、突变情况,指导靶向药物的精准治疗成为可能。笔者综述了靶向EGFR的小分子类PET显像剂,以期为新的探针研发及其临床应用提供一定帮助。
-
关键词:
- 受体,表皮生长因子 /
- 放射性示踪剂 /
- 正电子发射断层显像术 /
- 酪氨酸激酶抑制剂
Abstract: Epithelial growth factor receptor(EGFR) plays an important role in numerous cancers and many types of targeting EGFR drugs have been approved by the Food and Drug Administration. However, the individual sensitivity and efficiency rates of these targeting EGFR medicines are low. Many studies have shown that patients with high EGFR expression or mutation are responsive to targeting drugs. Therefore, clearing the EGFR expression and mutation status is significant for clinical medication. PET is a noninvasive in vivo imaging technique that enables the visualization and quantification of the distribution of molecules labeled with positron-emitting isotopes at a picomolar level. PET can guide the precision medicine for these targeting EGFR drugs. This review summarizes the small-molecule PET probes for targeting EGFR. -
表 1 美国食品与药品管理局批准的表皮生长因子受体靶向药物
Table 1. Anti-cancer drugs targeting EGFR approved by Food and Drug Administration
药物名称 商品名 靶点 适应证 西妥昔单抗(Cetunmab) Erbitux EGFR 结直肠癌 帕尼单抗(Panitumumab ) Vectibix EGFR 结直 耐昔妥株单抗(Necitumumab ) Portrazza EGFR 非小细胞肺癌 吉非替尼(Gefitrnib) Iressa EGFR 非小细胞肺癌 埃罗替尼(Erlotinib) Tarceva EGFR 非小细胞肺癌、胰腺癌 拉帕替尼(Lapatmib) Tykerb EGFR: HER-2 乳腺癌 凡德他尼(Vandetanib ) Caprelsa VEGFR: EGFR 甲状腺癌 阿法替尼(Afatinib) Gilotrif EGFR: HER-2 非小细胞肺癌 奥斯替尼(Osimertinib) Tagrisso EGFR 非小细胞肺癌 注:表中,EGFR:表皮生长因子受体;VEGFR:血管内皮生长因子受体;HER-2: 人表皮生长因子受体2。 -
[1] 陈万青, 郑荣寿, 曾红梅, 等.2011年中国恶性肿瘤发病和死亡分析[J].中国肿瘤, 2015, 24(1):1-10.DOI:10.11735/j.issn.1004-0242.2015.01.A001.
Chen WQ, Zheng RS, Zeng HM, et al.Report of cancer incidence and mortality in China, 2011[J].China Cancer, 2015, 24(1):1-10. doi: 10.11735/j.issn.1004-0242.2015.01.A001[2] Cataldo VD, Gibbons DL, Pérez-Soler R, et al.Treatment of non-small-cell lung cancer with erlotinib or gefitinib[J].N Engl J Med, 2011, 364(10):947-955.DOI:10.1056/NEJMct0807960. [3] Mendelsohn J, Baselga J.Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer[J].J Clin Oncol, 2003, 21(14):2787-2799.DOI:10.1200/JCO.2003.01.504. [4] Rudin M, Weissleder R.Molecular imaging in drug discovery and development[J].Nat Rev Drug Discov, 2003, 2(2):123-131.DOI:10.1038/nrd1007. [5] Green MR.Targeting targeted therapy[J].N Engl J Med, 2004, 350(21):2191-2193.DOI:10.1056/NEJMe048101. [6] Gridelli C, Marinis F, Maio M, et al.Gefitinib as first-line treatment for patients with advanced non-small-cell lung cancer with activating epidermal growth factor receptor mutation:Review of the evidence[J].Lung Cancer, 2011, 71(3):249-257.DOI:10.1016/j.lungcan.2010.12.008. [7] Jian G, Songwen Z, Ling Z, et al.Prediction of epidermal growth factor receptor mutations in the plasma/pleural effusion to efficacy of gefitinib treatment in advanced non-small cell lung cancer[J].J Cancer Res Clin Oncol, 2010, 136(9):1341-1347.DOI:10.1007/s00432-010-0785-z. [8] Bai H, Mao L, Wang HS, et al.Epidermal growth factor receptor mutations in plasma DNA samples predict tumor response in Chinese patients with stages IIIB to IV non-small-cell lung cancer[J].J Clin Oncol, 2009, 27(16):2653-2659.DOI:10.1200/JCO.2008.17.3930. [9] Johnström P, Fredriksson A, Thorell JO, et al.Synthesis of[methoxy-11C]PD153035, a selective EGF receptor tyrosine kinase inhibitor[J].J Labelled Comp Radiopharm, 1998, 41(7):623-629.DOI:10.1002/(SICI)1099-1344(199807)41:73.0.CO;2-Q. [10] Fredriksson A, Johnström P, Thorell JO, et al.In vivo evaluation of the biodistribution of 11C-labeled PD153035 in rats without and with neuroblastoma implants[J].Life Sci, 1999, 65(2):165-174.DOI:10.1016/S0024-3205(99)00233-7. [11] Samén E, Thorell JO, Fredriksson A, et al.The tyrosine kinase inhibitor PD153035:implication of labeling position on radiometabolites formed in vitro[J].Nucl Med Biol, 2006, 33(8):1005-1011.DOI:10.1016/j.nucmedbio.2006.09.008. [12] Samén E, Arnberg F, Lu L, et al.Metabolism of epidermal growth factor receptor targeting probe[11C]PD153035:impact on biodistribution and tumor uptake in rats[J].J Nucl Med, 2013, 54(10):1804-1811.DOI:10.2967/jnumed.113.120493. [13] Wang H, Yu JM, Yang GR, et al.Further characterization of the epidermal growth factor receptor ligand 11C-PD153035[J].Chin Med J(Engl), 2007, 120(11):960-964. [14] Wang H, Yu J, Yang G, et al.Assessment of 11C-labeled-4-N-(3-bromoanilino)-6, 7-dimethoxyquinazoline as a positron emission tomography agent to monitor epidermal growth factor receptor expression[J].Cancer Sci, 2007, 98(9):1413-1416.DOI:10.1111/j.1349-7006.2007.00562.x. [15] Liu N, Li M, Li X, et al.PET-based biodistribution and radiation dosimetry of epidermal growth factor receptor-selective tracer 11C-PD153035 in humans[J].J Nucl Med, 2009, 50(2):303-308.DOI:10.2967/jnumed.108.056556. [16] Meng X, Loo BW Jr, Ma L, et al.Molecular imaging with 11C-PD153035 PET/CT predicts survival in non-small cell lung cancer treated with EGFR-TKI:a pilot study[J].J Nucl Med, 2011, 52(10):1573-1579.DOI:10.2967/jnumed.111.092874. [17] DeJesus OT, Murali D, Flores LG, et al.Synthesis of[F-18]-ZD1839 as a PET imaging agent for epidermal growth factor receptors[J].J Labelled Comp Radiopharm, 2003, 46(S1):S1-S9.DOI:10.1002/jlcr.750. [18] Murali D, Flores LG, Converse AK, et al.Evaluation of[F-18] Iressa as a PET agent for tumor overexpressing epidermal growth factor (EGFR) receptors[J].J Labelled Comp Radiopharm, 2005, 48(s1):1-11.DOI:10.1002/jlcr.968. [19] Seimbille Y, Phelps ME, Czernin J, et al.Fluorin-18 labeling of 6, 7-distributed anilinoquinazoline derivatives for positron emission tomography(PET) imaging of tyrosine kianse receptors:synthesis of 18F-Iressa and related molecular probes[J].J Labelled Comp Radiopharm, 2005, 48(11):829-843.DOI:10.1002/jlcr.998. [20] Su H, Seimbille Y, Ferl GZ, et al.Evaluation of[18F] gefitinib as a molecular imaging probe for the assessment of the epidermal growth factor receptor status in malignant tumors[J].Eur J Nucl Med Mol Imaging, 2008, 35(6):1089-1099.DOI:10.1007/s00259-007-0636-6. [21] Läppchen T, Vlaming ML, Custers E, et al.Automated synthesis of[18F] gefitinib on a modular system[J].Appl Radiat Isot, 2012, 70(1):205-209.DOI:10.1016/j.apradiso.2011.09.005. [22] Holt DP, Ravert HT, Dannals RF, et al.Synthesis of[11C] gefitinib for imaging epidermal growth factor receptor tyrosine kinase with positron emission tomography[J].J Labelled Comp Radiopharm, 2006, 49(10):883-888.DOI:10.1002/jlcr.1104. [23] Wang JQ, Gao M, Miller KD, et al.Synthesis of[11C] Iressa as a new potential PET cancer imaging agent for epidermal growth factor receptor tyrosine kinase[J].Bioorg Med Chem Lett, 2006, 16(15):4102-4106.DOI:10.1016/j.bmcl.2006.04.080. [24] Zhang MR, Kumata K, Hatori A, et al.[11C]Gefitinib([11C] Iressa):radiosynthesis, in vitro uptake, and in vivo imaging of intact murine fibrosarcoma[J].Mol Imaging Biol, 2010, 12(2):181-191.DOI:10.1007/s11307-009-0265-5. [25] Kawamura K, Yamasaki T, Yui J, et al.In vivo evaluation of P-glycoprotein and breast cancer resistance protein modulation in the brain using[11C] gefitinib[J].Nucl Med Biol, 2009, 36(3):239-246.DOI:10.1016/j.nucmedbio.2008.12.006. [26] Vlaming ML, Läppchen T, Jansen HT, et al.PET-CT imaging with[18F]-gefitinib to measure Abcb1a/1b(P-gp)and Abcg2(Bcrp1)mediated drug-drug interactions at the murine blood-brain barrier[J].Nucl Med Biol, 2015, 42(11):833-841.DOI:10.1016/j.nucmedbio.2015.07.004. [27] Memon AA, Jakobsen S, Dagnaes-Hansen F, et al.Positron emission tomography(PET) imaging with[11C]-labeled erlotinib:a micro-PET study on mice with lung tumor xenografts[J].Cancer Res, 2009, 69(3):873-878.DOI:10.1158/0008-5472.CAN-08-3118. [28] Memon AA, Weber B, Winterdahl M, et al.PET imaging of patients with non-small cell lung cancer employing an EGF receptor targeting drug as tracer[J].Br J Cancer, 2011, 105(12):1850-1855.DOI:10.1038/bjc.2011.493. [29] Weber B, Winterdahl M, Memon A, et al.Erlotinib accumulation in brain metastases from non-small cell lung cancer:visualization by positron emission tomography in a patient harboring a mutation in the epidermal growth factor receptor[J].J Thorac Oncol, 2011, 6(7):1287-1289.DOI:10.1097/JTO.0b013e318219ab87. [30] Petrulli JR, Sullivan JM, Zheng MQ, et al.Quantitative analysis of[11C]-erlotinib PET demonstrates specific binding for activating mutations of the EGFR kinase domain[J].Neoplasia, 2013, 15(12):1347-1353.DOI:10.1593/neo.131666. [31] Abourbeh G, Itamar B, Salnikov O, et al.Identifying erlotinib-sensitive non-small cell lung carcinoma tumors in mice using[11C]erlotinib PET[J/OL].EJNMMI Res, 2015, 5:4[2016-08-16].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4385014.DOI:10.1186/s13550-014-0080-0. [32] Traxl A, Wanek T, Mairinger S, et al.Breast Cancer Resistance Protein and P-Glycoprotein Influence in Vivo Disposition of 11C-Erlotinib[J].J Nucl Med, 2015, 56(12):1930-1936.DOI:10.2967/jnumed.115.161273. [33] Bahce I, Smit EF, Lubberink M, et al.Development of[11C]erlotinib positron emission tomography for in vivo evaluation of EGF receptor mutational status[J].Clin Cancer Res, 2013, 19(1):183-193.DOI:10.1158/1078-0432.CCR-12-0289. [34] Yaqub M, Bahce I, Voorhoeve C, et al.Quantitative and simplified analysis of 11C-Erlotinib studies[J].J Nucl Med, 2016, 57(6):861-866.DOI:10.2967/jnumed.115.165225. [35] Bahce I, Yaqub M, Errami H, et al.Effects of erlotinib therapy on[11C]erlotinib uptake in EGFR mutated, advanced NSCLC[J/OL].EJNMMI Res, 2016, 6(1):10[2016-08-16].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4746207.DOI:10.1186/s13550-016-0169-8. [36] 黄顺, 王全师, 郑希, 等.一种EGFR正电子示踪剂及其制备方法和应用:中国, 201510114513.X[P].2015-08-05.
Huang S, Wang QS, Zhen X, et al.The preparation and application of an EGFR positron tracer:CN, 201510114513.X[P].2015-08-05.[37] Basuli F, Wu H, Li C, et al.A first synthesis of 18F-radiolabeled lapatinib:a potential tracer for positron emission tomographic imaging of Erbb1/Erbb2 tyrosine kinase activity[J].J Labelled Comp Radiopharm, 2011, 54(9):633-636.DOI:10.1002/jlcr.1898. [38] Saleem A, Searle GE, Kenny LM, et al.Lapatinib access into normal brain and brain metastases in patients with HER-2 overexpressing breast cancer[J/OL].EJNMMI Res, 2015, 5:30[2016-08-16].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4424224.DOI:10.1186/s13550-015-0103-5. [39] Gao M, Lola CM, Wang M, et al.Radiosynthesis of[11C]Vandetanib and[11C]chloro-Vandetanib as new potential PET agents for imaging of VEGFR in cancer[J].Bioorg Med Chem Lett, 2011, 21(11):3222-3226.DOI:10.1016/j.bmcl.2011.04.049. [40] Li F, Jiang S, Zu Y, et al.A tyrosine kinase inhibitor-based high-affinity PET radiopharmaceutical targets vascular endothelial growth factor receptor[J].J Nucl Med, 2014, 55(1):1525-1531.DOI:10.2967/jnumed.114.138925. [41] Samén, E, Li L, Mulder J, et al.Visualization of angiogenesis during cancer development in the polyoma middle T breast cancer model:molecular imaging with(R)-[11C]PAQ[J/OL].EJNMMI Res, 2014, 4(1):17[2016-08-16].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3986910.DOI:10.1186/2191-219X-4-17. [42] Murakami H, Tamura T, Takahashi T, et al.Phase I study of continuous afatinib(BIBW 2992) in patients with advanced non-small cell lung cancer afterprior chemotherapy/erlotinib/gefitinib (LUX-Lung 4)[J].Cancer Chemother Pharmacol, 2012, 69(4):891-899.DOI:10.1007/s00280-011-1738-1. [43] Slobbe P, Windhorst AD, Stigter-van Walsum M, et al.Development of[18F] afatinib as new TKI-PET tracer for EGFR positive tumors[J].Nucl Med Biol, 2014, 41(9):749-757.DOI:10.1016/j.nucmedbio.2014.06.005. [44] Slobbe P, Windhorst AD, Stigter-van Walsum M, et al.A comparative PET imaging study with the reversible and irreversible EGFR tyrosine kinase inhibitors[11C]erlotinib and[18F]afatinib in lung cancer-bearing mice[J/OL].EJNMMI Res, 2015, 5(1):14[2016-08-16].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4385286.DOI:10.1186/s13550-015-0088-0. [45] Pal A, Glekas A, Doubrovin M, et al.Molecular imaging of EGFR kinase activity in tumors with 124I-labeled small molecular tracer and positron emission tomography[J].Mol Imaging Biol, 2006, 8(5):262-277.DOI:10.1007/s11307-006-0049-0. [46] Tian M, Ogawa K, Wendt R, et al.Whole-body biodistribution kinetics, metabolism, and radiation dosimetry estimates of 18F-PEG6-IPQA in nonhuman primates[J].J Nucl Med, 2011, 52(6):934-941.DOI:10.2967/jnumed.110.086777. [47] Yeh HH, Ogawa K, Balatoni J, et al.Molecular imaging of active mutant L858R EGF receptor(EGFR) kinase-expressing nonsmall cell lung carcinomas using PET/CT[J].Proc Natl Acad Sci U S A, 2011, 108(4):1603-1608.DOI:10.1073/pnas.1010744108. [48] Pal A, Balatoni JA, Mukhopadhyay U, et al.Radiosynthesis and initial in vitro evaluation of[18F]F-PEG6-IPQA-a novel PET radiotracer for imaging EGFR expression-activity in lung carcinomas[J].Mol Imaging Biol, 2011, 13(5):853-861.DOI:10.1007/s11307-010-0408-8. [49] Medina OP, Pillarsetty N, Glekas A, et al.Optimizing tumor targeting of the lipophilic EGFR-binding radiotracer SKI 243 using a liposomal nanoparticle delivery system[J].J Control Release, 2011, 149(3):292-298.DOI:10.1016/j.jconrel.2010.10.024. [50] Yeh SH, Lin CF, Kong FL, et al.Molecular imaging of nonsmall cell lung carcinomas expressing active mutant EGFR kinase using PET with[124I]-morpholino-IPQA[J/OL].Biomed Res Int, 2013, 2013:549359[2016-08-16].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3730369.DOI:10.1155/2013/549359. [51] Bonasera TA, Ortu G, Rozen Y, et al.Potential 18F-labeled biomarkers for epidermal growth factor receptor tyrosine kinase[J].Nucl Med Biol, 2001, 28(4):359-374.DOI:10.1016/S0969-8051(01)00200-1. [52] Ortu G, Ben-David I, Rozen Y, et al.Labeled EGFr-TK irreversible inhibitor(ML03):in vitro and in vivo properties, potential as PET biomarker for cancer and feasibility as anticancer drug[J].Int J Cancer, 2002, 101(4):360-370.DOI:10.1002/ijc.10619. [53] Ben-David I, Rozen Y, Ortu G, et al.Radiosynthesis of ML03, a novel positron emission tomography biomarker for targeting epidermal growth factor receptor via the labeling synthon:[11C]acryloyl chloride[J].Appl Radiat Isot, 2003, 58(2):209-217.DOI:10.1016/S0969-8043(02)00301-9. [54] Mishani E, Abourbeh G, Rozen Y, et al.Novel carbon-11 labeled 4-dimethylamino-but-2-enoic acid[4-(phenylamino)-quinazoline-6-yl]-amides:potential PET bioprobes for molecular imaging of EGFR-positive tumors[J].Nucl Med Biol, 2004, 31(4):469-476.DOI:10.1016/j.nucmedbio.2003.12.005. [55] Dissoki S, Laky D, Mishani E.Fluorine-18 labeling of ML04-presently the most promising irreversible inhibitor candidate for visualization of EGFR in cancer[J].J Label Compd Radiopharm, 2006, 49(6):533-543.DOI:10.1002/jlcr.1071. [56] Abourbeh G, Dissoki S, Jacobson O, et al.Evaluation of radiolabeled ML04, a putative irreversible inhibitor of epidermal growth factor receptor, as a bioprobe for PET imaging of EGFR-overexpressing tumors[J].Nucl Med Biol, 2007, 34(1):55-70.DOI:10.1016/j.nucmedbio.2006.10.012. [57] Shaul M, Abourbeh G, Jacobson O, et al.Novel iodine-124 labeled EGFR inhibitors as potential PET agents for molecular imaging in cancer[J].Bioorg Med Chem, 2004, 12(13):3421-3429.DOI:10.1016/j.bmc.2004.04.044. [58] Dissoki S, Aviv Y, Laky D, et al.The effect of the[18F]-PEG group on tracer qualification of[4-(phenylamino)-quinazoline-6-YL]-amide moiety-an EGFR putative irreversible inhibitor[J].Appl Radiat Isot, 2007, 65(10):1140-1151.DOI:10.1016/j.apradiso.2007.04.014. [59] Dissoki S, Eshet R, Billauer H, et al.Modified PEG-anilinoquinazoline derivatives as potential EGFR PET agents[J].J Labelled Compd Radiopharm, 2009, 52(2):41-52.DOI:10.1002/jlcr.1569. [60] Pantaleo MA, Mishani E, Nanni C, et al.Evaluation of modified PEG-anilinoquinazoline derivatives as potential agents for EGFR imaging in cancer by small animal PET[J].Mol Imaging Biol, 2010, 12(6):616-625.DOI:10.1007/s11307-010-0315-z. [61] Vasdev N, Dorff PN, Gibbs AR, et al.Synthesis of 6-acrylamido-4-(2-[18F]fluoroanilino) quinazoline:a prospective irreversible EGFR binding probe[J].J Labelled Compd Radiopharm, 2005, 48(2):109-115.DOI:10.1002/jlcr.903. [62] Vasdev N, Dorff PN, O'neil JP, et al.Metabolic stability of 6, 7-dialkoxy-4-(2-, 3-and 4-[18F]fluoroanilino) quinazolines, potential EGFR imaging probes[J].Bioorg Med Chem, 2011, 19(9):2959-2965.DOI:10.1016/j.bmc.2011.03.032. [63] Kobus D, Giesen Y, Ullrich R, et al.A fully automated two-step synthesis of an 18F-labelled tyrosine kinase inhibitor for EGFR kinase activity imaging in tumors[J].Appl Radiat Isot, 2009, 67(11):1977-1984.DOI:10.1016/j.apradiso.2009.07.018. [64] Wang M, Gao M, Zheng QH.The first radiosynthesis of[11C]AZD8931 as a new potential PET agent for imaging of EGFR, HER2 and HER3 signaling[J].Bioorg Med Chem Lett, 2014, 24(18):4455-4459.DOI:10.1016/j.bmcl.2014.07.092. [65] Neto C, Fernandes C, Oliveira MC, et al.Radiohalogenated 4-anilinoquinazoline-based EGFR-TK inhibitors as potential cancer imaging agents[J].Nucl Med Biol, 2012, 39(2):247-260.DOI:10.1016/j.nucmedbio.2011.09.001. [66] 齐传民, 李石磊, 王潇, 等.新型18F标记取代喹唑啉类化合物及其制备方法和肿瘤PET显像应用:中国, 201210036262.4[P].2013-08-21.
Qi CM, Li SL, Wang X, et al.The preparation of 18F labeled quinazoline compound and its PET imaging application:CN, 201210036262.4[P].2013-08-21.[67] 齐传民, 陈玉蓉, 冯曼, 等.新型18F标记4-氨基喹唑啉类衍生物及其制备方法和肿瘤PET显像应用:中国, 201210036250.1[P].2013-08-21.
Qi CM, Chen YR, Feng M, et al.The preparation of 18F labeled 4-amino quinazoline derivatives and application of tumour PET imaging:CN, 201210036250.1[P].2013-08-21.申宝忠.一种18F标记的喹唑啉类不可逆性EGFR正电子示踪剂及其制备方法和应用:中国, 201310711310.
X[P].2014-03-26.Shen BZ.The preparation and application of 18F labeled quinazoline class irreversibility EGFR PET tracer:CN, 201310711310.X[P].2014-03-26.[69] 申宝忠.18F标记的喹唑啉类EGFR正电子示踪剂及其制备方法和应用:中国, 201310711309.7[P].2014-03-26.
Shen BZ.The preparation and application of 18F labeled quinazoline class EGFR PET tracer:CN, 201310711309.7[P].2014-03-26.[70] 刘振峰, 董孟杰, 王国林, 等.2-氟代苯胺喹唑啉类肿瘤正电子显像剂及制备和应用:中国, 201310256474.8[P].2013-09-18.
Liu ZF, Dong MJ, Wang GL, et al.The preparation and application of 2-fluoroaniline quinazoline class tumor positron imaging agent:CN, 201310256474.8[P].2013-09-18.[71] Pisaneschi F, Nguyen QD, Shamsaei E, et al.Development of a new epidermal growth factor receptor positron emission tomography imaging agent based on the 3-cyanoquinoline core:synthesis and biological evaluation[J].Bioorg Med Chem, 2010, 18(18):6634-6645.DOI:10.1016/j.bmc.2010.08.004. -






 下载:
下载: