-
人体的造血系统和免疫系统对电离辐射极为敏感,机体受到电离辐射会引起造血及免疫系统的损伤,形成急性放射病。而随着核技术的发展和广泛应用,人类受到辐射的概率也在不断增加[1]。现批准临床应用的辐射防护药物仅氨磷汀一种,且必须静脉注射,应用存在很大限制。因此,开展新的具有辐射防护功效的药物研究意义重大,将为核技术的广泛应用提供安全保障。
本研究的前期实验是应用药物组合原理,在褪黑素主要结构功能单位的氨基位置引入具有抗自由基、抗辐射及免疫活性功效的基团α-硫辛酸,得到新化合物5-甲氧基色胺-α-硫辛酸盐(5-methoxytryptamine-α-lipoic acid salt,MLA)。初步研究发现,MLA对急性辐射损伤具有一定的防护作用[2]。本研究进一步探讨MLA对小鼠受照后30 d的辐射防护效果及其作用机制。
-
C57BL/6纯系小鼠,雄性,体重18~22 g,由北京维通利华实验动物中心提供,合格证号:SCXK(京)2014-0003。抗小鼠Sca-1-PE(R-Phycoerythrin)、CD117(c-kit)-APC(Allophycocyanin)、biotin-CD5、CD4、CD8、CD45R/B220、Ly6G/Gr-1、CD11b、Ter-119 和Percp(Peridinin chlorphyll protein)-streptavidin 抗体购自美国ebioscience公司。烟酰胺腺嘌呤二核苷磷酸氧化酶4(nicotinamide adenine dinucleotide phosphate oxidase,NOX4)抗体购自中国Proteintech公司。2′,7′-二氯荧光素二乙酸酯购自上海碧云天生物技术有限公司。M3534培养基购自加拿大Stemcell公司。乙二胺四乙酸三钾购自美国Sigma公司。137Cs γ射线照射源购自加拿大原子能有限公司,剂量率为1.0 Gy/min;流式细胞仪Accuri C6购自美国BD公司;全自动血液分析仪MEK-7222k购自日本光电工业株式会社;CKKX41倒置显微镜购自日本Olympus公司。
-
将15 只C57BL/6 雄性小鼠完全随机分为3 组:对照组、照射组和照射+MLA组,每组5 只。其中对照组小鼠接受假照射(0 Gy);照射组和照射+MLA组进行6.0 Gy全身137Cs γ射线照射。照射后2 h,对照射+MLA组小鼠按10 mg/kg灌胃给药MLA,持续给药3 d。待照射后30 d处死小鼠,进行相关分析。
-
取外周血后用乙二胺四乙酸三钾溶液包被的抗凝管收集,PBS冲洗单侧股骨细胞,采用全自动血液分析仪进行检测。
-
分离小鼠骨髓细胞,计数后调整细胞浓度。取0.2 mL细胞悬液加入到2 mL M3534培养基中,充分混匀,用5 mL注射器连接16#平头注射器针头,加入到24孔板中。培养5 d后进行观察计数。细胞数≥30为阳性集落,以每105个细胞形成的集落数分析结果。
-
分离小鼠骨髓细胞,加入biotin-CD5、CD4、CD8、CD45R/B220、Ly6G/Gr-1、CD11b和Ter-119的混合抗体,冰上孵育30 min后,洗涤1次。加入Percp-streptavidin、Sca-1-PE和 CD117(c-kit)-APC抗体,冰上孵育30 min,随后加入2′,7′-二氯荧光素二乙酸酯染料,37℃水浴孵育30 min,洗涤1次后上流式细胞仪进行检测。
-
分离小鼠骨髓细胞,加入biotin-CD5、CD4、CD8、CD45R/B220、Ly6G/Gr-1、CD11b和Ter-119的混合抗体,冰上孵育30 min后,洗涤1次。加入Percp-streptavidin、Sca-1-PE和 CD117(c-kit)-APC抗体,冰上孵育30 min后将染色的细胞固定破膜隔夜。第2日分别加入NOX4一抗和二抗,上流式细胞仪进行检测。
-
符合正态分布的计量资料均以x±s表示,采用Excel软件中非配对双边t检验的方法对组间数据进行比较,P<0.05为差异具有统计学意义。
-
小鼠接受6.0 Gy照射后30 d,外周血WBC计数检测结果见表 1。与对照组相比,照射组和照射+MLA组小鼠的WBC(t=10.68、8.45,均P<0.05)、RBC(t=6.437、5.819,均P<0.05)等计数结果均明显下降,差异具有统计学意义。与照射组比较,MLA可显著提高受照小鼠WBC和RBC等计数结果(t=4.858、3.335,均P<0.05),差异具有统计学意义。
组别 WBC/(×109/L) RBC/(×1012/L) 血红蛋白/(g/L) 红细胞比容/% 血小板/(×109/L) 对照组 7.6±1.8 8.4±0.3 112.0±7.0 28.5±1.7 379.0±84.0 照射组 2.5±0.3 7.0±0.6 90.0±11.0 24.6±1.9 337.0±50.0 照射+MLA组 3.5±0.3 8.2±0.2 110.0±6.0 27.8±1.3 517.0±186.0 注:表中,MLA:5-甲氧基色胺-α-硫辛酸盐。 表 1 6.0 Gy全身照射后30 d小鼠外周血计数(n=5)
Table 1. The peripheral blood counts of mice exposed to 6.0 Gy total body irradiation for 30 d(n=5)
-
对小鼠单侧BMNCs计数及集落形成能力进行检测,结果见表 2。在小鼠接受6.0 Gy照射30 d后,与对照组相比,照射组BMNCs计数下降36%,集落形成能力下降58%,差异均具有统计学意义(t=9.304、7.493,均P<0.05)。与照射组比较,在给予MLA处理后,BMNCs计数和集落形成能力均有所增加,且差异具有统计学意义(t=5.629、3.947,均P<0.05)。
组别 BMNCs/(×106/股骨) CFU-GM/(×105细胞) 对照组 24.4±3.0 251.0±57.0 照射组 15.7±0.9 109.0±21.0 照射+MLA组 18.8±0.6 169.0±22.0 注:表中,MLA:5-甲氧基色胺-α-硫辛酸盐;BMNCs:骨髓有核细胞;CFU-GM:粒细胞-单核细胞集落生成数量。 表 2 6.0 Gy全身照射后30 d小鼠免疫器官指数的 变化(n=5)
Table 2. The immune organs index changes of mice exposed to 6.0 Gy total body irradiation for 30 d(n=5)
-
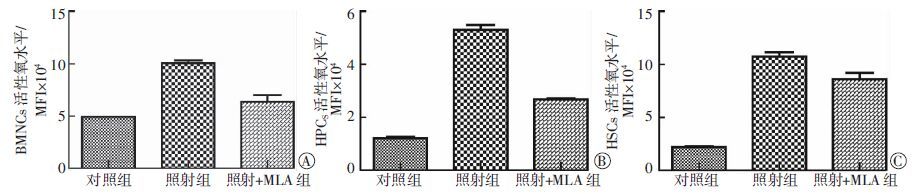
对小鼠造血细胞活性氧水平进行检测分析,结果见图 1。与对照组比较,照射组小鼠BMNCs、造血祖细胞(hematopoietic progenitor cells,HPCs)和造血干细胞(hematopoietic stem cells,HSCs)中的活性氧水平均升高(t=14.74、41.77、20.04,均P<0.05)。与照射组比较,给予MLA处理后,3类细胞中的活性氧水平均出现显著下降,且差异具有统计学意义(t=11.21、26.80、4.968,均P<0.05)。

图 1 MLA对6.0 Gy照射后30 d小鼠造血细胞活性氧水平的影响。图中,A:MLA对骨髓有核细胞活性氧的影响;B:MLA对造血祖细胞活性氧的影响;C:MLA对造血干细胞活性氧的影响。 MLA:5-甲氧基色胺-α-硫辛酸盐;BMNCs:骨髓有核细胞;MFI:平均荧光强度;HPCS:造血祖细胞;HSCs:造血干细胞。
Figure 1. The effects of 5-methoxytryptamine-α-lipoic acid salt on the ROS levels in the hematopoietic cells of mice exposed to 6.0 Gy total body irradiation for 30 d
-
对小鼠造血细胞NOX4表达进行检测,结果见图 2。与对照组比较,照射组小鼠BMNCs、HPCs和HSCs中的NOX4表达均升高,且差异有统计学意义(t=53.12、21.5、64.43,均P<0.05)。与照射组比较,给予MLA处理后,3类细胞中的NOX4表达均出现显著下降,且差异有统计学意义(t=33.93、13.83、12.93,均P<0.05)。

图 2 MLA对6.0 Gy照射后30 d小鼠造血细胞NOX4表达的影响。 图中,A:MLA对BMNCs NOX4表达的影响;B:MLA对HPCs NOX4表达的影响;C:MLA对HSCs NOX4表达的影响。MLA:5-甲氧基色胺-α-硫辛酸盐;BMNCs:骨髓有核细胞;NOX4:烟酰胺腺嘌呤二核苷磷酸氧化酶4;HPCs:造血祖细胞;HSCs:造血干细胞;MFI:平均荧光强度。
Figure 2. The effects of MLA on the NOX4 expression in the hematopoietic cells of mice exposed to 6.0 Gy total body irradiation for 30 d
-
辐射可引起机体不同的生理变化,包括DNA损伤和氧化应激反应,进而造成多器官的辐射损伤[3]。而对辐射防护药物和辐射治疗药物的研发始终是放射医学研究的热点。褪黑素发现于40多年前,经过大量研究证实其可作为直接清除自由基和间接的抗氧化剂,对不同器官的辐射损伤具有防护和治疗作用[4-5]。α-硫辛酸是1951年从牛肝中分离的天然产品,被证实能够在脂肪相和水溶液中有效清除自由基,从而阻止细胞膜的脂质过氧化和蛋白损伤[6-7]。本研究在两个化合物的基础上,经过药物组合原理合成新化合物MLA。前期研究已经在建立的亚致死剂量6.0 Gy全身照射小鼠造血系统辐射损伤及防护评价模型基础上,明确了MLA对急性辐射损伤的防护效果。本研究进一步观察MLA对受照小鼠外周血的辐射防护作用,结果发现,MLA可以有效地提高受照小鼠的外周血WBC、RBC等计数,表明MLA对造血系统有一定的防护作用。随后,对单侧BMNCs计数和骨髓细胞集落形成能力进行了观察,结果表明,MLA同样可以缓解辐射损伤效应。该结果与对褪黑素和α-硫辛酸的相关研究结果一致,但本研究发现MLA在10 mg/kg就有较好的辐射防护效果,其给药剂量显著低于褪黑素和α-硫辛酸单独给药剂量[5-7]。
因辐射损伤大部分都是通过形成活性氧进而造成间接损伤,本研究观察了MLA对造血细胞中活性氧水平的影响。结果表明,MLA不仅可以降低骨髓成熟细胞的活性氧水平,还能够有效降低HPCs和HSCs的活性氧水平,该结果与在受照后9 d的防护结果相一致,说明MLA可持续降低辐射引起的造血细胞活性氧升高[2]。前期研究表明,NOX4在造血细胞活性氧的生成过程中起着一定的作用[8]。NOX4的升高可引起造血细胞中活性氧的升高,因此本研究观察MLA对造血细胞中NOX4表达的影响,结果发现,MLA可显著降低受照小鼠造血细胞中NOX4的表达水平。
综上所述,本研究利用MLA对接受6.0 Gy全身照射小鼠进行治疗,结果发现MLA不仅能够提高受照小鼠外周血和单侧BMNCs,还能增加骨髓细胞的集落形成能力。进一步研究发现,MLA可能通过抑制造血细胞中NOX4的表达,降低活性氧的生成,从而对辐射损伤发挥治疗作用。
5-甲氧基色胺-α-硫辛酸盐对6.0 Gy受照小鼠造血系统的辐射防护作用
Protective effects of 5-methoxytryptamine-α-lipoic acid salt on mice exposed to 6.0 Gy total body irradiation
-
摘要:
目的 探讨新化合物5-甲氧基色胺-α-硫辛酸盐(MLA)对亚致死剂量受照小鼠造血系统损伤的辐射防护作用。 方法 将15只C57BL/6小鼠完全随机分为对照组、照射组和照射+MLA组。对照组接受假照射(0 Gy),其余两组进行6.0 Gy全身137Cs γ射线照射。照射后2 h将照射+MLA组小鼠按10 mg/kg灌胃给药,持续给药3 d。待照射后30 d处死小鼠,取外周血和单侧骨髓细胞进行计数,检测骨髓细胞克隆形成能力、造血细胞活性氧以及烟酰胺腺嘌呤二核苷磷酸氧化酶4(NOX4)的表达。 结果 与对照组比较,照射组小鼠骨髓有核细胞计数、粒细胞-单核细胞集落生成数量(CFU-GM)均明显下降(t=9.304、7.493,均P<0.05);骨髓细胞活性氧水平和NOX4表达显著升高(t=14.74、53.12,均P<0.05),且差异有统计学意义。与照射组相比,照射+MLA组小鼠外周血WBC、CFU-GM显著升高(t=4.858、3.947,均P<0.05);骨髓细胞活性氧水平和NOX4表达显著下降(t=11.21、33.93,均P<0.05),且差异有统计学意义。 结论 MLA对辐射引起的造血系统损伤有一定的防护作用。 -
关键词:
- 辐射防护 /
- 辐射损伤 /
- 活性氧 /
- NADPH氧化酶4 /
- 5-甲氧基色胺-α-硫辛酸盐
Abstract:Objective To study the protective effects of 5-methoxytryptamine-α-lipoic acid salt(MLA), a new synthetized compound, on the hematopoietic system of mice exposed to sublethal dose of total body irradiation(TBI). Methods Fifteen C57BL/6 mice were randomly assigned into three groups:control, irradiation, and MLA+irradiation. The mice in the control group received sham TBI, whereas the mice in the other groups underwent exposure to 6.0 Gy 137Cs γ-ray TBI. The mice in the MLA group were first administered with 10 mg/kg MLA after exposure to 6.0 Gy TBI for 2 h. The MLA was administered successively for 3 d. The peripheral blood and bone marrow nucleated cells(BMNCs) were then counted after the mice were exposed to TBI for 30 d. The CFU-GM ability, reactive oxygen species(ROS) levels, and nicotinamide adenine dinucleotide phosphate oxidase 4(NOX4) expression in the hematopoietic cells were also detected. Results In contrast to those of the control group, the number of BMNCs and the number CFU-GM in the irradiated groups decreased significantly(t=9.304, 7.493, both P<0.05), and the ROS levels and the NOX4 expression in the bone marrow cells of the irradiated groups increased(t=14.74, 53.12, both P<0.05). Compared with those of the irradiation group, the number of white blood cells and the number of BMNCs were elevated by MLA(t=4.858, 3.947, both P<0.05). The ROS levels and NOX4 expression in the bone marrow cells were inhibited by MLA(t=11.21, 33.93, both P<0.05). Conclusion MLA can protect mice from hematopoietic injury induced by irradiation. -
图 1 MLA对6.0 Gy照射后30 d小鼠造血细胞活性氧水平的影响。图中,A:MLA对骨髓有核细胞活性氧的影响;B:MLA对造血祖细胞活性氧的影响;C:MLA对造血干细胞活性氧的影响。 MLA:5-甲氧基色胺-α-硫辛酸盐;BMNCs:骨髓有核细胞;MFI:平均荧光强度;HPCS:造血祖细胞;HSCs:造血干细胞。
Figure 1. The effects of 5-methoxytryptamine-α-lipoic acid salt on the ROS levels in the hematopoietic cells of mice exposed to 6.0 Gy total body irradiation for 30 d
图 2 MLA对6.0 Gy照射后30 d小鼠造血细胞NOX4表达的影响。 图中,A:MLA对BMNCs NOX4表达的影响;B:MLA对HPCs NOX4表达的影响;C:MLA对HSCs NOX4表达的影响。MLA:5-甲氧基色胺-α-硫辛酸盐;BMNCs:骨髓有核细胞;NOX4:烟酰胺腺嘌呤二核苷磷酸氧化酶4;HPCs:造血祖细胞;HSCs:造血干细胞;MFI:平均荧光强度。
Figure 2. The effects of MLA on the NOX4 expression in the hematopoietic cells of mice exposed to 6.0 Gy total body irradiation for 30 d
表 1 6.0 Gy全身照射后30 d小鼠外周血计数(n=5)
Table 1. The peripheral blood counts of mice exposed to 6.0 Gy total body irradiation for 30 d(n=5)
组别 WBC/(×109/L) RBC/(×1012/L) 血红蛋白/(g/L) 红细胞比容/% 血小板/(×109/L) 对照组 7.6±1.8 8.4±0.3 112.0±7.0 28.5±1.7 379.0±84.0 照射组 2.5±0.3 7.0±0.6 90.0±11.0 24.6±1.9 337.0±50.0 照射+MLA组 3.5±0.3 8.2±0.2 110.0±6.0 27.8±1.3 517.0±186.0 注:表中,MLA:5-甲氧基色胺-α-硫辛酸盐。 表 2 6.0 Gy全身照射后30 d小鼠免疫器官指数的 变化(n=5)
Table 2. The immune organs index changes of mice exposed to 6.0 Gy total body irradiation for 30 d(n=5)
组别 BMNCs/(×106/股骨) CFU-GM/(×105细胞) 对照组 24.4±3.0 251.0±57.0 照射组 15.7±0.9 109.0±21.0 照射+MLA组 18.8±0.6 169.0±22.0 注:表中,MLA:5-甲氧基色胺-α-硫辛酸盐;BMNCs:骨髓有核细胞;CFU-GM:粒细胞-单核细胞集落生成数量。 -
[1] 赵洁, 康肖梦, 王华伟, 等.循环系统辐射损伤的防治药物[J].国际放射医学核医学杂志, 2014, 38(6):421-426.DOI:10.3760/cma.j, issn.1673-4114.2014.06.017.
Zhao J, Kang XM, Wang HW, et al.The drugs for the prevention and treatment of radiation-induced circulatory damage[J].Inter J Radiat Med Nucl Med, 2014, 38(6):421-426. doi: 10.3760/cma.j,issn.1673-4114.2014.06.017[2] Li DG, Tian ZY, Tang WS, et al.The protective effects of 5-Methoxytryptamine-alpha-lipoic acid on ionizing Radiation-Induced hematopoietic injury[J].Int J Mol Sci, 2016, 17(6):935.DOI:10.3390/ijms17060935. [3] Tahamtan R, Monfared AS, Tahamtani YA, et al.Radioprotective effect of melatonin on radiation-induced lung injury and lipid peroxidation in rats[J].Cell J, 2015, 17(1):111-120. [4] 曹婉婷, 李浣洋, 陈雪英, 等.正常组织在放射治疗中并发的迟发性损伤[J].国际放射医学核医学杂志, 2015, 39(3):260-263.DOI:10.3760/cma.j, issn.1673-4114, 2015.03.016.
Cao WT, Li HY, Chen XY, et al.Late effects of radiotherapy on normal tissue[J].Inter J Radiat Med Nucl Med, 2015, 39(3):260-263. doi: 10.3760/cma.j,issn.1673-4114,2015.03.016[5] Shirazi A, Mihandoost E, Mohseni MA, et al.Radio-protective effects of melatonin against irradiation-induced oxidative damage in rat peripheral blood[J].Phys Med, 2013, 29(1):65-74.DOI:10.1016/j.ejmp.2011.11.007. [6] Jung JH, Jung J, Kim SK, et al.Alpha lipoic acid attenuates radiation-induced thyroid injury in rats[J/OL].PLoS One, 2014, 9(11):e112253[2016-06-28].https://www.ncbi.nlm.nih.gov/pubmed/25401725.DOI:10.1371/journal.pone.0112253. [7] Ramachandran L, Nair CK.Protection against genotoxic damages following whole body γ radiation exposure in mice by lipoic acid[J].Mutat Res, 2011, 724(1/2):52-58.DOI:10.1016/j.mrgentox.2011.06.002. [8] Wang Y, Liu L, Pazhanisamy SK, et al.Total body irradiation causes residual bone marrow injury by induction of persistent oxidative stress in murine hematopoietic stem cells[J].Free Radic Biol Med, 2010, 48(2):348-356.DOI:10.1016/j.freeradbiomed.2009.11.005. -





 下载:
下载: