-
亚临床甲状腺功能减退症(subclinical hypothyroidism,SCH)的定义是血液中TSH水平高于正常参考值,而游离三碘甲状腺原氨酸(free triiodothyronine,FT3)及游离甲状腺素(free thyroxine,FT4)均处于正常水平,其在成人中的发病率为4%~20%,多数SCH是由慢性淋巴细胞甲状腺炎引起的[1]。其他可能引起SCH的原因有:①甲状腺损伤(131I治疗或其他外放疗);②医源性药物(含碘化合物、碳酸锂及干扰素等)导致;③曾患有亚急性甲状腺炎、产后甲状腺炎或无痛性甲状腺炎[2]。SCH的发病率会随着年龄增长而逐渐提高,女性的发病率高于男性。虽然SCH只代表轻度的甲状腺功能减退,但由于其是一种进展性的疾病,尤其是在血浆TSH浓度大于10 mIU/L、甲状腺过氧化物酶抗体阳性的老年女性患者中,SCH更容易发展至甲状腺功能减退症(以下简称甲减)[3]。SCH的临床症状并不典型,一些患者甚至没有明显的临床症状,在一些SCH的患者中会出现焦虑、抑郁、认知和记忆功能减退等,这些症状的严重程度与疾病严重程度、病情的持续时间有关。
心血管系统是甲状腺激素(thyroid hormone,TH)发挥作用的主要靶器官,TH缺乏可导致血管外周阻力增加、收缩及舒张功能减低、心脏的前负荷降低等,进而增加心血管疾病的发病风险[3-4]。高脂血症是心血管疾病的主要风险因素之一[5-6],TH的缺乏会造成血脂水平的异常,进而增加心血管疾病的发病风险[1]。到目前为止,甲减与高脂血症的关系已经十分明确,而有关高脂血症与SCH之间的关系的研究尚不充分。既往有研究表明,在SCH患者中,血浆中TSH与总胆固醇(total cholesterol,TC)及低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)水平呈正相关[7-9]。查阅文献可知,TH替代治疗可以减小甲状腺体积,改善SCH症状,改善TH缺乏所导致的血液动力学异常[3]。但TH替代治疗是否能够改善SCH患者的血脂异常状态仍然存在争议。目前有为数不多的关于评估SCH患者使用TH治疗对血脂水平影响的随机对照试验(randomized controlled trial,RCT),但是各研究的结果之间仍然存在争议[10-17]。本研究的目的是系统地研究TH替代治疗对SCH患者血脂水平的影响。
-
以“thyroxine”、“levothyroxin”及“levothyroxine”为关键词检索了2015年7月前包括Cochrane Library、PubMed、Medline、Google Scholar及Embase等在内的数据库中有关TH替代治疗SCH的RCT文献,无语言限制。
-
研究者独立阅读文献的题目及摘要,筛选符合标准的全文,阅读全文,交叉核对试验结果,排除不符合标准的文献后确定最后纳入研究的文献。纳入试验标准如下:①纳入的文献必须是有关比较TH与安慰剂替代治疗降低血脂水平程度的差异的研究。②研究对象为SCH患者。
汇总资料包括:①一般资料(作者姓氏、文章的发表年份);②研究特征(研究对象例数、甲状腺相关疾病病史、TH及安慰剂用量、治疗时间及血浆TSH水平)。
-
纳入本研究的文献的偏倚风险及质量评估采用Cochrane风险评估工具进行,共包括7个方面:随机序列产生(random sequence generation)、分配隐藏(allocation concealment)、对参与者和实施者的盲法(blinding of participants and personnel)、对结局评价实施盲法(blinding of outcome assessment)、结局数据完整性(incomplete outcome data)、选择性发表(selective reporting)、其他偏倚(other bias)[18-19]。本研究的研究者分别根据Cochrane风险评估工具中的评估标准独立评估所有纳入文献的偏倚风险,并相互检查评估结果,同时作出偏倚风险图及偏倚风险概要图。
-
采用Cochrane提供的RevMan 5.2软件进行荟萃分析。所有的数据结果均为连续型变量。以均数±标准差(standard deviation,SD)表示结果。在纳入的RCT文献中,大多数可获得的数据为基线值(baseline)及终末值(final),在本研究中,我们选用治疗前后指标的变化值进行统计分析。均值的变化值为终末值减去基线值。标准差的变化值通过以下公式计算得到:$\mathit{S}{\mathit{D}_{{\rm{change}}}} = \sqrt {\mathit{SD}_{{\rm{baseline}}}^{\rm{2}} + \mathit{SD}_{{\rm{final}}}^{\rm{2}} - \left( {2 \times {\rm{corr}} \times \mathit{SD}_{{\rm{baseline}}}^{} \times \mathit{SD}_{{\rm{final}}}^{}} \right)} $,该公式来源于文献[20]。通过制作森林图和I2检验对纳入的文献进行异质性检验,如果I2 < 50%,则表示这些研究之间具有同质性,采用固定效应模型进行荟萃分析;如果I2 > 50%,则表明各研究之间存在异质性,这时采用随机效应模型进行荟萃分析。P < 0.05表示差异有统计学意义。
-
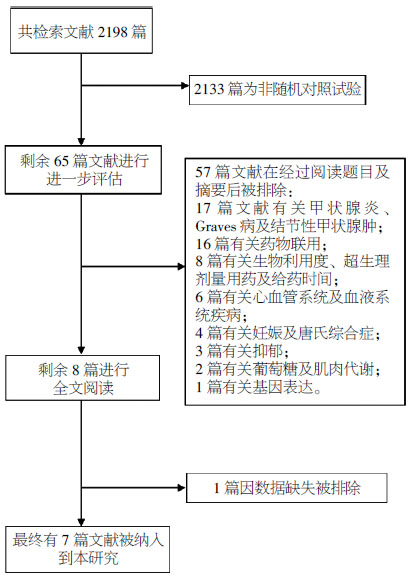
图 1为本研究的文献检索过程。最初检索获得相关文献共2198篇,其中2133篇因非RCT文献而被排除,经过阅读题目和摘要后57篇文献再被排除。经过仔细阅读全文,共有7篇RCT文献被纳入本研究中[10, 12-17],另外1篇RCT文献因数据不完整而被排除,文献检索筛选过程见图 1。纳入文献的研究资料见表 1。
作者 年份 患者例数 既往甲状腺相关疾病史 TH组血浆TSH水平/(mIU/L) 安慰剂组血浆TSH水平/(mIU/L) TH的初始使用剂量/μg 治疗时间/周 Cooper等[10] 1984 33 甲亢治疗后 10.8±2.2 11.1±3.2 50 48 Jaeschke等[12] 1996 31 文献中未提及 12.1±6.8 9.4±3.1 25 24 Meier等[13] 2001 63 自身免疫性甲状腺炎,甲亢治疗后及先天性SCH 14.4±1.7 11.3±1.0 25 48 Kong等[14] 2002 27 无甲状腺相关疾病病史 8.0±1.5 7.3±1.6 50 24 Razvi等[15] 2007 71 文献中未提及 5.4(3.8~15.8)a 5.3(3.7~15.9)a 100 24 Monzani等[16] 2004 45 自身免疫性甲状腺炎,高功能腺瘤及多结节性甲状腺肿治疗后 6.03(3.65~15.00)a 5.68(3.66~12.60)a 25 24 Caraccio等[17] 2002 49 自身免疫性甲状腺炎,甲亢治疗后 6.00(3.70~15.00)a 4.90(3.65~9.00)a 25 24 表中,TH:甲状腺激素;SCH:亚临床甲状腺功能减退症;a表示在该文献中,血浆TSH水平以“中位数及范围”表示,其余文献中以“均数±标准差”表示。 表 1 纳入的7篇随机对照文献的研究资料
Table 1. Characteristics of the trials included in the present meta-analysis
-
本研究通过绘制偏倚风险条形图及偏倚风险概要图进行质量评估(图 2)。以Cochrane中推荐的偏倚风险评价标准对所有纳入的文献进行偏倚风险评价,图 2中A表示每条风险评价标准所占的百分比,图 2中B为偏倚风险概要图,以颜色区分风险偏倚的高低,本研究中未出现红色图例,纳入的7篇文献中有5篇文献分别有1~3条未知风险项,其余2篇文献均为偏倚低风险。因此,本研究中纳入的7篇文献方法学整体质量较好。
-
本研究共进行了4组荟萃分析。第1组为比较TH及安慰剂对血浆TC水平的影响差异。该组中共纳入7篇文献。各研究之间没有明显的统计学异质性(I2=42%,P=0.11),采用固定效应模型,荟萃分析结果显示TH及安慰剂在降低血浆中TC水平的程度上无明显差异(平均差:-0.18;95% CI:[-0.40,0.03];P=0.09)(图 3)。第2组为比较TH及安慰剂对血浆LDL-C水平的影响差异。该组中共纳入6篇文献。各研究之间无统计学异质性(I2=34%,P=0.18),采用固定效应模型,荟萃分析结果显示TH降低血浆中LDL-C水平的程度明显高于安慰剂(平均差:-0.23;95% CI:[-0.44,-0.33];P=0.02)(图 4)。第3组为比较TH及安慰剂对血浆甘油三酯(triglycerides,TG)水平的影响差异。该组中共纳入6篇文献。各研究之间无统计学异质性(I2=0,P=0.92),采用固定效应模型,荟萃分析结果显示TH及安慰剂在降低血浆中TG水平的程度上无明显差异(平均差:-0.02;95% CI:[-0.17,0.13];P=0.78)(图 5)。第4组为比较TH及安慰剂对血浆高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)水平的影响差异。该组中共纳入6篇文献。各研究之间无统计学异质性(I2=0,P=0.96),采用固定效应模型,荟萃分析结果显示TH及安慰剂在升高血浆中HDL-C水平的程度上无明显差异(平均差:-0.06;95% CI:[-0.14,0.02];P=0.14)(图 6)。

图 3 甲状腺激素及安慰剂降低亚临床甲状腺功能减退症患者血浆总胆固醇水平的差异
Figure 3. Comparison of changes in the serum total cholesterol levels of patients treated with L-thyroxine or the placebo

图 4 甲状腺激素及安慰剂降低亚临床甲状腺功能减退症患者血浆低密度脂蛋白胆固醇水平的差异
Figure 4. Comparison of changes in the serum low-density lipoprotein-cholesterol levels of patients treated with L-hyroxine or the placebo
-
SCH患者有发展为甲减的风险,尤其是在甲状腺抗体阳性的患者中,这一风险更高,有研究表明,每年有2%~4.3%的SCH患者转变为甲减[3, 21]。TH替代治疗是SCH的基本治疗手段,TH替代治疗可抑制或延缓SCH向甲减的转变,并可以改善因TH缺乏引起的各种不适,提高患者的生活质量[22]。另外,外源性补充TH还能改善心脏的收缩及舒张功能障碍、高血压、血管内皮受损,增加颈动脉内膜厚度,改善其他心血管疾病的危险因素[16, 23-25]。但就目前来讲,在SCH患者中使用TH进行替代治疗对血脂水平是否产生益处尚存在争论[16, 26-27]。之前曾有一些评价TH替代治疗SCH对血脂水平影响的文章,但是结果并不一致。Anagnostis等[21]在最近的一篇文章中指出,对于TSH浓度小于7 mIU/L的SCH患者,TH替代治疗对血脂水平没有显著影响。而之前Tagami等[2]的研究表明,在经过TH替代治疗后,SCH患者的TC及LDL-C水平明显降低,且差异具有统计学意义。在另一篇评估SCH患者进行TH替代治疗后血脂水平改变程度的综述中也提到,TH替代治疗后血中TC及LDL-C水平较前降低,但TG水平未见明显变化,同时,该综述还表明,血浆中血脂基础水平及SCH的严重程度是影响TH替代治疗后血脂水平改善程度的主要因素[22]。而Villar等[28]的研究则表明,TH替代治疗后血浆TC、TG、LDL-C及HDL-C水平均没有明显改善。
为了能更全面、系统地了解TH替代治疗对血脂水平产生的影响,本研究进行了4组独立的荟萃分析,以评估TH替代治疗后血浆中TC、TG、LDL-C及HDL-C水平的变化程度。本研究采用治疗前后指标的变化值来进行统计分析。总的来说,汇总的RCT文章的整体质量比较好,存在的偏倚风险较少。分析结果显示4组比较均未见明显的异质性,在4组荟萃分析中均选择固定效应模型。本研究显示,在接受TH替代治疗后,血浆LDL-C水平降低程度差异有统计学意义(P=0.02),而TC、TG及HDL-C水平均没有明显改善(P值分别为0.09、0.78和0.14)。
本研究的结果与之前提到的两篇相关文献结果存在一定的差异[22, 28]。笔者认为,最重要的原因是本研究中增加了另一篇RCT文献用于结果分析,从而使数据更加完善。在Danese等[22]的研究中,纳入的大多数文献为非随机对照试验,没有设置对照组,并且大多数文献的样本量较小。本研究中纳入的文献均为RCT,与Danese等[22]的研究中只有两篇RCT相比,笔者检索到了另外6篇RCT,经过仔细筛查,其中7篇RCT被纳入最后的进一步分析中,另外1篇因数据不完整而被剔除。而之前仅有的1篇关于补充TH对SCH治疗效果的荟萃分析中包括了12篇RCT[21]。该研究涉及内容极其广泛,包括心血管系统疾病的发病率及病死率、症状改善情况、生活质量评估、认知功能、血脂改善情况、TSH水平恢复情况及用药后的不良反应。本研究的主要研究焦点是TH治疗后血脂水平的改善情况。在比较血浆TC水平变化的这组荟萃分析中,笔者除了引用Villar等研究中的3篇RCT文献,还新增加了1篇RCT文献([14]),在其余的3组荟萃分析中,与之前的荟萃分析相比,笔者在TG组中增加了3篇RCT文献([10, 16-17]),在LDL-C与HDL-C组中增加了另外3篇RCT文献([15-17]),最后本研究确定在经过TH治疗后,只有LDL-C水平有明显改善。
与之前的荟萃分析相比,本研究在经过数据的补充后,数据资料更加全面,相信这会使结果更加可靠。本研究也存在局限性:第一,最终纳入到本研究进行分析的文献数量较少,同时,部分文献中涉及的样本例数也较少,这是本研究最主要的局限性;第二,在所纳入的研究中血浆TSH及血脂的基础水平并不相同;第三,因为数据不完整,有1篇RCT文献未纳入到本研究中;最后,近期没有与本课题有关的RCT发表。以上局限性均可能增加本研究的偏倚,影响研究质量。
总之,本研究总结了可获得的有关TH治疗SCH对血脂水平影响的RCT文献,最后得出结论:在进行TH治疗后,SCH患者血浆LDL-C水平得到改善,而血浆TC、TG、HDL-C水平未见明显变化。
甲状腺激素治疗亚临床甲状腺功能减退症对血脂水平影响的荟萃分析
Effect of L-thyroxine versus placebo treatment on serum lipid levels in subclinical hypothyroidism
-
摘要:
目的 使用荟萃分析方法汇总随机对照试验,评估甲状腺激素对亚临床甲状腺功能减退症(SCH)患者血脂水平的影响。 方法 以“thyroxine”、“ levothyroxin”及“levothyroxine”为关键词检索了2015年7月前包括Cochrane Library、PubMed、Medline、Google Scholar及Embase等在内的数据库中有关甲状腺激素替代治疗SCH的随机对照试验文献,所有数据均为连续型变量,采用Cochrane提供的RevMan 5.2软件进行统计学分析,依据Cochrane质量评价标准进行文献质量评估。当研究间存在异质性时(I2 > 50%),采用随机效应模型进行荟萃分析;否则采用固定效应模型进行荟萃分析。 结果 最终纳入7篇随机对照试验文献,共319例患者。纳入的7篇文献方法学整体质量较好。共进行4组荟萃分析评价甲状腺激素对血脂的影响,4组研究之间无统计学异质性[总胆固醇(TC):I2=42%,P=0.11;甘油三酯(TG):I2=0,P=0.92;低密度脂蛋白胆固醇(LDL-C):I2=34%,P=0.18;高密度脂蛋白胆固醇(HDL-C):I2=0,P=0.96],均采用固定效应模型进行荟萃分析。荟萃分析结果显示,甲状腺激素及安慰剂对血浆中血脂水平的影响程度如下:TC(平均差:-0.18;95% CI:[-0.40,0.03];P=0.09)、TG(平均差:-0.02;95% CI:[-0.17,0.13];P=0.78)、LDL-C(平均差:-0.23;95% CI:[-0.44,-0.33];P=0.02)、HDL-C(平均差:-0.06; 95% CI:[-0.14,0.02];P=0.14)。 结论 对于SCH患者,在进行外源性甲状腺激素治疗后,血浆LDL-C水平得到改善,而血浆TC、TG、HDL-C水平未见明显变化。 -
关键词:
- 状腺激素类 /
- 随机对照试验 /
- Meta分析 /
- 亚临床甲状腺功能减退症 /
- 血脂
Abstract:Objective Subclinical hypothyroidism is a common disease. However, whether L-thyroxine replacement treatment can affect serum lipids in cases of subclinical hypothyroidism remains controversial. The objective of this meta-analysis was to assess the effect of L-thyroxine therapy on serum lipid levels of patients with subclinical hypothyroidism. Methods Literature dated until July 2015 was retrieved from the Cochrane Library, PubMed, Medline, Google Scholar, and Embase searching for the keywords "hyroxine", "levothyroxin" and "levothyroxine". All randomized controlled trials(RCTs) to determine the effects of L-thyroxine replacement on serum lipid levels were included in this study. After screening, the eligible RCTs were included in this meta-analysis. Statistical analyses were performed by the Review Manager 5.2 software. All the assessed outcomes were continuous data. Results A total of 7 RCTs involving 319 patients were included. The overall methodological quality of the RCTs was good. Results showed that the serum low density lipoprotein-cholesterol(LDL-C) level significantly decreased after L-thyroxine treatment [mean difference(MD):-0.23; 95% CI: [-0.44, -0.03]; P=0.02]. Meanwhile, changes in the total cholesterol(MD: -0.18; 95% CI: [-0.40, 0.03]; P=0.09), triglyceride(MD: -0.02; 95% CI: [-0.17, 0.13]; P=0.78), and high density lipoprotein-cholesterol(MD: -0.06; 95% CI: [-0.14, 0.02]; P=0.14) levels were not significant. Conclusions All available RCT evidence on the effect of L-thyroxine on serum lipid levels in subclinical hypothyroidism revealed a significant improvement in the serum LDL-C levels. However, the serum TC, TG, and HDL-C levels did not significantly change. -
表 1 纳入的7篇随机对照文献的研究资料
Table 1. Characteristics of the trials included in the present meta-analysis
作者 年份 患者例数 既往甲状腺相关疾病史 TH组血浆TSH水平/(mIU/L) 安慰剂组血浆TSH水平/(mIU/L) TH的初始使用剂量/μg 治疗时间/周 Cooper等[10] 1984 33 甲亢治疗后 10.8±2.2 11.1±3.2 50 48 Jaeschke等[12] 1996 31 文献中未提及 12.1±6.8 9.4±3.1 25 24 Meier等[13] 2001 63 自身免疫性甲状腺炎,甲亢治疗后及先天性SCH 14.4±1.7 11.3±1.0 25 48 Kong等[14] 2002 27 无甲状腺相关疾病病史 8.0±1.5 7.3±1.6 50 24 Razvi等[15] 2007 71 文献中未提及 5.4(3.8~15.8)a 5.3(3.7~15.9)a 100 24 Monzani等[16] 2004 45 自身免疫性甲状腺炎,高功能腺瘤及多结节性甲状腺肿治疗后 6.03(3.65~15.00)a 5.68(3.66~12.60)a 25 24 Caraccio等[17] 2002 49 自身免疫性甲状腺炎,甲亢治疗后 6.00(3.70~15.00)a 4.90(3.65~9.00)a 25 24 表中,TH:甲状腺激素;SCH:亚临床甲状腺功能减退症;a表示在该文献中,血浆TSH水平以“中位数及范围”表示,其余文献中以“均数±标准差”表示。 -
[1] Cooper DS, Biondi B. Subclinical thyroid disease[J]. Lancet, 2012, 379(9821): 1142-1154. DOI:10. 1016/S0140-6736(11)60276-6. [2] Tagami T, Tamanaha T, Shimazu S, et al. Lipid profiles in the untreated patients with Hashimoto thyroiditis and the effects of thyroxine treatment on subclinical hypothyroidism with Hashimoto thyroiditis[J]. Endocr J, 2010, 57(3): 253-258. DOI:10.1507/endocrj.K09E-315" target="_blank">http://doi.org/10.1507/endocrj.K09E-315. [3] Biondi B, Cooper DS. The clinical significance of subclinical thyroid dysfunction[J]. Endocr Rev, 2008, 29(1): 76-131. DOI:10. 1210/er. 2006-0043. [4] Danzi S, Klein I. Thyroid hormone and the cardiovascular system[J]. Med Clin North Am, 2012, 96(2): 257-268. DOI:10. 1016/j. mcna. 2012. 01. 006. [5] Larosa JC, He J, Vupputuri S. Effect of statins on risk of coronary disease:a meta-analysis of randomized controlled trials[J]. JAMA, 1999, 282(24): 2340-2346. DOI:10.1001/jama.282.24.2340. [6] Isles CG, Paterson JR. Identifying patients at risk for coronary heart disease:implications from trials of lipid-lowering drug therapy[J]. QJM, 2000, 93(9): 567-574. DOI:10.1093/qjmed/93.9.567" target="_blank">http://dx. doi. org/10. 1093/qjmed/93. 9. 567. [7] Walsh JP, Bremner AP, Bulsara MK, et al. Thyroid dysfunction and serum lipids:a community-based study[J]. Clin Endocrinol(Oxf), 2005, 63(6): 670-675. DOI:10. 1111/j. 1365-2265. 2005. 02399. x. [8] Kvetny J, Heldgaard PE, Bladbjerg EM, et al. Subclinical hypothyroidism is associated with a low-grade inflammation, increased triglyceride levels and predicts cardiovascular disease in males below 50 years[J]. Clin Endocrinol(Oxf), 2004, 61(2): 232-238. DOI:10. 1111/j. 1365-2265. 2004. 02088. x. [9] Iqbal A, Jorde R, Figenschau Y. Serum lipid levels in relation to serum thyroid-stimulating hormone and the effect of thyroxine treatment on serum lipid levels in subjects with subclinical hypothyroidism:the Tromsø Study[J]. J Intern Med, 2006, 260(1):53-61. DOI:10. 1111/j. 1365-2796. 2006. 01652. x. [10] Cooper DS, Halpern R, Wood LC, et al. L-Thyroxine therapy in subclinical hypothyroidism. a double-blind, placebo-controlled trial[J]. Ann Intern Med, 1984, 101(1): 18-24. doi: 10.7326/0003-4819-101-1-18 [11] Nyström E, Caidahl K, Fager G, et al. A double-blind cross-over 12-month study of L-thyroxine treatment of women with ′subclinical′ hypothyroidism[J]. Clin Endocrinol(Oxf), 1988, 29(1): 63-75. doi: 10.1111/j.1365-2265.1988.tb00250.x [12] Jaeschke R, Guyatt G, Gerstein H, et al. Does treatment with L-thyroxine influence health status in middle-aged and older adults with subclinical hypothyroidism?[J]. J Gen Intern Med, 1996, 11(12):744-749. doi: 10.1007/BF02598988 [13] Meier C, Staub JJ, Roth CB, et al. TSH-controlled L-thyroxine therapy reduces cholesterol levels and clinical symptoms in subclinical hypothyroidism:a double blind, placebo-controlled trial(Basel Thyroid Study)[J]. J Clin Endocrinol Metab, 2001, 86(10): 4860-4866. DOI:10. 1210/jcem. 86. 10. 7973. [14] Kong WM, Sheikh MH, Lumb PJ, et al. A 6-month randomized trial of thyroxine treatment in women with mild subclinical hypothyroidism[J]. Am J Med, 2002, 112(5): 348-354. doi: 10.1016/S0002-9343(02)01022-7 [15] Razvi S, Ingoe L, Keeka G, et al. The beneficial effect of L-thyroxine on cardiovascular risk factors, endothelial function, and quality of Life in subclinical hypothyroidism:randomized, crossover trial[J]. J Clin Endocrinol Metab, 2007, 92(5): 1715-1723. DOI:10. 1210/jc. 2006-1869. [16] Monzani F, Caraccio N, Kozàkowà M, et al. Effect of levothyroxine replacement on lipid profile and intima-media thickness in subclinical hypothyroidism:a double-blind, placebo-controlled study[J]. J Clin Endocrinol Metab, 2004, 89(5): 2099-2106. DOI:10. 1210/jc. 2003-031669. [17] Caraccio N, Ferrannini E, Monzani F. Lipoprotein profile in subclinical hypothyroidism:response to levothyroxine replacement, a randomized placebo-controlled study[J]. J Clin Endocrinol Metab, 2002, 87(4): 1533-1538. DOI:10. 1210/jcem. 87. 4. 8378. [18] Higgins JP, Altman DG, Gøtzsche PC, et al. The Cochrane Collaboration′s tool for assessing risk of bias in randomised trials[J/OL]. BMJ, 2011, 343:d5928[2016-05-27]. 10.1136/bmj.d5928" target="_blank">http://www. bmj. com/content/343/bmj. d5928. long. DOI:10. 1136/bmj. d5928. [19] Hopp L. Risk of bias reporting in Cochrane systematic reviews[J]. Int J Nurs Pract, 2015, 21(5): 683-686. DOI:10. 1111/ijn. 12252. [20] Higgins JPT, Green S. Cochrane handbook for systematic reviews of interventions v.5.0.1[EB/OL]. [2016-05-27]. http://www. cochrane-handbook. org. [21] Anagnostis P, Efstathiadou ZA, Slavakis A, et al. The effect of L-thyroxine substitution on lipid profile, glucose homeostasis, inflammation and coagulation in patients with subclinical hypothyroidism[J]. Int J Clin Pract, 2014, 68(7): 857-863. DOI:10. 1111/ijcp. 12394. [22] Danese MD, Ladenson PW, Meinert CL, et al. Clinical review 115:effect of thyroxine therapy on serum lipoproteins in patients with mild thyroid failure:a quantitative review of the literature[J]. J Clin Endocrinol Metab, 2000, 85(9): 2993-3001. DOI:10. 1210/jcem. 85. 9. 6841. [23] Jorde R, Waterloo K, Storhaug H, et al. Neuropsychological function and symptoms in subjects with subclinical hypothyroidism and the effect of thyroxine treatment[J]. J Clin Endocrinol Metab, 2006, 91(1): 145-153. DOI:10. 1210/jc. 2005-1775. [24] Biondi B, Klein I. Hypothyroidism as a risk factor for cardiovascular disease[J]. Endocrine, 2004, 24(1): 1-13. DOI:10. 1385/ENDO:24:1:001. [25] Biondi B, Lombardi G, Palmieri EA. Screening and treatment for subclinical thyroid disease[J]. JAMA, 2004, 291(13): 1562. DOI:10. 1001/jama. 291. 13. 1562-a. [26] Tanis BC, Westendorp GJ, Smelt HM. Effect of thyroid substitution on hypercholesterolaemia in patients with subclinical hypothyroidism:a reanalysis of intervention studies[J]. Clin Endocrinol(Oxf), 1996, 44(6): 643-649. DOI:10. 1046/j. 1365-2265. 1996. 739560. x. [27] Catli G, Anik A, Tuhan HU, et al. The effect of L-Thyroxine treatment on hypothyroid symptom scores and lipid profile in children with subclinical hypothyroidism[J]. J Clin Res Pediatr Endocrinol, 2014, 6(4): 238-244. DOI:10. 4274/jcrpe. 1594. [28] Villar HC, Saconato H, Valente O, et al. Thyroid hormone replacement for subclinical hypothyroidism[J/OL]. Cochrane Database Syst Rev, 2007, (3):CD003419[2016-05-27]. 10.1002/14651858.CD003419.pub2/epdf" target="_blank">http://onlinelibrary. wiley. com/doi/10. 1002/14651858. CD003419. pub2/epdf. DOI:10. 1002/14651858. CD003419. pub2. [29] Caraccio N, Natali A, Sironi A, et al. Muscle metabolism and exercise tolerance in subclinical hypothyroidism:a controlled trial of levothyroxine[J]. J Clin Endocrinol Metab, 2005, 90(7): 4057-4062. DOI:10. 1210/jc. 2004-2344. [30] Monzani F, Di Bello V, Caraccio N, et al. Effect of levothyroxine on cardiac function and structure in subclinical hypothyroidism:a double blind, placebo-controlled study[J]. J Clin Endocrinol Metab, 2001, 86(3): 1110-1115. DOI:10. 1210/jcem. 86. 3. 7291. [31] Ross DS. Bone density is not reduced during the short-term administration of levothyroxine to postmenopausal women with subclinical hypothyroidism:a randomized, prospective study[J]. Am J Med, 1993, 95(4): 385-388. DOI:10. 1016/0002-9343(93)90307-B. [32] Yazici M, Gorgulu S, Sertbas Y, et al. Effects of thyroxin therapy on cardiac function in patients with subclinical hypothyroidism:index of myocardial performance in the evaluation of left ventricular function[J]. Int J Cardiol, 2004, 95(2/3): 135-143. DOI:10. 1016/j. ijcard. 2003. 05. 015. -






 下载:
下载: