-
帕金森病(Parkinson′s disease,PD)是一种脑部神经系统退行性疾病,中老年多见,病理变化是脑内黑质多巴胺能神经元变性脱失,纹状体多巴胺减少的同时乙酰胆碱相对增多,随疾病演进致患者出现神经系统症状,如静止性震颤、肌强直、运动迟缓等。据相关研究,通常出现运动障碍症状时,患者脑内约50%以上的多巴胺神经元已经死亡[1]。目前,干扰临床诊断的难点主要有以下方面:① PD的确诊需要组织病理学上Lewy体的出现,而病理难以获得。②没有持续可靠的诊断标准,无法评估患者的病情发展,对于部分难以确诊的患者只能通过长期随访做出最终诊断。③PD症状呈多样性,并且部分患者临床症状不典型,难以与产生类似PD症状的神经系统疾病相鉴别。PET作为新型的影像学技术,凭借分子成像反映PD疾病变化与发展,在诊断及病情评价方面有重要的作用[2]。国外多项研究证明,PD病理变化与糖代谢、多巴胺转运体(dopamine transporter,DAT)变化均密切相关[3-4]。18F-FDG作为最成熟的PET显像剂,其提供的特异性的PD脑代谢模式是PD诊断和鉴别诊断的良好生物学指标[3]。在先进的PET影像基础上,多巴胺转运蛋白显像剂11C-甲基-N-2β-甲基酯-3β(4-F苯基)托烷[11C-2β-carbomethoxy-3β-(4-fluorophenyl)tropane,11C-CFT]作为新型生物学标志物,能够高特异性地与DAT结合来反映PD早期的病理改变,所提供PD患者脑内DAT信息可为PD病情严重程度评估提供重要价值。研究表明DAT功能与11C-CFT摄取呈正相关。Huang等[4]研究表明,11C-CFT PET显像对脑DAT的检测是早期诊断PD的一种重要技术。本研究对临床诊断的55例PD患者与30名健康对照者联合18F-FDG脑代谢与11C-CFT脑DAT PET显像,观察PD患者脑葡萄糖代谢与脑DAT PET显像的特点,探讨18F-FDG脑代谢联合11C-CFT脑DAT PET双显像在PD诊断及病情严重程度评估中的应用价值。
-
收集2015年2月至2016年2月我院神经内科确诊的PD患者55例,其中男性28例,平均年龄(64.82±11.35)岁;女性27例,平均年龄(62.11±9.31)岁。同时期选取年龄匹配的30名健康对照者,其中男性9名,平均年龄(61.44±6.21)岁;女性21名,平均年龄(60.71±8.96)岁。PD患者中单侧肢体症状者27例,双侧肢体症状者28例。
-
所有PD患者均符合英国伦敦帕金森协会脑库诊断标准[5]。
-
① 有反复的脑卒中、脑损伤、脑炎病史;②用过抗精神病药物;③脑CT有器质性病变;④大剂量左旋多巴药物治疗无效。
-
显像设备为美国GE discovers VCT64 PET/CT。扫描前受试者需停用抗PD药物2 d并禁食水8 h,18F-FDG显像和11C-CFT显像分别于前后两天进行。受检者分别注射18F-FDG及11C-CFT(平均185~370 MBq,均由我中心制备且放化纯度 > 95%),1 h后于安静闭目状态下从头顶至小脑下端行CT扫描,对CT数据进行衰减校正后再行PET三维模式扫描采集,经过计算机处理获得脑横断面、冠状面、矢状面及三维重建图像。
所有患者和健康对照者均于检查前签署了知情同意书。
-
CT图像上选择基底节区清晰的3个横断面图像:①18F-FDG显像,以小脑为基准,通过勾画18F-FDG影像上双侧尾状核头、双侧壳核、周围脑实质为ROI,以ROI内平均放射性计数作为半定量分析指标,对部分PD患者大脑皮层代谢减低区域进行半定量分析,反映该区域脑葡萄糖代谢。②11C-CFT显像,以小脑为基准,通过勾画双侧尾状核及壳核、小脑为ROI,以ROI内平均放射性计数作为半定量分析指标;(ROI计数-小脑计数)/小脑计数[(ROI-CB)/CB]比值作为11C-CFT摄取值,以此反映该区域DAT分布情况。
根据PD基底节壳核受累程度特点对11C-CFT PET显像图像判读,轻度表现为壳核后部放射性分布减低,壳核前、中部放射性分布基本正常;轻-中度表现为壳核后部放射性分布减低,壳核中部放射性分布略减低,壳核头部放射性分布基本正常;中度表现为壳核中后部放射性分布明显减低,壳核头部放射性分布基本正常;中-重度表现为壳核中后部放射性分布减低至缺损,壳核前部放射性分布减低;重度表现为壳核前、中、后部放射性分布稀疏减低至缺损。
-
应用SPSS17.0软件进行分析,计量数据以x±s表示。PD组与健康对照组组间ROI内放射性计数(基底节区11C-CFT摄取值)差异比较采用两样本t检验,P≤0.05表示差异有统计学意义。
-
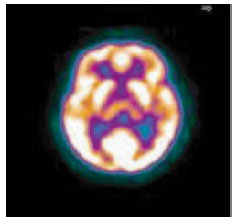
健康对照者18F-FDG PET显像表现为大脑形态如常,皮层各叶放射性分布均匀对称。双侧基底节区壳核放射性分布均匀对称;双侧尾状核头及双侧丘脑放射性分布基本同周围脑组织(图 1)。
-
健康对照者11C-CFT PET显像表现为双侧基底节区双侧尾状核放射性分布均匀对称,双侧壳核放射性分布均匀对称,未见异常放射性分布稀疏或缺损区(图 2)。
-
PD组与健康对照组比较,55例PD患者中51例18F-FDG PET显像表现为基底节区葡萄糖代谢水平增高(图 3中A),另外4例PD患者18F-FDG PET显像未见明显异常。
经过半定量分析后,部分PD患者在表现双侧基底节区葡萄糖代谢增高同时分别有大脑皮质不同区域的脑葡萄糖代谢减低。主要有下列几种表现:①双侧基底节区对称性放射性分布增高51例(占92.73%);②非对称性基底节区放射性减低2例(占3.64%);③双侧基底节区未见明显异常2例(占3.64%);④通过半定量分析数据所得,28例患者表现为大脑皮质代谢出现不同程度减低(CT于上述部位未见异常密度改变):其中20例患者(占36.36%)伴有顶叶代谢减低(图 3中B),7例患者(占12.73%)伴有颞叶代谢减低(图 3中C),7例患者(占12.73%)伴有额叶代谢减低(图 3中B),2例患者(3.64%)伴有枕叶代谢减低(图 3中D)。
-
健康对照组与PD组尾状核及壳核的平均11C-CFT摄取值详见表 1。健康对照组双侧基底节区(尾状核、壳核前、中、后部)11C-CFT摄取值之间的差异无统计学意义(t=-0.96、-1.17、-2.23、-1.73,P均 > 0.05)。55例PD患者肢体症状起病特点不同,通过11C-CFT代谢显像中双侧基底节区11C-CFT摄取值对比得到:①双侧肢体症状患者28例,两侧(患侧及健侧)尾状核及双侧壳核之间11C-CFT摄取值的差异无统计学意义(t=-1.31、-1.28、-0.94、-1.55,P均 > 0.05)。②单侧肢体症状患者27例,起病侧(患侧)及起病对侧(健侧)基底节11C-CFT摄取值均低于健康对照组(表 1);双侧基底节DAT分布呈双侧不对称降低,且起病对侧壳核后部显著降低。起病患侧的对侧尾状核、壳核前部、中部、后部分别减低至患侧的91.52%、90.95%、90.52%、83.80%。
组别 例数 尾状核 壳核前部 壳核中部 壳核尾部 健康对照组 30 2.86±0.33 3.20±0.36 3.06±0.32 2.81±0.43 PD组 单侧症状
(患侧)27 2.01±0.36
(t=-18.07)1.97±0.34
(t=-19.65)1.54±0.35
(t=-16.59)1.30±0.27
(t=-17.63)单侧症状
(健侧)27 1.82±0.41
(t=-16.34)1.77±0.30
(t=-15.59)1.39±0.29
(t=-13.73)1.10±0.23
(t=-15.27)双侧症状 28 1.45±0.29
(t=-11.35)1.29±0.33
(t=-10.66)0.81±0.31
(t=-13.30)0.58±0.30
(t=-10.96)表中,PD:帕金森病;双侧症状帕金森病患者与健康对照组之间双侧基底节(左右两侧)的11C-CFT摄取值差异无统计学意义,P均>0.05。单侧症状帕金森病组与健康对照组之间的双侧基底节的11C-CFT摄取值差异有统计学意义,P均<0.05。 表 1 健康对照组与PD组尾状核及壳核的11C-CFT平均摄取值(x±s)
Table 1. The average intake of 11C-CFT values in healthy control group and PD group of caudate nucleus and putamen(x±s)
-
根据PD基底节壳核受累程度对11C-CFT PET图像进行严重程度分级并测得各基底节区11C-CFT摄取值,详见表 2。轻、轻-中、中、中-重、重度不同程度PD组分别与健康对照组比较,各PD组双侧基底节区尾状核、双侧壳核前、中、后部11C-β-CFT摄取值与健康对照组11C-CFT摄取值之间的差异有统计学意义。
PET分级 图像数 尾状核头 壳核前部 壳核中部 壳核后部 健康对照组 60 2.86±0.33 3.20±0.36 3.06±0.32 2.81±0.43 PD组 轻度 16 2.38±0.43(t=-9.67) 2.36±0.57(t=-10.25) 1.99±0.36(t=-14.71) 1.86±0.41(t=-12.76) 轻-中度 13 1.64±0.39(t=-6.85) 1.60±0.39(t=-11.32) 1.08±0.26(t=-17.78) 0.74±0.25(t=-18.81) 中度 31 1.68±0.46(t=-10.95) 1.55±0.43(t=-16.31) 1.00±0.27(t=-26.42) 0.67±0.20(t=-30.76) 中-重度 35 1.55±0.45(t=-13.15) 1.35±0.35(t=-21.30) 0.82±0.21(t=-32.10) 0.59±0.18(t=-32.63) 重度 15 1.13±0.37(t=-8.82) 0.97±0.41(t=-13.28) 0.60±0.29(t=-21.75) 0.46±0.25(t=-22.38) 注:表中,PD:帕金森病;表中图像数为双侧基底节区图像数。不同严重程度的帕金森患者图像组与健康对照组壳核11C-CFT摄取值之间的差异有统计学意义,P均 < 0.05。 表 2 根据11C-CFT PET显像图像分级示各基底节区摄取值(x±s)
Table 2. The basal ganglia uptake values are shown depending on11C-CFTPET classification imagings(x±s)
PD患者与健康对照组的11C-CFT PET显像图比较见图 4。单侧基底节区轻度16例(图 4中B),表现为壳核后部放射性分布减低,壳核前、中部放射性分布基本正常。尾状核、壳核前、中、后部11C-CFT摄取值减低至健康对照组的83.21%、73.75%、65.03%、66.19%。

图 4 金森病患者与正常对照组的11C-CFT PET显像图比较
Figure 4. 11C-CFT PET imagings of Parkinson′s disease patients and normal control group
单侧基底节区轻-中度13例,表现为壳核后部放射性分布减低,壳核中部放射性分布略减低,壳核头部放射性分布基本正常。尾状核、壳核前、中、后部11C-CFT摄取值减低至健康对照组的57.34%、50.00%、35.29%、26.33%。
单侧基底节区中度31例(图 4中C),表现为壳核中后部放射性分布明显减低,壳核头部放射性分布基本正常。尾状核、壳核前、中、后部11C-CFT摄取值减低至健康对照组的58.74%、48.44%、32.67%、23.84%。
单侧基底节区中-重度35例,表现为壳核中后部放射性分布减低至缺损,壳核前部放射性分布减低。尾状核、壳核前、中、后部11C-CFT摄取值减低至健康对照组的54.20%、42.19%、26.80%、21.00%。
单侧基底节区重度15例(图 4中D),表现为壳核前、中、后部放射性分布稀疏减低至缺损。尾状核、壳核前、中、后部11C-CFT摄取值减低至健康对照组的39.51%、30.31%、19.61%、16.37%。
-
目前临床对PD的诊断及病情评估主要是根据患者相关症状及其体征,缺乏客观的依据。PET凭借分子成像,通过定位与定量分析,动态地反映PD分子水平发展的脑葡萄糖代谢及DAT蛋白受体信息。
18F-FDG脑代谢显像机制在于脑内代谢能源几乎全部由葡萄糖供应,各个神经核团的功能都随葡萄糖代谢变化而变化,因而能够体现脑神经元的相对活性。大脑额叶运动区是产生思考及控制躯体运动的中枢;顶叶与躯体的感觉相关;颞叶与听觉、语言以及记忆相关;枕叶与视觉的整合相关;当PD患者出现自主活动减少、行动迟缓等相关躯体症状就可能与这些部位受损有关。本研究共分析了55例PD患者,通过与30名健康对照者脑内葡萄糖代谢信息对比发现,其中51例PD患者18F-FDG PET影像表现为双侧基底节区代谢增高同时部分患者分别伴有大脑额叶、顶叶、颞叶、枕叶不同程度的葡萄糖代谢减低,这符合既往国内[6]对于PD患者脑功能网络代谢模式的报道。Wichmann和DeLong[7]发现这可能与基底节区抑制性输出过多而运动皮质区代谢减低有关。另外本研究中有2例18F-FDG代谢显像未见明显异常,但11C-CFT PET影像却观察到了双侧基底节区壳核的放射性分布减低,说明患者多巴胺受体功能已受累,而葡萄糖代谢显像却未显示异常。Arahata等[8]研究发现,9例未经治疗的PD患者局部和全脑18F-FDG代谢无异常改变,并且轻、重度PD间18F-FDG代谢亦未见明显差别。因此,脑葡萄糖代谢显像也存在一定局限性,且不能够反映病情严重程度,需要联合11C-CFT脑DAT显像。
DAT是调节维持多巴胺(DA)神经递质的重要原因,对神经系统的生理活动至关重要,并且不受药物影响,是反映多巴胺递质功能的重要指标[9]。动物实验表明,DAT能够准确地反映黑质纹状体多巴胺神经元的功能完整性[10]。由于PD患者黑质纹状体多巴胺神经元的变性脱失伴随突触前膜多巴胺转运蛋白数量及功能下降,多项研究[11-15]利用11C-CFT与DAT可特异性地结合于PD患者基底节区的特点,观察到PD患者基底节区11C-CFT摄取值显著低于正常组,并表明11C-CFT摄取值与PD患者临床Hoehn-Yahr(H-Y)分期及统一帕金森病评分量表(UPDRS)运动评分呈显著负相关。王慧春等[11]研究显示,早中期PD患者双侧壳核摄取减少呈不对称性,以起病对侧减少为主,后壳核区域最为显著。何婷婷等[12]发现PD患者主要表现为两侧尾状核及壳核浓聚明显减少,以壳核中后部为著,患肢对侧尾状核及壳核区降低更明显,上述研究均显示了11C-CFT PET显像对于早期PD患者的DAT变化的检测具有较高的灵敏度。DAT显像能够评价DAT损害的部位、密度及功能并对PD病情严重程度进行分级[13],因此是PD诊断及病情严重程度评估的良好指标。冼文彪等[14]对早、晚期PD患者行11C-CFT PET显像并运用统计参数图(SPM)分析,结果发现,早期PD者较正常组表现为最早开始减少部位从脑部外侧的壳核,逐渐发展至靠近脑部中线的尾状核,证明11C-CFT PET显像可以用来评估患者的病情严重程度以及监测疾病的进展。Ishibashi等[15]比较了PD患者与正常者基底节区DAT的摄取差异,发现PD患者尾状核、后连合尾状核、前连合背侧壳核和后连合壳核DAT吸收率分别为26.2%、29.9%、34.5%和60.2%;而正常者分别为5.4%、8.5%、6.2%和7.8%,认为后连合壳核是DAT下降的一个初始区域且会严重影响疾病进展。本研究通过11C-CFT PET显像对PD严重程度分级示:轻度PD患者壳核减低区域主要表现为后部受累,重度PD患者壳核减低区域表现为前、中、后部均受累,中度PD患者介于轻重患者之间表现为壳核中部11C-CFT摄取减低,并且随着PD患者病情进展,基底节区11C-CFT摄取值以起病对侧壳核的后部减低为著,随严重度加重逐渐累及壳核前部,PD患者基底节区11C-CFT摄取值随着分级严重度进展减缓。据尸检研究分析,多巴胺神经元变性首先出现在壳核后部,随着病情发展逐渐发展至壳核前部,这表明11C-CFT显像特点与PD病理变化相一致,本研究结果与既往国内外相关研究相符[11-17]。因此,若PD患者在11C-CFT PET显像中出现不对称的壳核后部代谢减缓,就应考虑有早期黑质纹状体通路损害,11C-CFT PET显像通过结合视觉分析的同时进行11C-CFT摄取值的测量,对于评价PD患者病情严重程度方面是较理想的分析指标。
另外本研究通过对28例双侧肢体症状及27例单侧肢体症状的PD患者行11C-CFT PET显像研究发现,无论单侧还是双侧肢体症状,都有可能累及双侧基底节区壳核,并且双侧壳核受累程度表现不同,但是均以肢体严重程度重侧的对侧基底节DAT减低更为显著,壳核后部首先受累,这与早期PD患者在病理上脑内黑质受损呈不对称性并以起病肢体对侧的黑质纹状体通路损害重于起病侧肢体相关[18]。因此,通过视觉分析并结合11C-CFT摄取值差异分析11C-CFT PET显像,能够为临床提供较为客观的影像学评价指标。但是11C-CFT PET显像也存在一定问题,Antonini等[19]研究在多系统萎缩、进行性核上性麻痹等PD叠加综合征患者中,PET也可以存在纹状体的DAT摄取值下降,而18F-FDG PET在鉴别诊断上,通过PD葡萄糖相关代谢模式(即PDRP)可鉴别不典型PD综合征及其他运动障碍疾病。因此,本研究对PD患者及正常组进行了对比,通过联合18F-FDG PET及11C-CFT PET显像,同时提供较完备的脑代谢及多巴胺受体信息,分析基底节区葡萄糖代谢水平及基底节区壳核前、中、后部DAT分布情况,二者优势互补更加准确地显示了病变区域及程度,对PD诊断及严重度评估方面提供了较为客观的影像学分析指标。在临床许可的条件下,可对临床部分症状不典型患者及鉴别诊断困难的患者通过联合显像对PD疾病准确评估,及时予以药物治疗,以达到早期并针对性、保护性地治疗目的。当然本研究也存在局限性:①我们需要考虑DAT显像会因设备、药物注射剂量及注射时间的不同而产生一定的误差;②目前还不能制定SUV参考值作为对PD严重程度分级的确定界限值。③后期对联合显像能否应用于PD患者治疗后的疗效评估方面有待进一步研究。
帕金森病脑部葡萄糖代谢和脑多巴胺转运体PET显像特点的临床研究
Clinical study of brain glucose metabolism and brain dopamine transporter PET imaging in patients with Parkinson′s disease
-
摘要:
目的 探讨18F-FDG脑代谢联合11C-甲基-N-2β-甲基酯-3β(4-F苯基)托烷(11C-CFT)脑多巴胺转运体(DAT)PET双显像在帕金森病(PD)诊断与病情严重程度评估中的应用价值。 方法 对55例不同严重程度的PD患者及30名健康对照者分别行18F-FDG脑代谢显像和11C-CFT脑DAT PET显像检查,通过勾画ROI,比较PET图像中不同严重程度的PD患者与健康对照者中脑基底节区葡萄糖代谢及DAT分布的差异,分析18F-FDG PET、11C-CFT PET显像在不同严重程度PD评估中的作用及特点。 结果 与健康对照者相比,18F-FDG PET显像中PD患者脑葡萄糖代谢改变主要为双侧基底节区壳核对称性代谢增高,同时部分患者伴有大脑皮质不同程度代谢减低;11C-CFT PET显像中PD患者双侧尾状核、壳核前、中、后部表现为DAT分布不同程度减低。单侧症状者或双侧症状者均以患侧对侧基底节区壳核DAT分布减低明显,并以壳核后部DAT分布减低为著。 结论 18F-FDG PET联合11C-CFT PET双显像在PD诊断及病情严重程度评估中有应用价值。 -
关键词:
- 帕金森病 /
- 葡萄糖 /
- 正电子发射断层显像术 /
- 氟脱氧葡萄糖F18 /
- 多巴胺转运体
Abstract:Objective To explore 18F-FDG brain metabolism and 11C-2βcarbomethoxy-3β(4-fluorophenyl) tropane (11C-CFT) brain dopamine transporter(DAT) PET dual imaging in the diagnosis and evaluation of the severity of Parkinson's disease(PD). Methods Fifty-five patients with different severity of PD and 30 cases of healthy controls were subjected to 18F-FDG cerebral metabolic imaging and 11C-CFT DAT PET imaging examination, in which ROI were outlined to compare the differences in glucose metabolism and DAT distribution in the basal ganglia of PD with different severity among the patients and those of healthy controls based on the PET images. 18F-FDG PET and 11C-CFT PET imaging were used to assess severity of PD. Results By comparison with the healthy controls, 18F-FDG PET imaging indicates that the changes in brain metabolism caused by PD mainly show improvement in symmetry of bilateral basal ganglia putamen. Moreover, some PD cases are accompanied with reduction in the metabolism of cerebral cortex to varying degrees. 11C-CFT PET imaging in PD patients indicates that DAT distribution in their bilateral caudate nucleus, bilateral anterior putamen, medio-putamen, and posterior putamen decreased in different degrees. Based on the symptoms of unilateral or bilateral PD, DAT distribution on the contralateral basal ganglia putamen decreased, whereas posterior putamen DAT distribution decreased more prominently. Conclusion 18F-FDG PET and 11C-CFT PET imaging dual joint inspection has a significant value in diagnosing and assessing the severity of PD. -
表 1 健康对照组与PD组尾状核及壳核的11C-CFT平均摄取值(x±s)
Table 1. The average intake of 11C-CFT values in healthy control group and PD group of caudate nucleus and putamen(x±s)
组别 例数 尾状核 壳核前部 壳核中部 壳核尾部 健康对照组 30 2.86±0.33 3.20±0.36 3.06±0.32 2.81±0.43 PD组 单侧症状
(患侧)27 2.01±0.36
(t=-18.07)1.97±0.34
(t=-19.65)1.54±0.35
(t=-16.59)1.30±0.27
(t=-17.63)单侧症状
(健侧)27 1.82±0.41
(t=-16.34)1.77±0.30
(t=-15.59)1.39±0.29
(t=-13.73)1.10±0.23
(t=-15.27)双侧症状 28 1.45±0.29
(t=-11.35)1.29±0.33
(t=-10.66)0.81±0.31
(t=-13.30)0.58±0.30
(t=-10.96)表中,PD:帕金森病;双侧症状帕金森病患者与健康对照组之间双侧基底节(左右两侧)的11C-CFT摄取值差异无统计学意义,P均>0.05。单侧症状帕金森病组与健康对照组之间的双侧基底节的11C-CFT摄取值差异有统计学意义,P均<0.05。 表 2 根据11C-CFT PET显像图像分级示各基底节区摄取值(x±s)
Table 2. The basal ganglia uptake values are shown depending on11C-CFTPET classification imagings(x±s)
PET分级 图像数 尾状核头 壳核前部 壳核中部 壳核后部 健康对照组 60 2.86±0.33 3.20±0.36 3.06±0.32 2.81±0.43 PD组 轻度 16 2.38±0.43(t=-9.67) 2.36±0.57(t=-10.25) 1.99±0.36(t=-14.71) 1.86±0.41(t=-12.76) 轻-中度 13 1.64±0.39(t=-6.85) 1.60±0.39(t=-11.32) 1.08±0.26(t=-17.78) 0.74±0.25(t=-18.81) 中度 31 1.68±0.46(t=-10.95) 1.55±0.43(t=-16.31) 1.00±0.27(t=-26.42) 0.67±0.20(t=-30.76) 中-重度 35 1.55±0.45(t=-13.15) 1.35±0.35(t=-21.30) 0.82±0.21(t=-32.10) 0.59±0.18(t=-32.63) 重度 15 1.13±0.37(t=-8.82) 0.97±0.41(t=-13.28) 0.60±0.29(t=-21.75) 0.46±0.25(t=-22.38) 注:表中,PD:帕金森病;表中图像数为双侧基底节区图像数。不同严重程度的帕金森患者图像组与健康对照组壳核11C-CFT摄取值之间的差异有统计学意义,P均 < 0.05。 -
[1] Jankovic J. Parkinson′s disease:clinical features and diagnosis[J]. J Neurol Neurosurg Psychiatry, 2008, 79(4): 368-376. DOI:10. 1136/jnnp. 2007. 131045. [2] Kassiou M, Banati R, Holsinger RM, et al. Challenges in molecular imaging of Parkinson′s disease:a brief overview[J]. Brain Res Bull, 2009, 78(2/3): 105-108. DOI:10. 1016/j. brainresbull. 2008. 08. 006. [3] Eckert T, Eidelberg D. Neuroimaging and therapeutics in movement disorders[J]. NeuroRx, 2005, 2(2): 361-371. DOI:10. 1602/neurorx. 2. 2. 361. [4] Huang T, Wang H, Tang G, et al. The influence of residualnor-β-CFT in 11C CFT injection on the Parkinson disease diagnosis:a 11C CFT PET study[J]. Clin Nucl Med, 2012, 37(8): 743-747. DOI:10. 1097/RLU. 0b013e31824c5fae. [5] Hughes AJ, Daniel SE, Kilford L, et al. Accuracy of clinical diagnosis of idiopathic Parkinson′s disease:a clinico-pathological study of 100 cases[J]. J Neurol Neurosurg Psychiatry, 1992, 55(3): 181-184. [6] 史新冲, 陈玲, 张祥松, 等.帕金森病的脑部葡萄糖代谢特征分析[J].中国神经精神疾病杂志, 2011, 37(9): 565-568. doi: 10.3969/j.issn.1002-0152.2011.09.013.ShiCX,ChenL,ZhangXS,etal.AnalysisofglucosemetabolisminthebrainofParkinson′sdisease[J].ChinJNervMentDis,2011,37(9):565-568
DOI:10. 3969/j. issn. 1002-0152. 2011. 09. 013.Shi CX, Chen L, Zhang XS, et al. Analysis of glucose metabolism in the brain of Parkinson′s disease[J]. Chin J Nerv Ment Dis, 2011, 37(9): 565-568.[7] Wichmann T, DeLong MR. Pathophysiology of Parkinson′s disease:the MPTP primate model of the human disorder[J]. Ann N Y Acad Sci, 2003, 991(1): 199-213. DOI:10. 1111/j. 1749-6632. 2003. tb07477. x. [8] Arahata Y, Kato T, Tadokoro M, et al. 18F-fluorodeoxyglucose positron emission tomography in Parkinson′s disease[J]. Nihon Rinsho, 1997, 55(1): 222-226. [9] 潘天虹.多巴胺及多巴胺转运蛋白与帕金森病[J].细胞生物学杂志, 2001, 23(3): 166-168. doi: 10.3969/j.issn.1674-7666.2001.03.010.PanTH.DopamineanddopaminetransporterandParkinson′sdisease[J].ChinJCellBio,2001,23(3):166-168
DOI:10. 3969/j. issn. 1674-7666. 2001. 03. 010.Pan TH. Dopamine and dopamine transporter and Parkinson′s disease[J]. Chin J Cell Bio, 2001, 23(3): 166-168.[10] tiasny-Kolster K, Doerr Y, Moller JC, et al. Combination of ′idiopathic′ REM sleep behaviour disorder and olfactory dysfunction as possible indicator for alpha-synucleinopathy demonstrated by dopamine transporter FP-CIT-SPECT[J]. Brain, 2005, 128(Pt 1):126-137. DOI:http://dx. doi. org/10. 1093/brain/awh322. [11] 王慧春, 左传涛, 黄喆慜, 等. 11C-CFT脑PET显像在早期帕金森病诊断中的临床应用[J].中国临床医学影像杂志, 2010, 21(4): 229-232. doi: 10.3969/j.issn.1008-1062.2010.04.001.
DOI:10. 3969/j. issn. 1008-1062. 2010. 04. 001.Wang HC, Zuo CT, Huang ZM, et al. Application of 11C-CFT PET ln the diagnosis of Parkinson′s disease with early-stage[J]. J Chin Clin Med Imaging, 2010, 21(4): 229-232.[12] 何婷婷, 王瑞民, 田嘉禾, 等.多巴胺转运蛋白PET成像诊断帕金森病[J].中国医学影像学杂志, 2008, 16(2): 94-97. doi: 10.3969/j.issn.1005-5185.2008.02.004.HeTT,WangRM,TianJH,etal.PETimagingofdopaminetransporter(DAT)inthediagnosisofparkinson′sdisease[J].ChinJMedImaging,2008,16(2):94-97
DOI:10. 3969/j. issn. 1005-5185. 2008. 02. 004.He TT, Wang RM, Tian JH, et al. PET imaging of dopamine transporter(DAT)in the diagnosis of parkinson′s disease[J]. Chin J Med Imaging, 2008, 16(2): 94-97.[13] Rinne JO, Ruottinen H, Bergman J, et al. Usefulness of a dopamine transporter PET ligand 18F beta-CFT in assessing disability in Parkinson′s disease[J]. J Neurol Neurosurg Psychiatry, 1999, 67(6): 737-741. DOI:10. 1136/jnnp. 67. 6. 737. [14] DOI:10. 3936/j. issn. 1002-0152. 2014. 08. 006.Xian WB, Shi XC, Zhang XS, et al. Application of 11C CFT dopamine transporter PET imaging in the diagnosis and severity assessment of Parkinson disease[J]. Chin J Nerv Ment Dis, 2014, 40(8): 474-478.
[15] Ishibashi K, Oda K, Ishiwata K, et al. Comparison of dopamine transporter decline in a patient with Parkinson′s disease and normal aging effect[J]. J Neurol Sci, 2014, 339(1/2): 207-209. DOI:10. 1016/j. jns. 2014. 01. 015. [16] Nurmi E, Bergman J, Eskola O, et al. Progression of dopaminergic hypofunction in striatal subregions in Parkinson′s disease using 18F CFT PET[J]. Synapse, 2003, 48(3): 109-115. DOI:10. 1002/syn. 10192. [17] 倪夏珺, 丁正同, 邬剑军, 等. 11C-β-CFT脑多巴胺转运体PET显像在帕金森病诊断中的应用[J].中国临床神经科学, 2009, 17(4): 371-376. doi: 10.3969/j.issn.1008-0678.2009.04.008.
DOI:10. 3969/j. issn. 1008-0678. 2009. 04. 008.Ni XJ, Ding ZT, Wu JJ. Application of 11C-β-CFT Dopamine Transporter PET Imaging in Diagnosing of Parkinson s Disease[J]. Chin J Clin Neurosci, 2009, 17(4): 371-376.[18] Kempster PA, Gibb WR, Stern GM, et al. Asymmetry of substaintianigra neuronal loss in arkinson′s disease and its relevance to the mechanism of levodopa related motor luctuations[J]. J Neurol Neumsurg Psychiatry, 1989, 52(1): 72-76. doi: 10.1136/jnnp.52.1.72 [19] Antonini A, Benti R, De Notaris R, et al. 123I-Ioflupane/SPECT binding to striatal dopamine transporter(DAT) uptake in patients with Parkinson′s disease, multiple system atrophy, and progressive supranuclear palsy[J]. Neurol Sci, 2003, 24(3): 149-150. DOI:10. 1007/s10072-003-0103-5. -






 下载:
下载: