-
BLM结合蛋白75(BLM-associated polypeptides 75,BLAP75)是一个相对分子质量为75×103的蛋白质,它在维持基因组稳定性方面具有非常重要的作用[1-2]。既往研究表明,BLAP75通过与RecQ家族DNA解螺旋酶BLM以及DNA拓扑异构酶TopoⅢα紧密结合,形成BLM-TopoⅢα-BLAP75(BTB)复合物直接参与DNA双链断裂(double-strand break,DSB)的同源重组修复(homologous recombination repair,HRR)过程[3-4],从而发挥维持基因组稳定性的作用。电离辐射(ionizing radiation,IR)对人体造成伤害的主要原因之一是引起DSB,HRR是真核细胞准确修复DSB的一个最主要的途径[5]。此外,IR诱导DNA损伤还会激起细胞中的DNA损伤反应,从而激活许多蛋白激酶、损伤效应分子以及DNA修复蛋白。由于已经发现BLM蛋白在IR诱导的DNA损伤修复中具有多重作用[6-7],因此,推测BLAP75很可能在IR诱导的DNA损伤修复中也有重要作用。本研究采用RNA干扰技术在细胞中沉默BLAP75基因来研究BLAP75究竟如何影响IR诱导DNA损伤修复。
-
人胚肾上皮293T细胞由本实验室保存,用含10%胎牛血清(FBS,美国Gibco公司)的DMEM培养基,在37 ℃、5%CO2的条件下培养。Trizol、培养基Opti-MEM® I Reduced Serum Medium和Lipofectamine RNAiMAX均购自美国Thermo Fisher Scientific公司;Quanti Tect反转录试剂盒购自德国Qiagen公司;SYBR Green预混合物购自瑞士Roche公司。BCA(bicinchoninic acid)蛋白定量试剂盒购自日本Takara公司;基因定点突变试剂盒QuickChange Site-Directed Mutagenesis Kit购自美国Stratagene公司;BLAP75抗体购自武汉三鹰Proteintech公司;磷酸化p53抗体、细胞周期检查点激酶2(checkpoint kinase 2,Chk2)抗体和磷酸化Chk2抗体均购自美国Cell Signaling Technology;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自北京康为世纪生物科技有限公司;辣根过氧化酶标记的二抗购自北京中杉金桥生物技术有限公司。细胞γ射线照射采用铯源137Cs(加拿大原子能公司,CAMMA-CELL40),剂量率为0.873 Gy/min。
-
本研究中使用的两种BLAP75 siRNA(BLAP75 siRNA1组和BLAP75 siRNA2组)由上海吉玛生物有限公司合成,其序列分别为5′-AGCCTTCACGAATGTTGAT-3′和5′-TCTAGTTACAGCTGAAGCA-3′。非特异的阴性对照Control siRNA也由上海吉玛生物有限公司提供,序列为5′-TTCTCCGAACGTGTCACGT-3′。转染试剂为Lipofectamine RNAiMAX,具体步骤如下:转染前1 d使用不含抗生素的培养基,将293T细胞接种到6孔板中,使细胞密度在转染时约达到40%。转染时,取50 pmol的siRNA用250 μl无血清无抗生素的Opti-MEM培养基稀释混匀,另取4 μl的Lipofectamine RNAiMAX也用250 μl同样的培养基稀释混匀,5 min后将以上两部分混合,室温孵育20 min,将全部500 μl混合物滴加入6孔板中,轻轻混匀,72 h后收集细胞。
-
收集并裂解转染了siRNA的293T细胞,提取总蛋白,用BCA蛋白定量试剂盒测总蛋白浓度。取30 μg总蛋白上样,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后,采用半干转移法将蛋白转移到聚偏二氟乙烯膜上,用含5%脱脂奶粉的封闭液室温封闭1 h,于4 ℃一抗孵育过夜,洗膜,室温孵育相应的二抗1 h,再次洗膜后采用增强化学发光法检测蛋白水平。
-
收集转染了siRNA的293T细胞,用Trizol提取细胞中的总RNA,然后用Quanti Tect反转录试剂盒将mRNA反转录成cDNA。使用SYBR Green预混合物,按说明书要求添加引物和模板,每个PCR反应的总体积为20 μl。qPCR反应程序:95 ℃10 min激活DNA聚合酶;95 ℃ 15 s,60 ℃ 30 s,共40个循环;溶解曲线程序为机器默认设置。qPCR反应中所用引物如下:
BLAP75引物:
(正向)5′-TGCTGCTGTTCCTCGTGGTAATAG-3′
(反向)5′-GATCAGTAAGGAGCCACTGCTCAA-3′
GAPDH引物:
(正向)5′-GGAAGGTGAAGGTCGGAGTC-3′
(反向)5′-GCTCCTGGAAGATGGTGATG-3′
-
将BLAP75 siRNA1或者阴性对照Control siRNA转染293T细胞72 h后,与未转染siRNA的293T细胞一起受4 Gy或10 Gy剂量照射,然后立即收集细胞,调整细胞浓度为5×105个/ml。取30 μl细胞悬液与70 μl 7.5%低熔点凝胶混匀后迅速铺在7.5%正常熔点凝胶上,在pH=10的碱性裂解液中裂解2.5 h,电泳液中解旋20 min,电泳20 min,在pH=7.5的中和液中中和20 min。2 μg/ml的溴化乙锭染色30 s后,于超纯水中漂洗后荧光显微镜下观察并拍摄不少于100个细胞。用彗星分析软件(CASP软件)分析细胞,包括尾部DNA百分比、尾矩和Olive尾矩。另外,将抵抗BLAP75 siRNA1的表达质粒转入已转染BLAP75 siRNA1的细胞中,48 h后进行同样条件的单细胞凝胶电泳实验,即BLAP75 siRNA1+ BLAP75组。
-
为了确保RNA干扰后的实验细胞表型是由沉默BLAP75所致,本研究还构建了抵抗BLAP75 siRNA1的BLAP75表达质粒,即用Quick Change Site-Directed Mutagenesis Kit将野生型BLAP75表达质粒进行定点突变,改变BLAP75 siRNA1靶序列中的4个核苷酸,该突变不会改变编码的氨基酸序列。DNA测序验证构建的新质粒序列。
-
数据采用SPSS13.0软件进行统计学处理,组间比较采用t检验,数据以均数±标准差($\bar x \pm s$)表示。P < 0.05表示差异有统计学意义。
-
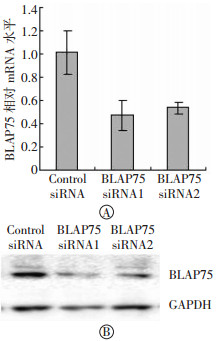
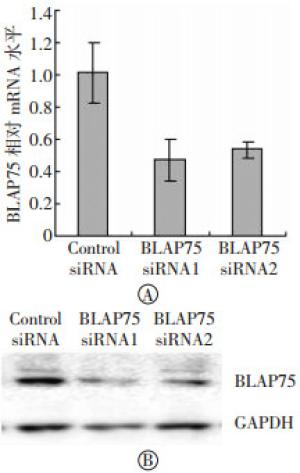
如图 1所示,在两种BLAP75 siRNA转染的细胞中BLAP75 mRNA水平都显著降低,同时Western blot检测显示BLAP75蛋白水平也随之降低,表明两种BLAP75 siRNA都能有效地沉默293T细胞中BLAP75基因的表达。
-
彗星图像如图 2所示,未照射组细胞均未显示出明显拖尾样彗星图像,而照射4 Gy和10 Gy的4组细胞都出现了明显的彗星拖尾现象,并且照射剂量越大彗星拖尾现象越明显,表明DNA损伤程度与IR存在剂量效应关系。通过CASP软件定量分析后,从表 1中可以看出4 Gy γ射线照射后,与未转染siRNA的293T细胞相比,转染BLAP75 siRNA1细胞的尾部DNA百分比、尾距和Olive尾距均显著增多(t=5.793,20.850,5.608,P均 < 0.05),并且在沉默BLAP75的该种细胞中重新表达野生型BLAP75之后接受照射,即BLAP75 siRNA1+BLAP75组细胞的尾部DNA百分比、尾距和Olive尾距又降回到正常293T细胞水平(t=0.957,0.352,0.814,P均 > 0.05);在10 Gy照射下也发生同样趋势的变化。转染阴性对照Control siRNA的细胞与未转染siRNA的293T细胞相比,各指标差异却无统计学意义。表明在细胞中沉默BLAP75基因会增加IR诱导DNA的损伤,而回补BLAP75能有效减少该类DNA损伤,提示BLAP75蛋白参与IR诱导DNA损伤修复。
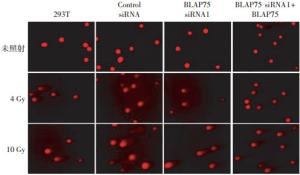
图 2 沉默BLAP75基因对电离辐射诱导DNA损伤的影响
Figure 2. Influences on the ionizing radiation-induced DNA damage after BLAP75 gene silence
组别 照射剂量/Gy 细胞数量/个 尾部DNA百分比/% 尾距 Olive尾距 293T 0 100 1.44±1.13 0.39±0.30 0.51±0.23 4 100 2.01±0.73 0.43±0.18 0.45±0.33 10 100 6.58±2.13 3.31±1.63 3.09±1.13 Control siRNA 0 100 0.90±0.42 0.18±0.10 0.70±0.25 4 100 2.39±0.17
(t=0.967)0.42±0.23
(t=0.355)0.47±0.33
(t=0.505)10 100 6.86±2.15
(t=0.757)3.29±2.73
(t=0.602)3.37±1.13
(t=0.302)BLAP75 siRNA1 0 100 1.36±0.74 0.19±0.09 0.28±0.13 4 100 6.58±2.13
(t=5.793)3.31±1.12
(t=20.850)3.09±2.08
(t=5.608)10 100 12.72±3.56
(t=12.060)9.07±2.03
(t=9.950)6.38±1.10
(t=4.392)BLAP75 siRNA1+BLAP75 0 100 1.08±0.45 0.20±0.08 0.72±0.22 4 100 2.20±0.78
(t=0.957)0.40±0.10
(t=0.352)0.38±0.03
(t=0.814)10 100 5.89±1.02
(t=0.773)2.97±0.98
(t=0.844)3.08±1.17
(t=0.682)注:表中,照射后Control siRNA细胞组、BLAP75 siRNA1+BLAP75细胞组与同等条件下未转染的293T细胞组进行比较,P均 > 0.05;BLAP75 siRNA1细胞组分别与同等条件下未转染的293T细胞组进行比较,P均 < 0.05。 表 1 沉默BLAP75基因对电离辐射诱导DNA损伤的量化
Table 1. Quantification of the ionizing radiation-induced DNA damage after BLAP75 gene silence
-
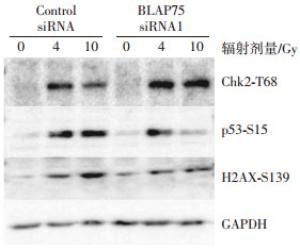
将转染了不同siRNA的293T细胞用4 Gy或10 Gy射线照射后1 h,使用Western blot法检测细胞内3个代表性DNA损伤检查点的特征性蛋白磷酸化,即Chk2激酶的第68位苏氨酸、p53的第15位丝氨酸和H2AX的第139位丝氨酸的磷酸化情况。从图 3可见,IR照射后,阴性对照组(Control siRNA)细胞中Chk2的第68位苏氨酸被磷酸化,在沉默BLAP75基因的细胞中也是照射后此位点被磷酸化,并且磷酸化程度比Control siRNA组细胞增高;而p53的第15位丝氨酸的磷酸化变化则相反,尤其是在10 Gy照射后,在沉默BLAP75的细胞中的磷酸化程度比Control siRNA组细胞降低;H2AX的第139位丝氨酸的磷酸化也在10 Gy照射后有同样的变化,而与前两者不同的是,在未照射的沉默BLAP75细胞中该位点磷酸化程度明显高于对照细胞。这些特征性位点磷酸化的差异表明,BLAP75会影响IR引起的DNA损伤反应。
-
IR诱导的DNA损伤类型以DSB为主,且DSB是最严重的DNA损伤形式之一,其主要通过非同源末端连接或者同源重组两条途径来修复[8]。由于BLAP75与BLM和TopoⅢα结合形成BLM-TopoⅢα-BLAP75(BTB)复合物,在HRR DSB过程中,具有催化BLM和TopoⅢα酶活性,从而促进HRR高效完成的重要作用[3],所以BLAP75很可能在IR诱导的DNA损伤修复中发挥作用。本研究通过特异性的siRNA沉默293T细胞中BLAP75基因的表达,采用灵敏的单细胞凝胶电泳技术定量细胞的DNA损伤程度,发现沉默BLAP75的细胞在受到同样剂量γ射线照射后DNA损伤程度明显高于未转染siRNA的293T细胞和Control siRNA组细胞,而且在沉默BLAP75的细胞中重新表达抗siRNA的BLAP75能有效拯救此实验表型,表明在受到IR时BLAP75对DNA有重要的保护作用,或者具有快速修复受损DNA的作用。
细胞受到照射后DNA损伤反应是一个复杂的过程,DSB能启动多种信号通路,涉及的损伤识别因子主要有磷脂酰肌醇3-激酶:毛细血管扩张性共济失调症突变(ataxia telangiectasia-mutated,ATM)蛋白及ATM和Rad3相关蛋白(ATM and Rad3-related,ATR)等,它们将损伤信号传导到下游靶蛋白,最终导致细胞周期阻滞、DNA损伤修复或诱导细胞凋亡。因此,本研究还探索了可能在辐射损伤反应中与BLAP75相关的信号通路。IR诱导的DSB通常会激活ATM-Chk2信号通路[9],所以,我们采用Chk2特异的磷酸化抗体检测Chk2上第68位苏氨酸的磷酸化程度,发现在细胞缺失BLAP75时,IR诱导Chk2的磷酸化程度比对照细胞增强,提示有BLAP75缺陷的细胞DNA修复能力可能下降,以致于积累了许多无法被修复的DNA损伤,导致更多的Chk2被激活。正常状态下p53蛋白水平很低,因为受到其特异性的负反馈调节因子鼠双微基因2(murine double,MDM2)的调节,MDM2是一种泛素化E3连接酶,它可直接与p53蛋白结合来促进p53蛋白的泛素化降解。当细胞中的DNA受到损伤时,p53蛋白被磷酸化,阻碍了MDM2的结合从而避免被降解,进而启动DNA修复机制,使损伤的DNA得以修复。因此,本研究也检测了p53蛋白的第15位丝氨酸的磷酸化程度,出人意料的是在沉默BLAP75的细胞中,IR导致的p53磷酸化程度却比对照细胞弱,暗示缺少BLAP75时可能也会引起p53的变化。另外,H2AX第139位丝氨酸磷酸化形成的γ-H2AX是DNA损伤的标志物,研究发现沉默BLAP75后即使未受到射线照射的细胞中γ-H2AX的水平也较高,分析原因可能是缺失BLAP75导致不能有效修复内源性的DNA损伤,造成DNA损伤的累积。
综上所述,本研究结果表明,BLAP75在IR诱导的DNA损伤反应中具有降低DNA损伤程度的重要生物学功能,提示BLAP75在辐射损伤修复中具有重要作用,具体的作用机制需进一步深入研究。
沉默BLAP75基因对电离辐射诱导DNA损伤的影响
Effects of silencing BLAP75 on DNA damage induced by ionizing radiation
-
摘要:
目的 研究BLM结合蛋白75(BLAP75)在电离辐射诱导DNA损伤反应中的生物学效应。 方法 运用RNA干扰技术,在细胞中特异性沉默BLAP75基因,然后通过单细胞凝胶电泳技术来研究电离辐射诱导DNA损伤程度的变化,并且通过再次表达BLAP75来拯救沉默BLAP75所致的实验表型,以及应用Western blot方法研究DNA损伤反应中的磷酸化修饰。 结果 与未转染的293T对照组细胞相比,电离辐射在沉默了BLAP75基因的细胞中会诱导更多的DNA断裂,并且在此细胞中重新表达BLAP75则能降低DNA断裂数量至对照组细胞水平;γ射线照射后,细胞周期检查点激酶2(Chk2)的磷酸化程度比阴性对照组细胞增强。 结论 BLAP75能减少电离辐射诱导的DNA损伤,在电离辐射损伤修复中可能具有重要作用。 Abstract:Objective To study the biological effects of BLM-associated protein 75(BLAP75) in ionizing radiation(IR) induced DNA damage response(DDR). Methods BLAP75 was silenced in cells by RNA interference. Single-cell gel electrophoresis was performed to quantify the DNA breaks. Also siRNA-resistant BLAP75 was expressed in BLAP75-silenced cells to rescue the phenotype. Western blot was used to examine the DDR phosphorylation upon IR. Results IR induced more DNA breaks in BLAP75-silenced cells than in 293T control cells without siRNA transfection. After expression of BLAP75 in BLAP75-silenced cells, IR induced DNA breaks were similar to 293T control cells. In response to IR, the phosphorylation level of Chk2 was higher in the BLAP75-silenced cells than in the control cells. Conclusion BLAP75 alleviates IR-induced DNA damage and possibly plays an important role in IR-induced damage response and repair. -
Key words:
- Gene silencing /
- BLAP75 /
- Radiation, ionizing /
- RNA interference
-
表 1 沉默BLAP75基因对电离辐射诱导DNA损伤的量化
Table 1. Quantification of the ionizing radiation-induced DNA damage after BLAP75 gene silence
组别 照射剂量/Gy 细胞数量/个 尾部DNA百分比/% 尾距 Olive尾距 293T 0 100 1.44±1.13 0.39±0.30 0.51±0.23 4 100 2.01±0.73 0.43±0.18 0.45±0.33 10 100 6.58±2.13 3.31±1.63 3.09±1.13 Control siRNA 0 100 0.90±0.42 0.18±0.10 0.70±0.25 4 100 2.39±0.17
(t=0.967)0.42±0.23
(t=0.355)0.47±0.33
(t=0.505)10 100 6.86±2.15
(t=0.757)3.29±2.73
(t=0.602)3.37±1.13
(t=0.302)BLAP75 siRNA1 0 100 1.36±0.74 0.19±0.09 0.28±0.13 4 100 6.58±2.13
(t=5.793)3.31±1.12
(t=20.850)3.09±2.08
(t=5.608)10 100 12.72±3.56
(t=12.060)9.07±2.03
(t=9.950)6.38±1.10
(t=4.392)BLAP75 siRNA1+BLAP75 0 100 1.08±0.45 0.20±0.08 0.72±0.22 4 100 2.20±0.78
(t=0.957)0.40±0.10
(t=0.352)0.38±0.03
(t=0.814)10 100 5.89±1.02
(t=0.773)2.97±0.98
(t=0.844)3.08±1.17
(t=0.682)注:表中,照射后Control siRNA细胞组、BLAP75 siRNA1+BLAP75细胞组与同等条件下未转染的293T细胞组进行比较,P均 > 0.05;BLAP75 siRNA1细胞组分别与同等条件下未转染的293T细胞组进行比较,P均 < 0.05。 -
[1] Yin J, Sobeck A, Xu C, et al. BLAP75, an essential component of Bloom′s syndrome protein complexes that maintain genome integrity[J]. EMBO J, 2005, 24(7):1465-1476. DOI:10. 1038/sj.emboj. 7600622. [2] Daley JM, Chiba T, Xue X, et al. Multifaceted role of the Topo Ⅲα-RMI1-RMI2 complex and DNA2 in the BLM-dependent pathway of DNA break end resection[J]. Nucleic Acids Res, 2014, 42(17):11083-11091. DOI:10. 1093/nar/gku803. [3] Wu L, Bachrati CZ, Ou J, et al. BLAP75/RMI1 promotes the BLM-dependent dissolution of homologous recombination intermediates[J]. Proc Natl Acad Sci USA, 2006, 103(11):4068-4073. DOI:10. 1073/pnas. 0508295103. [4] Wang J, Chen J, Gong Z. TopBP1 controls BLM protein level to maintain genome stability[J]. Mol Cell, 2013, 52(5):667-678. DOI:10. 1016/j.molcel. 2013. 10. 012. [5] Mladenov E, Magin S, Soni A, et al. DNA double-strand break repair as determinant of cellular radiosensitivity to killing and target in radiation therapy[J]. Front Oncol, 2013, 3: 113. DOI: 10.3389/fonc.2013.00113. [6] Rad B, Forget AL, Baskin RJ, et al. Single-molecule visualization of RecQ helicase reveals DNA melting, nucleation, and assembly are required for processive DNA unwinding[J/OL]. Proc Natl Acad Sci USA, 2015, 112(50): E6852-E6861[2016-07-01]. http://www.pnas.org/content/112/50/E6852.longDOI: 10.1073/pnas.1518028112. [7] El Ghamrasni S, Cardoso R, Halaby MJ, et al. Cooperation of Blm and Mus81 in development, fertility, genomic integrity and cancer suppression[J]. Oncogene, 2015, 34(14):1780-1789. DOI:10. 1038/onc. 2014. 121. [8] Li X, Heyer WD. Homologous recombination in DNA repair and DNA damage tolerance[J]. Cell Res, 2008, 18(1):99-113. DOI:10. 1038/cr. 2008. 1. [9] 徐畅, 王彦, 杜利清, 等. shRNA干扰沉默Net1基因对电离辐射损伤反应的影响[J].国际放射医学核医学杂志, 2013, 37(3):135-138. DOI:10.3760/cma.j.lssn.1673-4114.2013.03.002.
Xu C, Wang Y, Du LQ, et al. The effects of short hairpin RNA-mediatied silencing Net1 on ioning radiation-induced damage responses[J]. Int J Radiat Med Nucl Med, 2013, 37(3):135-138. doi: 10.3760/cma.j.lssn.1673-4114.2013.03.002 -





 下载:
下载: