-
恶性肿瘤放化疗后继发全血细胞减少的病例在临床工作中并不少见,而甲状腺癌131I治疗后合并骨髓增生异常综合征(myelodysplastic syndrome,MDS)的病例却十分罕见,查阅国内外文献均无相关报道,现将我院收治的1例甲状腺癌131I治疗后合并MDS的病例报道如下。
-
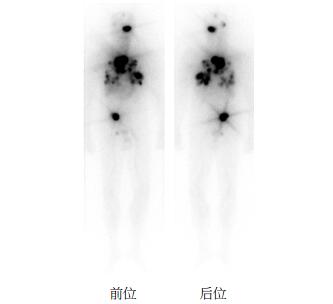
患者男性,57岁,因“甲状腺癌术后5次大剂量131I治疗后2年余,发现三系(RBC、WBC、血小板)减少2周”于2015年3月6日入院。患者20年前因无明显诱因出现甲状腺肿大,1995年于当地医院行“甲状腺肿物切除术”,病理确诊为甲状腺癌,术后反复咳嗽;2005年行肺部CT发现甲状腺癌肺转移,行“甲状腺全切术”,术中病理确诊为甲状腺乳头状癌,术后行131I治疗2次,剂量为5550 MBq,并进行常规TSH抑制治疗;此后定期复查肺部CT,未发现肿瘤进展和复发。2011年7月出现嘴角歪斜,伴左耳听力进行性下降,行头颅MRI示“左侧颅底岩骨嵴、右枕骨占位”,考虑骨转移瘤,并脑膜刺激改变,同时行131I全身扫描示“右侧枕骨、纵隔、双肺、肝内、右髋骨存在摄碘功能的转移灶”,考虑甲状腺癌多处骨转移,于我院行131I治疗,自2011年至2013年12月,于我院共行131I治疗5次,每次剂量均约为7400 MBq[1-2],每次131I治疗前均进行血常规检查,未见异常。2014年1月26日口服7400 MBq 131I(成都中核高通同位素股份有限公司)后行131I全身扫描,示颈前未见明显甲状腺组织残留,颅骨、淋巴结、纵隔、双肺、腹部及骨盆可见多发转移灶(图 1)。131I治疗期间予以口服左甲状腺激素抑制治疗,同时行右侧髋骨局部放疗,放疗共计10次,总剂量为50 Gy[3]。此次入院前3月余(2014年12月)无明显诱因出现活动后气促,无胸闷、头晕、头痛、晕厥、心悸、端坐呼吸和夜间呼吸困难,无发热、咳血、胸痛、腹痛、血便等不适。休息后气促可缓解,但症状反复,于2015年2月23日查血常规示三系减少,WBC为1.12×109个/L,RBC为1.29×1012个/L,血小板数为74×109个/L,血红蛋白含量为39 g/L;胸部CT示双肺多发转移瘤,纵隔内淋巴结转移,左侧胸第六肋肋骨骨质改变,提示骨转移瘤,但需与骨软骨瘤鉴别,右下胸腔积液。2015年3月6日至7日,分别以左髂前上棘、左髂后上棘为穿刺点,行骨髓活检,结果提示骨髓增生减低,发现少量幼稚细胞,原始或幼稚有核细胞占3%,考虑继发性MDS可能(图 2),但未进一步行基因突变检查[4]。诊断:①甲状腺癌;②甲状腺癌骨转移;③继发性MDS。治疗:①予以输入红细胞4次,共计5单位,并予以促进血细胞生长、提升免疫力、营养心肌和改善循环对症治疗;②予以鲨肝醇、维生素B4等治疗白细胞减少症;③予以口服庆大霉素片、氟康唑胶囊预防感染。2015年3月13日患者一般状况尚可,骨髓病理结果示骨髓明显增生活跃,造血细胞约占85%,三系均可见增生,遂予办理出院,于当地医院治疗甲状腺癌。转诊当地医院后,查骨髓细胞染色体示10个细胞中有8个细胞7号染色体缺失,其中6个细胞5号染色体长臂亦缺失(图 3),考虑为MDS的发病原因,继续予以输血等对症治疗。
-
甲状腺癌是临床上最常见的头颈部和内分泌系统恶性肿瘤之一,在中青年女性中发病率较高[1]。目前手术仍是甲状腺癌的首选治疗方法,术后对于残存的甲状腺组织、局部淋巴结或远处转移灶应行131I治疗[5-6]。
MDS是一组具有异质性的后天性克隆性疾患,其基本病变是克隆性造血干、祖细胞发育异常,导致无效造血以及恶性转化危险性增高;表现为骨髓中各系造血细胞数量增多或正常,伴有明显发育异常的形态改变,外周血中各系血细胞明显减少;其演变为急性髓系白血病的危险性很高[7-9]。
本例患者在甲状腺癌术后3年时间内共接受7次131I治疗,近两年内接受5次131I治疗,平均每次剂量约为7400 MBq,近期发现MDS,目前就患者骨髓细胞染色体异常讨论,患者是嵌合型的(-5,-7),这是MDS最常见的一种染色体变异[10],但是为何患者会出现染色体突变?这与大剂量多次131I治疗、骨转移的放疗是否有关?查阅文献得知,1993年已有研究者调查了46 988例甲状腺功能亢进或甲状腺癌患者,其中甲状腺癌802例,131I治疗平均剂量为4532 MBq,随访2年,2例患非慢性淋巴细胞白血病(标化发病比为1.22,95%CI 0.15~4.41),与对照组相比,接受131I治疗并没有增加MDS的风险[11]。分析其原因:131I大部分被甲状腺摄取,其他器官组织吸收较少,而且131I的半衰期长(8 d),其治疗剂量相对安全,因此不会增加MDS的患病率。2012年《中国甲状腺结节和分化型甲状腺癌指南》指出,131I属于相对安全的治疗方法[12],迄今为止,尚无法通过前瞻性临床研究确定131I治疗剂量的上限(包括单次剂量和累计剂量)。但回顾性统计分析提示,随着131I治疗次数的增加和剂量的加大,辐射不良反应的风险也会增高,较常见的不良反应包括慢性唾液腺损失、龋齿、鼻泪管阻塞或胃肠道反应等[13-14],131I治疗罕见引起骨髓抑制、肾功能异常,可通过治疗前后监测血常规和肾功能及时发现。
综上所述,对于接受131I清甲或者清灶治疗的甲状腺癌患者,尤其是多次接受131I治疗的患者,在131I治疗前后应定期复查血常规,注意造血功能的改变等,对发生MDS的患者应及时治疗。
甲状腺癌131I治疗后合并骨髓增生异常综合征一例
-
-
-
[1] Blumhardt R, Wolin EA, Phillips WT, et al.Current controversies in the initial post-surgical radioactive iodine therapy for thyroid cancer:a narrative review[J].EndocrRelat Cancer, 2014, 21(6):R473-R484.DOI:10.1530/ERC-14-0286. [2] 胡莹莹, 蒋宁一.131I治疗分化型甲状腺癌的现状和进展[J].国际放射医学核医学杂志, 2006, 30(6):343-346.DOI:10.3760/cma.j.issn.1673-4114.2006.06.007.
Hu YY, Jiang NY.Radiodione treatment of differentiated thyroid cancer:current status and future prospects[J].Int J Radiat Med Nucl Med, 2006, 30(6):343-346. doi: 10.3760/cma.j.issn.1673-4114.2006.06.007[3] Zhang WD, Liu DR, Feng CC, et al.Management of differentiated thyroid carcinoma with bone metastasis:a case report and review of the Chinese literature[J].J Zhejiang Univ Sci B, 2014, 15(12):1081-1087.DOI:10.1631/jzus.B1400124. [4] 张之南, 沈悌.血液病诊断及疗效标准[M].3版.北京: 科学出版社, 2007: 157.
Zhang ZN, Shen D.The diagnostic and therapeutic effect of hemopathy[M].3th ed.Beijing:Science Press, 2007:157.[5] 王卓颖, 吴毅.分化型甲状腺癌的诊治指南解读[J].外科理论与实践, 2014, 19(3):185-188.DOI:10.3969/j.issn.1007-9610.2014.03.001.
Wang ZY, Wu Y.Interpretation of the Guide to the diagnosis and treatment of differentiated thyroid cancer[J].J Surg Concepts Pract, 2014, 19(3):185-188. doi: 10.3969/j.issn.1007-9610.2014.03.001[6] 张桂芝, 谭建, 刘雪辉, 等.131I治疗分化型甲状腺癌术后患者疗效影响因素研究[J].中华核医学杂志, 2010, 30(4):259-263.DOI:10.3760/cma.j.issn.0253-9780.2010.04.011.
Zhang GZ, Tan J, Liu XH, et al.Influential factors on the effectiveness of 131I treatment on post-surgical differentiated thyroid cancer patients[J].Chin J Nucl Med, 2010, 30(4):259-263. doi: 10.3760/cma.j.issn.0253-9780.2010.04.011[7] 程辉, 余丹, 周静, 等.58例继发性骨髓增生异常综合征临床分析[C]//第八届全国中西医结合血液病学术会议论文集, 武汉, 2007: 126-129.
Cheng H, Yu D, Zhou J, et al.The clinical analysis of 58 cases with secondary myelodysplastic syndrome[C]//Proceedings of the eighth national academic conference on blood disease with traditional Chinese and Western medicine, Wuhan, 2007: 126-129.[8] 何广胜.骨髓增生异常综合征研究进展[J].中国实用内科杂志, 2014, 34(7):684-688.DOI:10.7504/nk2014060303.
He GS.Research progress of myelodysplastic syndrome[J].Chin J Pract Intern Med, 2014, 34(7):684-688. doi: 10.7504/nk2014060303[9] 张朝霞, 王天有.骨髓增生异常综合征相关基因研究进展[J].中国小儿血液与肿瘤杂志, 2011, 16(2):89-92.DOI:10.3969/j.issn.1673-5323.2011.02.012.
Zhang CX, Wang TY.The research progress of myelodysplastic syndrome related genes[J].J China Pediatr Blood Cancer, 2011, 16(2):89-92. doi: 10.3969/j.issn.1673-5323.2011.02.012[10] 安利, 江明.114例骨髓增生异常综合征的染色体核型与预后分析[J].中山大学学报:医学科学版, 2014, 35(4):575-578.
An L, Jiang M.Karyotype and prognosis analysis of 114 cases of myelodysplastic syndrome[J].J SUN Yat-sen Univ(Med Sci), 2014, 35(4):575-578.[11] Hall P, Boice JD Jr, Berg G, et al.Leukaemia incidence after iodine-131 exposure[J].Lancet, 1992, 340(8810):1-4. [12] Zhu RS, Yu YL, Lu HK, et al.Clinincal study of 312 cases with metastatic differentiated thyroid cancer treated with large doses of 131I[J].Chin Med J(Engl), 2005, 118(5):425-428. [13] Walter MA, Turtschi CP, Schindler C, et al.The dental safety profile of high-dose radioiodine therapy for thyroid cancer:long-term results of a longitudinal cohort study[J].J Nucl Med, 2007, 48(10):1620-1625.DOI:10.2967/jnumed.107.042192. [14] Kloos RT, Duvuuri V, Jhiang SM, et al.Nasolacrimal drainage system obstruction from radioactive iodine therapy for thyroid carcinoma[J].J Clin Endocrinol Metab, 2002, 87(12):5817-5820.DOI:http://dx.doi.org/10.1210/jc.2002-020210. -






 下载:
下载: