-
耐辐射菌属(Deinococcus)是已发现的最耐辐射的微生物,是众所周知的能够耐受多重压力的球菌或杆状非孢子菌,其高效的DNA损伤修复的能力是已知的其他细菌无法比拟的[1]。耐辐射奇球菌(Deinococcus radiodurans,DR)是由美国科学家Anderson等[2]于1956年在经X射线灭菌后仍然变质的牛肉罐头中首次发现的,其对电离辐射、紫外辐照、干燥以及其他造成DNA双链断裂的理化因素均具备超乎寻常的抵抗能力[3-4]。研究发现,pprI基因(pleiotropic gene promoting DNA repair)的功能是作为一个辐射响应调控的总开关[5],而pprM基因可能是依赖于pprI基因的一个调节子,并证实pprM基因缺陷菌株表现出对电离辐射较高的敏感性[6]。通过对PprM蛋白进一步的生物信息学分析发现,该蛋白既含有RNA结合结构域,又拥有冷休克DNA结合域(cold-shock DNA-binding domain)。PprM蛋白同时拥有RNA和DNA结合的特性在已知的DR蛋白中是非常罕见的,提示该蛋白在DR辐射抗性方面可能起着重要的调控作用。但目前有关pprM基因功能的研究尚少,具体的调控途径仍不清楚。
本研究拟在前期构建的pprM基因敲除株的基础上,利用PCR方法在pprM基因的C末端携带HA(流感病毒血凝素)标签,并连接到pRADK质粒上,再转化到pprM基因敲除株中,得到pprM基因敲除回补株,为后期研究与PprM蛋白相互作用的靶DNA筛选奠定良好的基础。
-
Deinococcus radiodurans R1(编号:CGMCC 1.633)由南华大学公共卫生学院核辐射DNA损伤与修复实验室传代并保存,购自中国普通微生物菌种保藏中心;pprM基因缺失株、大肠杆菌DH5α由南华大学公共卫生学院核辐射DNA损伤与修复实验室保存;pRADK质粒由浙江大学农业与生物技术学院华跃进教授馈赠。
-
限制性内切酶NdeⅠ、T4 DNA连接酶购自美国Fermentas公司;Pfx高保真DNA聚合酶购自美国Invitrogen公司;质粒提取试剂盒、PCR试剂盒、DNA Marker、抗HA标签兔多克隆抗体购自北京康为世纪生物科技有限公司;考马斯亮蓝蛋白测定试剂盒购自上海碧云天生物技术有限公司;凝胶回收试剂盒购自美国Omega公司;引物合成、基因测序由苏州金唯智生物技术有限公司完成。
-
以无突变的pGEX-6p-1-pprM载体作为模板,设计并合成带HA标签的引物对,序列为P1:5′-GGGTATAC(NdeⅠ酶切位点)GTGTGCCGAGTTTC-3′;P2:5′-CTCATATG(NdeⅠ酶切位点)GGCGTAGTCGGGCACGTCGTAGGGGTA(HA标签序列)-CCAGCGGTCGTCGGG-3′。采用Pfx高保真DNA聚合酶进行PCR扩增,反应体系见表 1。扩增条件如下:94℃ 2 min;94℃ 45 s、59℃ 30 s、72℃ 90 s,共30个循环;72℃延伸10 min。
反应成分 体积(μl) 10×Pfx buffer 5.0 10×PCRx buffer 2.5 MgSO4(50 mmol/L) 1.0 dNTP(10 mmol/L) 1.0 P1(10 mmol/L) 1.5 P2(10 mmol/L) 1.5 pGEX-6p-1-pprM载体 2.0 Pfx高保真DNA聚合酶 1.0 ddH2O 34.5 总体积 50 表 1 PCR扩增的反应体系
Table 1. PCR reaction system
PCR扩增产物经琼脂糖凝胶电泳后进行切胶回收,按普通琼脂糖凝胶DNA回收试剂盒中的说明进行回收和纯化。将获得的PCR产物送往苏州金唯智生物技术有限公司进行测序。提取质粒载体pRADK。将PCR产物与pRADK质粒用NdeⅠ酶切,酶切体系:PCR产物或pRADK质粒25 μl,10×buffer R 5 μl,NdeⅠ 2 μl,加ddH2O至50 μl。酶切条件:37℃,水浴酶切3 h。将载体与目的片段的单酶切产物进行连接,连接体系:T4 DNA连接酶1 μl,10×Ligation Buffer 1 μl,pRADK质粒1 μl,HA-pprM 4 μl,加ddH2O至10 μl。连接条件:16℃,过夜连接。取5 μl的连接产物转化至大肠杆菌DH5α感受态细胞中,于含30 μg/ml卡那霉素的LB平板上筛选。挑取平板上的单克隆菌落接种到5 ml含30 μg/ml卡那霉素的LB培养基中,于37℃过夜摇培,再提取质粒,质粒经NdeⅠ酶切验证,阳性克隆子送苏州金唯智生物技术有限公司测序。
-
DR新鲜感受态细胞的制备和转化采用改良的CaCl2法[7],简要操作步骤如下:挑取DR单菌落,接种于TGY液体培养基中,30℃振荡培养过夜以活化菌种;第2天取适量菌液转接于10 ml新鲜TGY(tryptone-glucose-yeast)液体培养基中,培养至OD值约0.8,然后分装到1.5 ml离心管中,每管1 ml,4℃,3500×g离心5 min收集菌体;加入1 ml无菌CaCl2溶液(配方:2×TGY培养基、50 mmol/L CaCl2溶液),4℃,3500×g离心5 min收集菌体,并重复一次。加入0.5 ml无菌CaCl2溶液,30℃振荡培养90 min;取出离心管至冰上冷却2 min,然后加入需要转化的质粒10 μl,轻轻混匀后于冰上静置45 min;将离心管中的菌液转移至5 ml TGY液体培养基中,30℃振荡培养18 h;取100 μl菌液涂布于含30 μg/ml卡那霉素的营养肉汁固体培养基上。
挑取阳性克隆至5 ml含30 μg/ml卡那霉素的TGY液体培养基中,30℃振荡培养约20 h。采用生物辐照仪(中国核动力研究设计院设备制造厂)予以2 kGy辐照,收集细菌。加入5 ml新鲜TGY液体培养基,30℃振荡培养约2 h。将菌液置于冰上用美国Sonics超声波细胞破碎仪破碎,超声10 s,间歇10 s,共超声30次,超声输出振幅15%。13 000×g离心10 min,吸取上清用于Western blot检测。
-
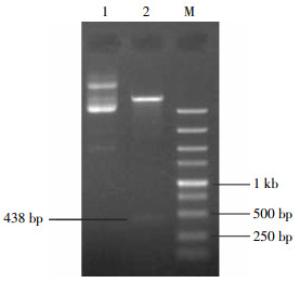
利用上述1.3节中的方法进行PCR扩增,获得携带有NdeⅠ酶切位点的HA-pprM目的片段,用1.0%的琼脂糖凝胶电泳鉴定,在250 bp与500 bp之间有一条非常明显的条带,约为438 bp(图 1)。与预期大小相符。
-
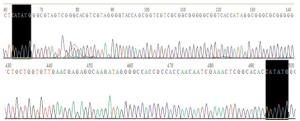
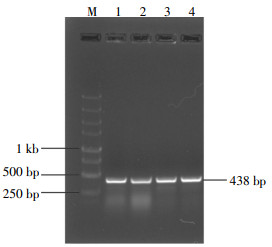
将重组质粒pRADK-HA-pprM进行NdeI单酶切,得到约438 bp的目的条带,如图 2所示。将酶切鉴定成功的质粒送往苏州金唯智生物技术有限公司进行测序分析,结果如图 3所示,所测得的序列通过Blast比对分析,结果表明HA-pprM片段插入位点正确,没有造成任何突变。
-
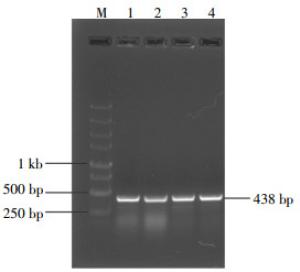
超声裂解转化成功的回补株菌体,提取总蛋白,并进行Western blot检测,结果得到相对分子质量约为13 000的蛋白质条带,与预期大小一致(图 4)。
-
高剂量的电离辐射会导致基因组产生大量的DNA断裂片段,其中,DNA双链断裂被认为是最致命的伤害,尽管其发生率显著低于单链断裂和DNA碱基损伤。若电离辐射只损伤DNA的一条链(如单链断裂或DNA碱基损伤),可以使用未损坏的互补链作为模板进行修复,但若是双链断裂则很难找到模板进行无突变修复,因为DNA的两条链都不是完整的。然而基因组的完整性决定了细胞的存活状态,因此大多数研究的热点便是辐照期间损伤DNA的修复[8-9]。DR高效的DNA损伤修复能力可以重新精确组装损伤的DNA片段成完整的分子,参与DNA损伤修复途径的基因有很多,如RecA重组酶[10](在诱导DNA双链断裂的修复中起核心作用)、PprA[11-12](促进DNA修复多效性功能蛋白)、PprI[5, 13](耐辐射全局调控蛋白)、DdrO[14-15](辐射干燥响应调节蛋白)等。pprM基因是随着对pprI基因的深入研究而发现的辐射响应相关基因,对这个新基因目前了解甚少,初步研究表明,pprM基因缺陷菌株对电离辐射较敏感[6],且将pprM基因转入大肠杆菌能提高其抗盐碱、耐干旱的能力[16]。
PprM作为一种冷激蛋白,在辐射诱导下高表达,其不可能单独发挥作用。研究虽已证明PprM是一种PprI依赖性DNA损伤应答的调节器,但很有可能还有其他因子发挥着直接或间接的调控作用。DR辐射调控网络一直是科研工作者们研究的热点,Lu等[17]对pprI基因进行染色质免疫沉淀技术分析,发现PprI蛋白能特异性结合pprA和recA等DNA修复基因的启动子,而且在电离辐射诱导下,结合活性得到加强。进一步通过基因芯片研究发现,PprI可与DR_0905、DR_0906序列结合并上调其表达。生物信息学分析发现,gyrB(DR_0906)位于pprM(DR_0907)的上游,与gyrA同属于DNA解旋酶基因。研究表明PprA除了促进DNA修复外,还能与DNA解旋酶、拓扑异构酶DraTopoIB协同作用,促进超螺旋DNA的松弛,共同维持DR基因组的完整性[12, 18]。进一步对PprA相互作用的蛋白进行预测表明其与DNA解旋酶、PprI、RecA、DdrA等蛋白的关系非常密切[19]。启动子预测分析发现,pprM的启动子可能位于DR_0905、DR_0906序列位置之间,与DR_0906拥有共同的启动子。已有相关文献证明,pprM缺陷菌株中PprA的含量增加,辐照处理后与野生型菌株的PprA含量相同,说明PprM可能抑制pprA的表达,但经辐照后又可以去抑制[6]。笔者对PprM的DNA结合特性进行深入的生物信息学分析发现:①PprM可能结合PprA的启动子,通过调控PprA的表达,参与到DNA修复的多种途径中。②PprM可能结合DR_0906的启动子并调控其表达。故笔者可以大胆推测,PprI能够与pprA启动子结合并调控该基因的辐射抗性,同时PprM能够调控gyrB的表达,并与PprA、GyrA、DraTopoIB等协同作用以维持基因组的稳定。
本研究旨在筛选与PprM相互作用的靶DNA,鉴于PprM蛋白目前尚没有商业化的单克隆抗体,故设计并构建了带HA标签的pprM基因回补株,为后期实施染色质免疫沉淀技术奠定了扎实的基础。笔者所在课题组一直致力于pprM基因的深入研究,已完成筛选与PprM相互作用的靶RNA、酵母双杂交筛选与PprM相互作用的蛋白等研究(数据尚未发表);本研究利用染色质免疫沉淀技术筛选与PprM相互作用的靶DNA,在辐射响应基因pprM调控网络的全面研究中迈进了重要一步。
耐辐射奇球菌pprM基因回补株的构建与鉴定
Construction and identification of pprM-complemented Deinococcus radiodurans strain
-
摘要:
目的 构建耐辐射奇球菌pprM基因缺失回补菌株, 为进一步研究PprM蛋白的功能奠定实验基础。 方法 设计并合成HA-pprM基因(HA为流感病毒血凝素)全长的引物, 以无突变的pGEX-6p-1-pprM载体为模板, PCR扩增出携带NdeⅠ酶切位点的HA-pprM基因全长, 经NdeⅠ酶切后, 与pRADK载体连接并转化大肠杆菌, 经培养、提取质粒及纯化后, 采用酶切鉴定以及基因测序方法确认插入序列的正确性; 采用CaCl2法将构建好的重组质粒pRADK-HA-pprM转化到耐辐射奇球菌pprM基因缺失的菌株中, 通过Western blot验证HA-PprM融合蛋白的表达。 结果 构建的重组质粒pRADK-HA-pprM经NdeⅠ酶切鉴定结果符合目的条带大小(438 bp), 测序结果显示插入的寡核苷酸序列及方向与预期的一致, Western blot结果显示HA-PprM融合蛋白的相对分子质量约为13000。 结论 笔者成功构建了重组质粒pRADK-HA-pprM, 为进一步研究与PprM蛋白相互作用的靶DNA的筛选奠定了良好的基础。 Abstract:Objective To investigate the function of PprM protein by constructing a pprM-complemented strain of Deinococcus radiodurans. Methods HA-pprM gene was amplified by PCR from the plasmid DNA of pGEX-6p-1-pprM(approximately 438 bp) and then inserted into the shuttle expression vector pRADK to construct pRADK-HA-pprM. The correctness of the inserted sequences was confirmed through agarose gel electrophoresis, restriction enzyme digestion, and gene sequencing. The recombinant plasmid was transformed into the pprM mutant strain of Deinococcus radiodurans, and the recombinant protein was analyzed by Western blot. Results The recombinant plasmid pRADK-HA-pprM and a complemented strain were obtained. The recombinant protein can be highly expressed in the complemented strain. Conclusion This study provided a foundation for further studies on the interaction between the PprM protein and its target DNA. -
Key words:
- Deinococcus /
- pprM gene /
- Complemented strain construction
-
表 1 PCR扩增的反应体系
Table 1. PCR reaction system
反应成分 体积(μl) 10×Pfx buffer 5.0 10×PCRx buffer 2.5 MgSO4(50 mmol/L) 1.0 dNTP(10 mmol/L) 1.0 P1(10 mmol/L) 1.5 P2(10 mmol/L) 1.5 pGEX-6p-1-pprM载体 2.0 Pfx高保真DNA聚合酶 1.0 ddH2O 34.5 总体积 50 -
[1] Gerber E, Bernard R, Castang S, et al. Deinococcus as new chassis for industrial biotechnology:biology, physiology and tools[J]. J Appl Microbiol, 2015, 119(1):1-10. DOI:10.1111/jam. 12808. [2] Anderson AW, Nordon HC, Cain RF, et al. Studies on a radioresistant Micrococcus. I. Isolation, morphology, cultural characteristics, and resistance to gamma radiation[J]. Food Technol, 1956, 10(1):575-578. [3] Slade D, Radman M. Oxidative stress resistance in Deinococcus radiodurans[J]. Microbiol Mol Biol Rev, 2011, 75(1):133-191. DOI:10.1128/MMBR.00015-10. [4] Cox MM, Battista JR. Deinococcus radiodurans-the consummate survivor[J]. Nat Rev Microbiol, 2005, 3(11):882-892. DOI:10.1038/nrmicro1264. [5] Lu H, Gao G, Xu G, et al. Deinococcus radiodurans PprI switches on DNA damage response and cellular survival networks after radiation damage[J]. Mol Cell Proteomics, 2009, 8(3):481-494. DOI:10.1074/mcp.M800123-MCP200. [6] Ohba H, Satoh K, Sghaier H, et al. Identification of PprM:a modulator of the PprI-dependent DNA damage response in Deinococcus radiodurans[J]. Extremophiles, 2009, 13(3):471-479. DOI:10.1007/s00792-009-0232-8. [7] Meima R, Rothfuss HM, Gewin L, et al. Promoter cloning in the radioresistant bacterium Deinococcus radiodurans[J]. J Bacteriol, 2001, 183(10):3169-3175. DOI:10.1128/JB.183.10.3169-3175.2001. [8] Holliday R. Early studies on recombination and DNA repair in Ustilago maydis[J]. DNA Repair(Amst), 2004, 3(6):671-682. DOI:10.1016/j.dnarep.2004.02.002. [9] Daly MJ. A new perspective on radiation resistance based on Deinococcus radiodurans[J]. Nat Rev Microbiol, 2009, 7(3):237-245. DOI:10.1038/nrmicro2073. [10] Ngo KV, Molzberger ET, Chitteni-Pattu S, et al. Regulation of deinococcus radiodurans RecA protein function via modulation of active and inactive nucleoprotein filament states[J]. J Biol Chem, 2013, 288(29):21351-21366. DOI:10.1074/jbc.M113.459230. [11] Narumi I, Satoh K, Cui S, et al. PprA:a novel protein from Deinococcus radiodurans that stimulates DNA ligation[J]. Mol Microbiol, 2004, 54(1):278-285. DOI:10.1111/j.1365-2958.2004.04272.x. [12] Kota S, Charaka VK, Ringgaard S, et al. PprA contributes to Deinococcus radiodurans resistance to nalidixic acid, genome maintenance after DNA damage and interacts with deinococcal topoisomerases[J/OL]. PLoS One, 2014, 9(1): e85288[2016-02-16]. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0085288. DOI: 10.1371/journal.pone.0085288. [13] Hua Y, Narumi I, Gao G, et al. PprI:a general Switch responsible for extreme radioresistance of Deinococcus radiodurans[J]. Biochem Biophys Res Commun, 2003, 306(2):354-360. [14] Devigne A, Ithurbide S, Bouthier De La Tour C, et al. DdrO is an essential protein that regulates the radiation desiccation response and the apoptotic-like cell death in the radioresistant Deinococcus radiodurans bacterium[J]. Mol Microbiol, 2015, 96(5):1069-1084. DOI:10.1111/mmi.12991. [15] Wang Y, Xu Q, Lu H, et al. Protease activity of PprI facilitates DNA damage response: Mn2+-dependence and substrate sequence-specificity of the proteolytic reaction[J/OL]. PLoS One, 2015, 10(3): e0122071[2016-02-16]. http://journals.plos.org/plosone/article?id=10.1371/journal.pone.0122071. DOI: 10.1371/journal.pone.0122071. [16] 王玮, 宋素琴, 张志东, 等.耐辐射异球菌pprM基因克隆及功能预测[J].新疆农业科学, 2012, 49(8):1449-1455. DOI:10.6048/j.issn.1001-4330.2012.08.012.
Wang W, Song SQ, Zhang ZD, et al. Gene cloning of deinococcus radiodurans pprM and its function prediction[J]. Xinjiang Agric Sci, 2012, 49(8):1449-1455. doi: 10.6048/j.issn.1001-4330.2012.08.012[17] Lu H, Chen H, Xu G, et al. DNA binding is essential for PprI function in response to radiation damage in Deinococcus radiodurans[J]. DNA Repair(Amst), 2012, 11(2):139-145. DOI:10.1016/j.dnarep.2011.10.013. [18] Kota S, Rajpurohit YS, Charaka VK, et al. DNA gyrase of deinococcus radiodurans is characterized as type Ⅱ bacterial topoisomerase and its activity is differentially regulated by PprA in vitro[J]. Extremophiles, 2016, 20(2):195-205. DOI:10.1007/s00792-016-0814-1. [19] 范美婷, 马云, 何淑雅.耐辐射奇球菌中多效蛋白PprA功能的研究进展[J].国际放射医学核医学杂志, 2015, 39(2):149-153.
Fang MT, Ma Y, He SY. Research progress and prediction on pleiotropic protein PprA from Deinococcus radiodurans[J]. Int J Radiat Med Nucl Med, 2015, 39(2):149-153. -





 下载:
下载: