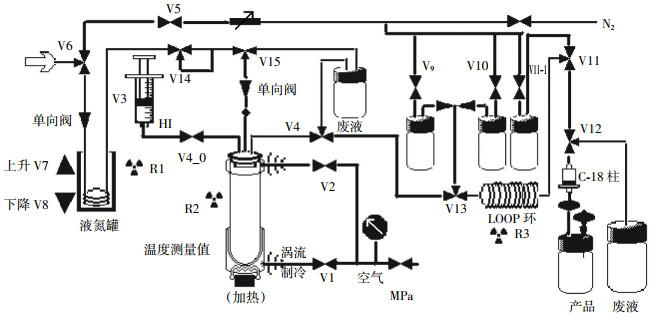
-
11C-蛋氨酸(11C-methionine,11C-MET)是肿瘤氨基酸代谢显像剂,在脑胶质瘤的良恶性、疗效评价、治疗后残留或复发的鉴别诊断中有着重要意义[1-2],在临床诊断多发性骨髓瘤、多灶性白质脑病、肢端肥大症等方面也有着独特优势[3-6]。目前,临床研究中所用的11C-MET的制备方法主要是C-18柱固相合成法和液相合成法[7-8],固相合成法反应面积小,11C-CH3I不能与前体充分反应,合成效率受到影响;液相合成法的合成时间长,放化产率低。Gómez等[9]使用LOOP环法合成11C-MET,其操作过程复杂,合成效率低;张政伟等[10]使用LOOP环法合成11C-MET,自制LOOP环管径较大,管壁产品残留多,产品产量较低,合成效率不高。本研究对国产11C-多功能合成模块进行了改进,寻求在国产模块上以LOOP环法合成合格的11C-MET,实验中使用的聚四氟乙烯LOOP环(1 mm×0.5 mm×2 m),管径较小,表面积大,反应充分,管壁产品残留少,取得了较好的效果,并与C-18柱固相合成法进行了比较,固相合成法参见文献[11]。
-
自动化11C多功能合成模块(PET-CM-3H-IT-I)购自派特(北京)科技有限公司;HM-20加速器购自日本住友重机械株式会社;Endosafe-PTS细菌内毒素快速检测仪购自USA Charles River公司;AB104G分析天平购自Switzerland Mettler Toledo公司;CRC-15R型活度计购自USA Capintec公司;分析型高效液相色谱(high performance liquid chromatography,HPLC)仪、Sep-Pak C-18柱购自美国Waters公司;无菌滤膜购自Merck Millipore公司。
-
L-高胱氨酸硫内酯购自北京百灵威科技有限公司;57%HI和LiAlH4四氢呋喃溶液(1 mol/L)购自美国Sigma Aldrich公司;AR级磷酸二氢钠、氢氧化钠、无水乙醇购自国药集团化学试剂有限公司;0.9%生理盐水购自青岛华仁药业公司;灭菌注射用水购自石家庄四药有限公司;HPLC级乙腈、丙酮购自美国TEDIA有限公司。
-
液相法制备11C-CH3I:HM-20加速器经14N(P,α)11C核反应在加速器内产生11CO2,氮气作为载气将11CO2传送到11C-多功能合成模块,传送完毕,开启自动化程序,11CO2被N2载至反应管与0.2 ml LiAlH4四氢呋喃溶液(l mo1/L)反应,加热并通入N2除去四氢呋喃,再加入0.3 ml 57%HI,生成的11C-CH3I通入到LOOP环与前体反应[12]。
-
将在线生成的11C-CH3I通入至含有L-高胱氨酸硫内酯的NaOH乙醇溶液,废气排入尾气收集囊。反应结束后用NaH2PO4溶液将LOOP环内反应液经C-18纯化柱和无菌滤膜淋洗至收集瓶,11C-MET自动化合成系统图见图 1。
-
反应保持11C-MET的前体量为3 mg,溶解到不同碱当量的NaOH溶液中,溶解1 min后再加入100 μl乙醇,室温下通入至在线合成的11C-CH3I中反应,比较反应结果,寻求合适的碱当量。
-
在3 mg的11C-MET前体量和100 μl的2 mol/L NaOH溶液中分别加入丙酮、乙腈、丙酮:乙腈(1:1)和乙醇各100 μl作为反应溶剂,室温反应,比较不同溶剂的反应效率,寻求较为理想的反应溶剂。
-
取11C-MET不同前体量(0.5~4 mg)溶于10.0 eq(化学当量)新鲜配制的NaOH溶液(2 mol/L)中,溶解静置1 min后再加入100 μl乙醇混合均匀,分别与11C-CH3I在室温下反应,比较不同前体量对合成效率的影响。
-
检查产品外观,精密pH试纸测试产品pH值,使用Endosafe-PTS细菌内毒素快速检测仪检测产品的细菌内毒素,HPLC仪检测产品有机溶剂残留,通过HPLC测量产品放化纯度和比活度:分析产品11C-MET的分析柱为反相Nova-Park C-18柱(150 mm×3.9 mm),流动相为NaH2PO4溶液(pH=2.5,10 mmol/L),流速1 ml/min;用放射性活度计测定产品放射性活度,化学量按天平称量的前体量换算成产物量进行计算,估算产品放射性比活度。本研究对产品质量控制一般重复3次,抽检的产品量为3批,改变条件进行合成时需重新抽检3批产品。
-
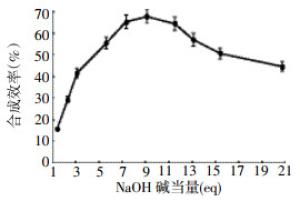
11C-MET在不同碱量下的合成效率见图 2(n=3,未校正效率):NaOH碱量相对于前体摩尔量5.6~11.5 eq,合成效率稳定,为55%~68%。碱当量3.1 eq的合成效率为41.53%,碱当量逐渐减小,合成效率不断下降;碱当量 > 11.5 eq,随碱量增加,合成效率迅速下降;碱当量20.7 eq的合成效率为44.57%,产品放射化学纯度78.36%,见图 3(峰1是产品;峰2为副产物)。
-
本研究分析了正电子药物常用反应溶剂,合成效率结果见表 1。乙腈、丙酮等溶剂中的反应效率均低于乙醇,可见NaOH的乙醇溶液更适合LOOP环法合成11C-MET。
溶剂 11C-蛋氨酸合成效率(n=3,未校正效率) 丙酮 (35.96±2.06)% 乙腈 (28.24±2.10)% 丙酮:乙腈(1:1) (31.47±1.63)% 乙醇 (64.74±0.60)% 表 1 不同溶剂对11C-蛋氨酸合成的影响
Table 1. Effect of solvent on the 11C-methionine synthesis
-
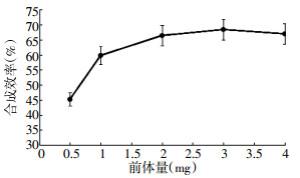
不同量的11C-MET前体药分别与在线合成的11C-CH3I反应,其合成效率见图 4。11C-MET前体量为1~3 mg的合成效率均超过60%,降低前体量至0.5 mg时合成效率为45.20%;如果前体量较大(> 3 mg),产品的合成效率并没有太大的提高。
-
优化11C-MET自动化合成条件为:2~3 mg 11C-MET前体溶于100 μl新鲜配制的NaOH(2 mol/L)溶液中,再加入100 μl乙醇,将混合液装于自动合成器的LOOP环内,通入在线转化的11C-CH3I,待LOOP环处放射性不再升高停止通气,室温静置反应;打开V9、V12,用5 ml NaH2PO4溶液(0.3 mmol/L)经C-18纯化柱和无菌滤膜淋洗至收集瓶。11C-CO2传至LOOP环后,开启自动合成程序,从11C-CO2到取代反应、纯化至终产品,总计用时为11 min。产品的外观、pH值、HPLC检测放化纯、细菌内毒素检测、气相色谱仪检测溶剂残留等质量控制结果均符合静脉注射要求,并与C-18柱固相法进行比较,结果见表 2。
项目 C-18柱固相合成法 LOOP环法 欧洲药典8.0 外观 无色澄明 无色澄明 无色澄明 pH值 6.5~7.0 6.5~7.0 4.5~8.5 放化纯 >95% >97% >95% 乙腈残留 < 0.3 mg/ml < 0.2 mg/ml < 0.41 mg/ml 丙酮残留 < 1 mg/ml < 0.6 mg/ml < 5 mg/ml 乙醇含量 < 4.3 mg/ml < 4.1mg/ml < 5 mg/ml 细菌内毒素 < 4 Eu/ml < 4 Eu/ml < 175/V IU/ml 表 2 11C-蛋氨酸的质控结果(n=4)
Table 2. Result of quality control of 11C-methionine(n=4)
-
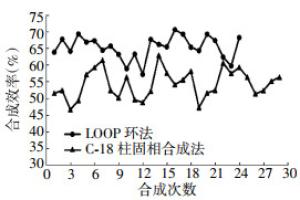
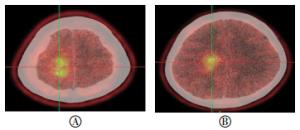
本研究优化了11C-MET的LOOP环法合成条件, 并与常用的C-18柱固相合成法进行了比较, 其合成效率明显提高, 见图 5。国产11C多功能模块经LOOP环法合成11C-MET与C-18柱固相合成法相比较, 合成效率、产量、最大产量、制备用时分别为:(65.31±4.32)%、54.3±3.41)%(n1=24, n2=29, CH3I未校正效率); (6.61±1.38) GBq、(3.83±0.77) GBq; 9.03 GBq、5.38 GBq; 11 min、12 min; 比活度分别不低于(3.32±0.62) TBq/g和(1.93±0.39) TBq/g。LOOP环法与C-18柱固相法合成的11C-MET在临床应用中进行了比较, 由图 6可知两种合成11C-MET的图像质量并无太大差别, 均可应用于临床研究。
-
本研究中,NaOH溶液与L-高胱氨酸硫内酯发生开环反应,生成中间体11C-4-巯基丁氨酸盐,再与11C-CH3I发生取代反应,碱性环境中的中间体比较稳定,中性或弱酸环境中会发生逆化反应。NaOH量较大,中间体可能与11C-CH3I发生酯化反应生成副产品11C-4-巯基丁氨酸甲酯;同时碱量过大,调节产品pH值需要更多缓冲溶液,增加产品无机盐的含量。实验表明,碱量增加导致L-高胱氨酸硫内酯更容易发生开环反应,碱量在5.6~11.5 eq,合成效率稳定在55%~68%,产品放化纯度>95%,放射性比活度不低于(3.32±0.62)TBq/g,副产品含量较低;碱量<3.1 eq时,合成效率较低,碱量>11.5 eq时,副反应比例逐渐增加。前体L-高胱氨酸硫内酯与NaOH的乙醇溶液发生开环反应,再与11C-CH3I发生亲核取代,小极性溶剂可降低电荷集中的亲核试剂溶剂化,有利于亲核取代反应,提高反应效率。丙酮、乙腈是较为合适的反应溶剂,但由于其本身易挥发,在LOOP环法或C-18柱固相合成法中易造成较大的放射性损失,产品放化纯度较高,但合成效率大大降低。本研究认为丙酮、乙腈不适合LOOP环法或C-18柱固相合成法,合成11C-MET时应选用乙醇为反应溶剂。本研究的反应为亲核取代反应,合成效率与前体浓度呈正相关,提高前体浓度可提升合成效率;但前体量过大会造成化学纯度降低,同时浪费了前体。为了保证合成效率、控制产品中前体含量,同时降低合成成本,本研究认为使用2~3 mg的11C-MET前体为宜。
国内外关于11C-MET制备方面研究的问题,主要在质量控制、制备时间及合成效率等方面[8-11]。本研究采用自动化模块经LOOP环法合成放射性药物11C-MET,在制备过程中,LOOP环可以重复、多次使用,同时减少了Sep-Pak C-18柱的使用量,降低生产药物合成成本;LOOP环法制备11C-MET可以提高合成效率,大大增加了产品的产量;LOOP环法还可应用于制备11C-乙酸盐、11C-胆碱和11C-carfentanil等药物,扩展了国产11C多功能模块的使用范围;每次在使用LOOP环之前要求仔细清洗LOOP环,以免造成合成效率的降低。近年来,微流控法制备药物成为一个兴起的研究热点[13-14],此方法制备放射性药物具有放射损失较少、合成效率高、合成耗时少等优点,为放射性药物的制备指引了一个新的研究方向。
本研究采用LOOP环法合成11C-MET,优化了11C-MET的合成条件,并与C-18柱固相合成法进行了比较。制备放射性药物11C-MET的操作过程并不复杂,提高合成效率,增加产品产率,降低合成成本成为制备简单药物所追求的目标,LOOP环法制备11C-MET是一种值得推广的合成方法。
国产模块LOOP环改良法合成11C-蛋氨酸
Synthesis of 11C-methionine on home-made module by the improved LOOP method
-
摘要:
目的 用国产11C-多功能合成模块经LOOP环法合成放射性药物11C-蛋氨酸(11C-MET), 与C-18柱固相法合成11C-蛋氨酸进行比较。 方法 对国产模块LOOP环法制备11C-MET的合成工艺进行探讨, 研究碱当量、溶剂效应及前体量等影响因素。 结果 LOOP环法制备11C-MET优化后的合成条件:前体量2~3 mg溶于NaOH溶液(2 mol/L), 碱当量5.6~11.5 eq, 加入乙醇100 μl, 室温反应。此条件下11C-MET的合成效率为(65.31±4.32)%(n=24, 11C-CH3I未校正效率), 产品的放化纯度>95%, 产量为(6.61±1.38) GBq。 结论 LOOP环法提高了11C-MET合成效率, LOOP环可以多次重复利用, 降低了生产成本, 提高了合成产量, 实现了稳定、全自动化合成11C-MET, 且产品能满足临床需求。 -
关键词:
- 正电子发射断层显像术 /
- 甲硫氨酸 /
- 碳放射性同位素 /
- LOOP环法 /
- 全自动化合成
Abstract:Objective The synthesis of radiopharmaceutical 11C-methionine(11C-MET) by LOOP and C-18 on-column method on home-made 11C-multifunction synthesis module was compared. Method The synthesis conditions of 11C-MET with home-made synthesis module by LOOP method was studied, which included the alkali equivalent, solvents and the amount of precursor. Results The optimum condition was 2-3 mg of precursor in NaOH solution(2 mol/L), alkali equivalent(5.6-11.5 eq) and ethanol(100 μL), and at room temperature for synthesis of 11C-MET. It could be got with radiochemical yield of (65.31±4.32)%(n=24, end of synthesis of 11C-CH3I). The radiochemical purity of 11C-MET was higher than 95% and the production radioactivity was (6.61±1.38) GBq(n=24). Conclusions By the method of LOOP, it showed that the production efficiency was increased, the output was increased and production cost of synthetic was reduced. The synthetic process was reliable and full automatic, and the product synthesized by this process was suitable for clinical use. -
Key words:
- Positron-emission tomography /
- Methionine /
- Carbon radioisotope /
- LOOP method /
- Full automated synthesis
-
表 1 不同溶剂对11C-蛋氨酸合成的影响
Table 1. Effect of solvent on the 11C-methionine synthesis
溶剂 11C-蛋氨酸合成效率(n=3,未校正效率) 丙酮 (35.96±2.06)% 乙腈 (28.24±2.10)% 丙酮:乙腈(1:1) (31.47±1.63)% 乙醇 (64.74±0.60)% 表 2 11C-蛋氨酸的质控结果(n=4)
Table 2. Result of quality control of 11C-methionine(n=4)
项目 C-18柱固相合成法 LOOP环法 欧洲药典8.0 外观 无色澄明 无色澄明 无色澄明 pH值 6.5~7.0 6.5~7.0 4.5~8.5 放化纯 >95% >97% >95% 乙腈残留 < 0.3 mg/ml < 0.2 mg/ml < 0.41 mg/ml 丙酮残留 < 1 mg/ml < 0.6 mg/ml < 5 mg/ml 乙醇含量 < 4.3 mg/ml < 4.1mg/ml < 5 mg/ml 细菌内毒素 < 4 Eu/ml < 4 Eu/ml < 175/V IU/ml -
[1] D'Souza MM, Sharma R, Jaimini A, et al. 11C-MET PET/CT and advanced MRI in the evaluation of tumor recurrence in high-grade gliomas[J]. Clin Nucl Med, 2014, 39(9):791-798. DOI:10.1097/RLU. 0000000000000532. [2] Navarria P, Reggiori G, Pessina FA, et al. Investigation on the role of integrated PET/MRI for target volume definition and radiotherapy planning in patients with high grade glioma[J]. Radiother Oncol, 2014, 112(3):425-429. DOI:10.1016/j.radonc. 2014. 09. 004. [3] Kobayashi M, Yamashita K, Takaori-Kondo A. Clinical value of 18F-FDG-PET and 11C-MET-PET in patients with plasma cell malignancy[J]. Nihon Rinsho, 2015, 73(1):74-79. [4] Lückerath K, Lapa C, Albert C, et al. 11C-Methionine-PET:a novel and sensitive tool for monitoring of early response to treatment in multiple myeloma[J]. Oncotarget, 2015, 6(10):8418-8429. DOI:10.18632/oncotarget. 3053. [5] Shirai S, Yabe I, Kano T, et al. Usefulness of 11C-methionine-positron emission tomography for the diagnosis of progressive multifocal leukoencephalopathy[J]. J Neurol, 2014, 261(12):2314-2318. DOI:10.1007/s00415-014-7500-y. [6] Rodriguez-Barcelo S, Gutierrez-Cardo A, Dominguez-Paez M, et al. Clinical usefulness of coregistered 11C-methionine positron emission tomography/3-T magnetic resonance imaging at the follow-up of acromegaly[J]. World Neurosurg, 2014, 82(3/4):468-473. DOI:10.1016/j.wneu. 2013. 11. 011. [7] Cheung MK, Ho CL. A simple, versatile, low-cost and remotely operated apparatus for[11C] acetate, [11C]choline, [11C]methionine and[11C]PIB synthesis.[J]. Appl Radiat Isot, 2009, 67(4):581-589. DOI:10.1016/j.apradiso. 2008. 08. 018. [8] Pascali C, Bogni A, Iwata R, et al. High efficiency preparation of L-[S-methyl-11C] methionine by on-column[11C] methylation on C18 Sep-Pak[J]. J Labelled Compd Radiopharm, 1999, 42:715-724. doi: 10.1002/(SICI)1099-1344(199908)42:8<715::AID-JLCR224>3.0.CO;2-3 [9] Gómez V, Gispert JD, Amador V, et al. New method for routine production of L-[methyl-11C] methionine:in loop synthesis[J]. J Label Compd Radiopharm, 2008, 51(1):83-86. DOI:10.1002/jlcr. 1483. [10] 张政伟, 薛方平, 刘平, 等.国产11C多功能模块在11C标记药物中的应用研究[J].中国医疗设备, 2009, 24(8):5-7, 16. DOI:10.3969/j.issn.1674-1633.2009.08.002.
Zhang ZW, Xue FP, Liu P, et al. The application of the homemade 11C-module in the 11C labeling radiopharmaceuticals[J]. J Press China Med Devices, 2009, 24(8):5-7, 16. doi: 10.3969/j.issn.1674-1633.2009.08.002[11] 张晓军, 李云刚, 刘健, 等. L-[S-11C-甲基]-蛋氨酸的合成及HPL分析[J].同位素, 2014, 27(4):236-240. DOI:10. 7538/tws. 2014. 27. 04. 0236.
Zhang XJ, Li YG, Liu J, et al. Preparation and HPLC analysis of L-[s-methyl-11C]methionine[J]. J Isotopes, 2014, 27(4):236-240. doi: 10.7538/tws.2014.27.04.0236[12] 张锦明, 田嘉禾, 王武尚, 等.单管法自动化合成11C-碘代甲烷[J].中华核医学杂志, 2004, 24(4):243-244. DOI:10.3760/cma.j.issn. 2095-2848.2004.04.019.
Zhang JM, Tian JH, Wang WS, et al. An automated synthesis of 11C-methyl iodide with singlevessel[J]. Chin J Nucl Med, 2004, 24(4):243-244. doi: 10.3760/cma.j.issn.2095-2848.2004.04.019[13] Kundu S, Bhangale AS, Wallace WE, et al. Continuous flow enzyme-catalyzed polymerization in a microreactor[J]. J Am Chem Soc, 2011, 133(15):6006-6011. DOI:10.1021/ja111346c. [14] 金杰, 董玲, 张克华, 等.微流控合成研究进展[J].有机化学, 2012, 32(1):201-209. DOI:10. 6023/cioc1105131.
Jin J, Dong L, Zhang KH, et al. Recent advances in microfluidic synthesis[J]. Chin J Org Chem, 2012, 32(1):201-209. doi: 10.6023/cioc1105131 -





 下载:
下载: