-
近年来正电子显像剂的发展日新月异,形成了以18F-FDG为主体,其他不同核素标记的多种显像原理的正电子显像剂作为辅助的全方位多角度显像的格局,大大提高了肿瘤相关疾病诊断的灵敏度和准确率。11C-乙酸盐(11C-acetate,11C-ACE)作为18F-FDG PET/CT显像有益补充的正电子显像剂,具有经济、半衰期短、某些特定部位本底低易发现病灶、与18F-FDG联合使用可增加检出率等优点[1]。18F-FDG联合11C-ACE的PET/CT显像应用在肝细胞肝癌与腺瘤、局灶性结节样增生、巨大再生结节和纤维板型肝细胞癌之间的鉴别诊断结果令人满意,在肝脏高分化肿瘤的诊断中具有较高的准确率[2-3]。18F-FDG联合11C-ACE也常用于肝细胞癌介入诊疗如肝动脉灌注化疗栓塞的治疗效果监测。因此,11C-ACE在肿瘤临床诊断应用上越来越受到人们的重视。但因其放化合成影响因素较多、产率不稳定等因素没有广泛地使用。近年来,无论是进口的还是国产的合成器在功能上都有了显著的提高,改进后的合成器可以快速地全自动地合成多种放射性显像剂[4-6]。然而,为了稳定地生产常规的放射性显像剂,这些合成模块被设计成专用的或者在设计上采用了标准的放射化学合成技术。如果要进行非标准的放射化学反应则需要对合成模块进行繁琐地改造,甚至是重构。笔者利用GE MINItrace QILIN并改造了Tracerlab FXC实现了稳定地自动化合成11C-ACE,并进行了临床应用前的质量控制和产率影响因素分析,现报道如下。
-
试剂:3.0 mol/L溴化甲基镁的四氢呋喃溶液、无水四氢呋喃(美国Adrich公司);NaOH、冰乙酸、柠檬酸、柠檬酸钠(分析纯,国药集团化学试剂北京有限公司);乙酸钠(> 99.5%,美国Sigma-Aldrich公司);生理盐水注射液、注射用水(德国ABX Advanced Biochemical Compounds公司)。
仪器设备:回旋加速器(MINItrace QILIN,美国GE公司);合成器(Tracerlab FXC,美国GE公司),软件界面见图 1;PS-H+、PS-Ag+、PS-OH-Sep-Paks柱(德国MACHEREY-NAGEL);QMA柱(美国Waters公司);无菌滤膜(Mellex-GS,美国Millipore公司);硅胶板(Gel60F254,天津化学试剂厂);活度检测器(CRC-25R,美国Capintec公司);放射性高效薄层扫描仪(B-MS-1000,美国BioScan公司);高效液相色谱仪(426型泵)、紫外检测器(UVIS-201,美国Alltech公司);C18柱:150 mm×4.60 mm,5 μm(Luna SCX,美国Phenomenex公司);分析天平(CP214,美国Ohaus公司)。
-
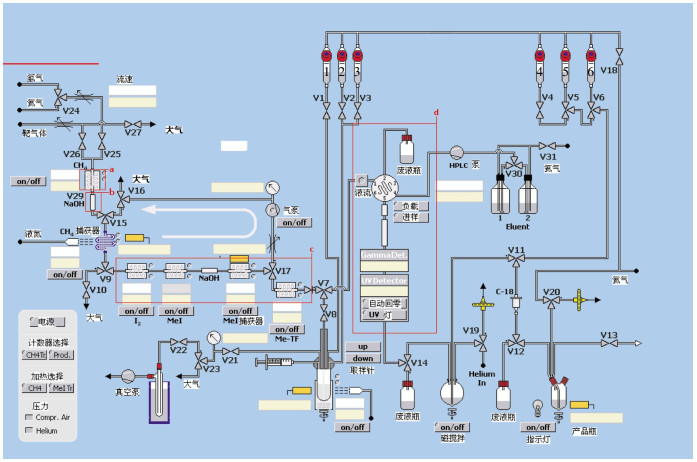
Tracerlab FXC为一台合成11C标记药物的多功能合成器,可以将加速器产生的11C-CO2转化为11C标记的放射性显像剂注射液。该合成器包含气相生产碘甲烷系统、反应瓶系统、在线色谱系统和分离纯化系统。而合成11C-ACE的合成器应由冷捕获系统、反应瓶系统和分离纯化系统组成。因此,将Tracerlab FXC合成器根据合成11C-ACE的要求进行改造和连接,使之成为合成11C-ACE的专用合成器。Tracerlab FXC改造后如图 2所示。
-
原加速器在轰击完成后可将活性11C-CO2直接传入合成器,现加装一个分子筛和一个三通阀(3V),如图 2(加速器室),改为分步传输。11C-CO2被传递并被捕获在分子筛柱上,在分子筛柱与V26之间装有一个三通阀并可外部控制开关。当三通阀被切换至合成器方向,打开V26并加热分子筛至350℃~380℃,11C-CO2气体就会被释放并传递至CH4捕获器。这样做可以提高Me捕获器对11C-CO2的捕获效率。
-
原采用加热镍粉柱至400℃来减少其对11C-CO2的吸收作用,但并不短接(图 1中a),现用管线将镍粉柱短接。这样可以去除镍粉柱对11C-CO2的吸附进而提高11C-ACE的产率。
-
将V29与V15间的氢氧化钠吸水柱短接(图 1中b),使加速器传输过来的11C-CO2直接进入冷却捕获器,避免吸收。将V9与V7间的I2炉、MeI炉、MeI捕获器、Me-TF短接(图 1中c),使冷却捕获器与反应瓶直接相连,去除中间不参加反应的装置。
-
将V7与圆底烧瓶连接,使反应容器中的产品在猝灭后可以直接转入稀释圆底烧瓶,将装置的色谱分离改为固相分离(图 1中d),可节省分离纯化时间,减少因衰变带来的产率损失。
-
在圆底烧瓶和V11之间加入Luer Lock适配器,接入PS-H+和PS-Ag+ Sep-Paks柱(图 2中e),使稀释后的产物经过PS-H+和PS-Ag+ Sep-Paks柱预处理之后进入分离纯化系统。在V11与V12之间装一个PS-OH-Sep-Paks柱用于吸附产品。改为固相分离后可大大节省分离纯化时间。
-
在反应容器上加装一个格氏试剂注入装置,可通过外部阀门(进样阀)控制开关,以便于在活性物质到达前可以向反应容器中加入溴化甲基镁(图 2中f),当打开阀门时氮气压力可将对空气敏感的格氏试剂加入反应容器中。这个装置可以在氮气正压力下向反应容器中加入对空气敏感的格氏试剂,也可以避免试剂管与格氏试剂或沉淀镁的相互污染。
-
不参与11C-ACE合成的部件不在产率影响因素考察之列。将高效液相色谱分离系统改造为固相分离系统大大缩短了合成时间,对提高产率的贡献显而易见。在此考察11C-CO2传输方式的改变、镍粉催化剂柱的连接与否及安装前体加注装置对产率的影响。
-
试验在短接镍粉柱的情况下,对比11C-CO2经分子筛传输与不经分子筛传输对11C-CO2捕获的影响。加速器轰击束流设置为20 μA,轰击时间固定为5 min,分别进行5次试验;在固定11C-CO2经分子筛传输的情况下,对比镍粉柱短路与否对11C-CO2捕获的影响。也分别进行5次试验,加速器束流和轰击时间设置相同。观察改造前后CH4捕获器捕获11C-CO2的活度的差异。
-
根据1.3.1试验结果,筛选出更为合理的改造方法用于本实验,加速器轰击束流设置为25 μA,轰击时间固定为25 min,安装前体加注装置与不安装分别进行5次试验,观察合成11C-ACE的产量变化。
-
根据产率影响因素的考察,确定较为合理的改造途径,然后固定下来用于自动化合成,在合成11C-ACE之前需对合成器进行检漏和测试。根据氦气压力及流速判断各管路及阀门是否漏气。在1、2、3号试剂瓶中加入丙酮,模拟合成通路,测试各阀门及系统是否正常运行并干燥及消毒。
-
合成器预先进行清洗,在各试剂管内装入相应的试剂,用纯化水和冰醋酸配制1 mmol/L CH3CO2H溶液,配制pH4.7的柠檬酸缓冲液和1 mol/L NaOH溶液。试剂瓶1、2、圆底烧瓶分别预先加入1、2、8 ml 1mmol/L的CH3CO2H溶液。试剂瓶5、6分别加入10 ml的纯化水,试剂瓶4加入6 ml柠檬酸缓冲液,在11C-CO2被引进反应容器之前,先用高纯氦气置换V29、V21、MeI捕获器、反应瓶及管路中的大气和12C-CO2,然后加入500 μl 0.5 mol/L的CH3MgBr的四氢呋喃溶液。在圆底烧瓶与V11连接口中间接头上安装PS-H+和PS-Ag+ Sep-Paks柱,固相萃取座上安装处理过的PS-OH-柱。在加速器轰击结束前2 min,向反应瓶内加入0.5 ml 0.5 mol/L CH3MgBr的四氢呋喃溶液。待轰击结束,按照前述改造前后两种方法传输11C-CO2并记录捕获器活度为原料活度。
-
加热捕获器释放11C-CO2,50 s后开始用15 ml/min氦气流将11C-CO2传输至反应瓶。传输时间为1 min。传输结束后打开V1向反应瓶内缓慢加入1 mmol/L CH3CO2H溶液,以20 ml/min氦气流鼓泡1.5 min,去除未反应的11C-CO2,记录反应瓶活度为中间活度。
将2号试剂管中的1 mmol/L CH3CO2H溶液加入到反应瓶中,清洗反应瓶。打开V7、V8,控制V2,使稀释的混合液缓慢通过V8(ON)、V7(ON)到达圆底烧瓶,产品混合物被稀释,再经过PS-H+和PS-Ag+ Sep-Paks柱、V11、PS-OH-柱、V12流向废液瓶。11C-ACE捕获于PS-OH-柱上,此过程持续3 min。
将V11打开朝向4、5、6号试剂管。打开V6,用6号试剂管中的注射用水通过V6(ON)、V11(ON)冲洗PS-OH-柱,之后用5号试剂管中的注射用水再洗PS-OH-柱一次。最后,给V12加电,打开V4,使4号试剂管中的柠檬酸缓冲液通过V4(ON)、V5、V6、V11(ON)、PS-OH-柱、V12(ON)将11C-ACE淋洗进入产物瓶。记录活度之后,将产品从产品瓶压出,通过0.22 μm滤膜过滤进入无菌瓶接收,即得到11C-ACE。
-
11C-ACE的质量控制参考中华人民共和国药典2015版第四部生物活性测定法1401(放射性药品检定法)及通则9501(正电子类放射性药品质量控制指导原则)[7],分别进行性状检查、pH值检查、放射化学纯度测定、过滤器完整性测试、细菌内毒素检查、无菌检查和放射性浓度检查。
放射化学纯度测定用高效液相色谱法,配备有UV检测器(220 nm)和一个放射性活度检测器。高效液相色谱柱:Phenomenex Luna SCX,150 mm×4.60 mm;流动相:0.025 mol/L硫酸溶液;流速=1.0 ml/min。乙酸钠(> 99.5%)作为非放射性12C的标准品。过滤器完整性测试:像正常生产一样,过滤器连着针头插到无菌水液面下,另一端经由一个调节器与氮气供给相连。不断加大氮气压力,当压力达到过滤器可接受的350 kPa压力下,没有看到气泡流则过滤器完好。如果在 < 350 kPa的压力下看到了气泡流,则测试失败。
-
产率影响因素数据使用SPSS 22统计学软件处理,统计学方法为两组独立样本资料的t检验,P < 0.05表示差异有统计学意义。
-
11C-CO2传输方式的改变及镍粉催化剂柱的连接与否对11C-CO2捕获的影响,可通过测量两种改造前后CH4捕获器捕获11C-CO2的活度来比较,详见表 1。在短接镍粉柱的情况下,11C-CO2经分子筛传输与不经分子筛传输在α=0.05水平上可以认为有显著的不同。在固定11C-CO2经分子筛传输的情况下,镍粉柱短路与否在α=0.05水平上可以认为有显著的不同。
试验批次 11C-CO2传输方式 t值 P值 镍粉柱连接情况 t值 P值 不经分子筛 经分子筛 短接前 短接后 试验1 4884 12 839 44.6 < 0.01 1258 12 321 79.8 < 0.01 试验2 6216 9694 2886 10 693 试验3 5735 10 767 3737 11 433 试验4 4144 13 801 1961 11 507 试验5 6586 12 025 2886 10 767 表 1 11C-CO2传输方式的改变及镍粉催化剂柱的连接与否对11C-CO2捕获的影响(MBq)
Table 1. The effect of the change of 11C-CO2 transmission mode and the connection or not of nickel powder catalyst column on 11C-CO2 captured(MBq)
为分别比较两种改造方式对11C-CO2捕获影响的显著性,以各项对比值均数做柱状图,如图 3。11C-CO2的传输经过和不经过分子筛对其捕获有显著影响,经过分子筛可大大提高11C-CO2的捕获效率,对11C-ACE产率的影响也是非常显著的;短接和不短接镍粉柱对11C-CO2的捕获影响更加显著,短接后可大大提高11C-CO2的捕获效率,对11C-ACE产率的影响也是非常显著的,且合成器这两项改进对11C-ACE的产率将有一个共同性地提高。

图 3 11C-CO2传输方式及镍粉柱连接改进对11C-CO2捕获的影响
Figure 3. The effect of the change of 11C-CO2 transmission mode and the connection improvement of nickel powder column on 11C-CO2 captured
在11C-CO2传输经过分子筛且短接镍粉柱的情况下,前体加注装置安装前后对1C-ACE产量的影响见表 2。安装前体加注装置前后对11C-ACE产量的影响在α=0.05水平上可以认为有显著的不同。可见是否安装前体加注装置对11C-ACE产率的影响也很显著。但从均值比较来看对产率的提升并不是特别明显。
试验批次 未安装前体
加注装置安装前体
加注装置t值 P值 试验1 2368 3959 79.8 < 0.01 试验2 3034 2812 试验3 3441 3145 试验4 2627 4699 试验5 3922 5291 表 2 安装前体加注装置前后对合成11C-乙酸盐的影响(MBq)
Table 2. Effect of before and after fixing precursors filling device for the synthesis of 11C- acetate(MBq)
-
使用试验后较为理想的改造方法进行11C-ACE的全自动合成,共连续生产了5次均获成功。生产结束后均进行了质量控制并出具了质控报告,所得最终产品质控均符合药典2015版第四部放射性药品检定法及正电子类放射性药品质量控制指导原则[7](表 3)。
质量参数 标准 试验1 试验2 试验3 试验4 试验5 性状 无色、澄清 符合规定 符合规定 符合规定 符合规定 符合规定 pH值 4.5~7.5 6.3 6.5 6.1 6.6 6.8 放射化学纯度(%) ≥90 98.9 98.5 99.7 99 99.2 细菌内毒素(EU) < 15.0 < 2.00 < 2.00 2.44 < 2.00 < 2.00 无菌 无菌生长 符合规定 符合规定 符合规定 符合规定 符合规定 活度(MBq) - 3959 2812 3145 4699 5291 放射性浓度(MBq/ml) ≥370 659.8 468.7 524.2 783.2 881.8 注:表中,“-”表示无此项数据。 表 3 11C-乙酸盐质量控制数据
Table 3. The quality control data of 11C-acetate
采用高效液相色谱法测量11C-ACE的放化纯,显示单一峰(图 4中A线),该峰与乙酸盐的紫外吸收峰(B线)一致,保留时间为8.6 min,11C-ACE放化纯>95%。
-
自动化合成11C-ACE在纯化方面从最初的高效液相色谱法[8]、蒸馏法[9]发展为后来的固相萃取法[10],从技术上有了很大的发展。固相萃取法无论是在合成过程的时间节省上还是在产品纯度上都有了很大的提升,从近期文献来看[4, 11-12],固相萃取法纯化11C-ACE已成为了成熟、稳定、主流的纯化方法。本次实验也采用了固相萃取的方法,从质控结果来看也是符合临床应用要求的。
由于对一些必要部件及电控方面不熟悉,在合成器结构改造过程中遇到了很多困难,也走了很多弯路。因此在合成初期进行相关的学习或者厂家工程师对使用者进行一些培训指导是必要的。
在整个合成器改造过程中,气密性是尤其需要重视的。每次改造后的预实验均需要进行气密性测试、系统性测试,以确保试验过程中不出现放射性事故、漏液等造成试验失败。试验过程中全程监测环境放射性活度,以便出现11C-CO2泄漏能够及时发现,保护工作人员的安全。通风系统全程打开。
传输11C-CO2时,轰击后的混合靶气体是否经过分子筛装置选择性吸附对11C-CO2的捕获影响显著。不经过分子筛装置吸附的,11C-CO2捕获减少可能是因为传输时流速过快,并且轰击过程中靶气体转化为11C-CO2的量较少,混合气体传输过程中11C-CO2的捕获效率不高。经过分子筛装置吸附后,传输气体得到了纯化,流速也减慢了,11C-CO2捕获效率大大提高。
本次实验起初并未短路镍粉催化剂柱,仅通过加热至400℃的办法来防止活性11C-CO2被镍粉吸附,但经过多次试验并未合成成功。寻找原因时将V10与NaOH柱相连,用低放射性水平的11C-CO2通过V26、V29、V9、V10,发现NaOH柱上几无放射性,怀疑镍粉柱吸附了11C-CO2,经短路镍粉柱后,合成获得成功。镍粉柱对11C-CO2的完全吸附并不是在所有的合成器上都会发生,吸附阻碍的程度取决于镍粉填充柱的密度及环境。
在反应容器上加装一个格氏试剂注入装置,可通过外部阀门(进样阀)控制开关,以便于在活性物质到达前可以向反应容器中加入CH3MgBr,当打开阀门时氮气压力可将对空气敏感的格氏试剂加入反应容器中。此装置从统计结果上看可有效防止空气对格氏试剂的影响,但从实际操作过程中和数据均值上看对11C-ACE产量的影响却并不显著,究其原因可能是因为格氏试剂并未像我们想象中的那样不稳定,或者也可能是新疆地域干燥、环境湿度低,对格氏试剂的影响小。
综上所述,11C-ACE的合成影响因素多,合成产率不稳定,每套合成器均需要对可能影响产率的因素进行考察,以寻找最佳合成路径进行稳定生产,并行必要的质控以保障临床用药安全。合成过程中防止放射性气体泄漏也是合成工作的重要内容之一,需要特别地关注。本研究通过对11C-ACE合成影响因素的考察,最终确定较为满意的合成路径,所得产品符合放射性药品质量控制指导原则之规定,放化纯度高,产率稳定,可满足临床应用要求。
11C-乙酸盐的自动化合成影响因素的考察及质量控制
Study of the automated synthesis influence factors and quality control of 11C-acetate
-
摘要:
目的 通过对Tracerlab FXC进行改造实现稳定地自动化合成11C-乙酸盐, 并进行了必要的质量控制及产率的影响因素分析。 方法 短接合成器上不参与反应的装置, 加装可外部控制的阀门或装置来控制可能影响合成产率的外部因素。以活性11C-CO2与500μl 0.5 mol/L的CH3MgBr反应, 经猝灭、稀释、固相萃取获得11C-乙酸盐。参照中国药典第四部通则对终产品进行必要的质量控制。 结果 通过产率的影响因素分析明确了显著影响11C-乙酸盐合成的因素。经过连续5次合成11C-乙酸盐, 所得产品经检定均符合规定。 结论 11C-乙酸盐的合成影响因素多, 产率浮动大, 采用改造过的这套系统可自动、稳定、快速、安全地合成11C-乙酸盐, 并且各项必要的质控指标均符合要求。 Abstract:Objective To use Tracerlab FXC transformation to achieve a stable automated synthesis of 11C-acetate, while performing necessary quality control and analysis of key factors of production yield. Methods The devices that do not participate were short-circuited in the reaction of synthesis, adding external controllable valves or devices to control the external factors which may affect the synthesis yield.The active 11C-CO2 reacts with 500 μl of 0.5 mol/L methyl magnesium bromide and then quenched and diluted, and solid phase extraction was used to obtain 11C-acetate.Quality control is applied to the final product according to Chinese Pharmacopoeia Fourth General. Results The analysis of the key factors of yield was carried out to identify the major factors exerts the most considerable effect on the processing synthesis of 11C-acetate.All results qualified after testing according to Chinese Pharmacopoeia quality control guidelines with five times of consecutive synthesis. Conclusions Numerous factors affect the synthesis of 11C-acetate, and production yield is highly unstable, as well.The modified Tracerlab FXC is able to produce 11C-acetate in a faster, more stable, and secure approach, and the final product is also qualified according to the product standard. -
Key words:
- Acetates /
- Automation /
- Quality Control /
- Chemical synthesis
-
表 1 11C-CO2传输方式的改变及镍粉催化剂柱的连接与否对11C-CO2捕获的影响(MBq)
Table 1. The effect of the change of 11C-CO2 transmission mode and the connection or not of nickel powder catalyst column on 11C-CO2 captured(MBq)
试验批次 11C-CO2传输方式 t值 P值 镍粉柱连接情况 t值 P值 不经分子筛 经分子筛 短接前 短接后 试验1 4884 12 839 44.6 < 0.01 1258 12 321 79.8 < 0.01 试验2 6216 9694 2886 10 693 试验3 5735 10 767 3737 11 433 试验4 4144 13 801 1961 11 507 试验5 6586 12 025 2886 10 767 表 2 安装前体加注装置前后对合成11C-乙酸盐的影响(MBq)
Table 2. Effect of before and after fixing precursors filling device for the synthesis of 11C- acetate(MBq)
试验批次 未安装前体
加注装置安装前体
加注装置t值 P值 试验1 2368 3959 79.8 < 0.01 试验2 3034 2812 试验3 3441 3145 试验4 2627 4699 试验5 3922 5291 表 3 11C-乙酸盐质量控制数据
Table 3. The quality control data of 11C-acetate
质量参数 标准 试验1 试验2 试验3 试验4 试验5 性状 无色、澄清 符合规定 符合规定 符合规定 符合规定 符合规定 pH值 4.5~7.5 6.3 6.5 6.1 6.6 6.8 放射化学纯度(%) ≥90 98.9 98.5 99.7 99 99.2 细菌内毒素(EU) < 15.0 < 2.00 < 2.00 2.44 < 2.00 < 2.00 无菌 无菌生长 符合规定 符合规定 符合规定 符合规定 符合规定 活度(MBq) - 3959 2812 3145 4699 5291 放射性浓度(MBq/ml) ≥370 659.8 468.7 524.2 783.2 881.8 注:表中,“-”表示无此项数据。 -
[1] 陈思蓉, 何志礼.18F-FDG及11C-乙酸盐PET/CT诊断原发及转移性肝细胞癌:一项前瞻性研究的价值与不足分析[J].中华核医学杂志, 2009, 29(3):205-207.DOI:10.3760/cma.j.issn.0253-9780.2009.03.018.Chen
Chen SR, He ZL.18F-FDG and 11C-acetate PET/CT for detection of primary and metastatic hepatocellular carcinoma:the pros and cons of a prespective study[J].Chin J Nucl Med, 2009, 29(3):205-207. doi: 10.3760/cma.j.issn.0253-9780.2009.03.018.Chen[2] Ho CL, Yu SC, Yeung DW.11C-acetate PET imaging in hepatocellular carcinoma and other liver masses[J].J Nucl Med, 2003, 44(2):213-221. [3] Park JW, Kim JH, Kim SK, et al.A prospective evaluation of 18F-FDG and 11C-Acetate PET/CT for detection of primary and metastatic hepatocellular carcinoma[J].J Nucl Med, 2008, 49(12):1912-1921.DOI:10.2967/jnumed.108.055087. [4] Runkle AC, Shao X, Tluczek LJ, et al.Automated production of 11C acetate and 11C palmitate using a modified GE Tracerlab FX(C-Pro)[J].Appl Radiat Isot, 2011, 69(4):691-698.DOI:10.1016/j.apradiso.2011.01.002. [5] 王治国, 左峰, 张国旭, 等.11C-乙酸盐FXC合成器的改进及产率因素研究[J].中国医学装备, 2014, 11(3):31-33.DOI:10.3969/J.ISSN.1672-8270.2014.03.011.Wang
Wang ZG, Zuo F, Zhang GX, et al.The improvement and yield factors of 11C-acetate on FXC[J].China Med Equip, 2014, 11(3):31-33. doi: 10.3969/J.ISSN.1672-8270.2014.03.011.Wang[6] 李彦生.碳-[11C]乙酸盐的全自动合成及临床前研究[D].天津: 天津大学, 2013: 1-47.
Li YS.The study of automated synthesis of 11C acetate and its pre-clinical application[D].Tianjin: Tianjin University, 2013: 1-47.[7] 国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社, 2009.
Chinese Pharmacopoeia Commission.Pharmacopoeia of the People's Republic of China[M].Beijing:Chemical Industry Press, 2009.[8] Davenport RJ, Pike VW, Dowsett K.Automated chemoenzymatic synthesis of no-carrier-added [carbonyl-11C] propionyl L-carnitine for pharmacokinetic studies[J].Appl Radiat Isot, 1997, 48(7):917-124.DOI:10.1016/S0969-8043(97)00026-2. [9] Mitterhauser M, Wadsak W, Krcal A, et al.New aspects on the preparation of[11C] acetate-a simple and fast approach via distillation[J].Appl Radiat Isot, 2004, 61(6):1147-1150.DOI:10.1016/j.apradiso.2004.03.060. [10] Bar DL, Malleval M, Bonnefoi F, et al.Simple synthesis of[1-11C]-aceteta.J Label Compd Radiopharm, 2006, 49: 263-267.DOI: 10.1002/jlcr.1024. [11] 甘满权, 唐小兰, 唐刚华, 等.11C-乙酸盐自动化合成改进工艺及PET/CT显像[J].同位素, 2013, 26(2):73-78.DOI:10.7538/tws.2013.26.02.0073.Gan
Gan MQ, Tang XL, Tang GH, et al.Improved automated synthesis and preliminary animal PET/CT imaging of 11C-acetate[J].J Isotop, 2013, 26(2):73-78. doi: 10.7538/tws.2013.26.02.0073.Gan[12] 赵雷, 杨雁, 孙华.自动化固相萃取法合成11C-乙酸盐的影响因素[J].国际放射医学核医学杂志, 2015, 39(3):224-227, 234.DOI:10.3760/cma.j.issn.1673-4114.2015.03.008.ZhaoL,
Zhao L, Yang Y, Sun H.Influential factors of solid-phase extraction method to automate the synthesis of 11C-acetate[J].Int J Radiat Med Nucl Med, 2015, 39(3):224-227, 234. doi: 10.3760/cma.j.issn.1673-4114.2015.03.008.ZhaoL, -






 下载:
下载: