-
近年来,随着多层螺旋高分辨率CT的临床应用、肺低剂量CT普查的开展及病理学的进展,肺不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)逐渐为临床、病理及影像医师所认识,但是,目前对AAH的认识仍有不足,笔者将在工作中遇到的3例经手术证实的AAH病例结合近年来有关AAH的文献报告如下,以供同道们参考,并希望能引起临床、病理、影像工作者的注意。
-
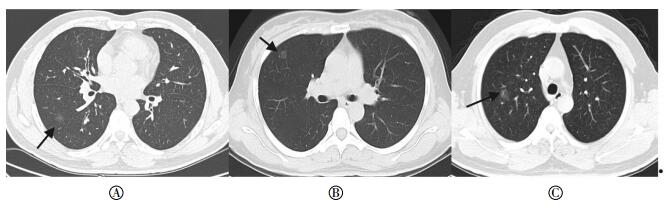
病例1,男性,48岁。无明显临床症状和体征,于肺低剂量CT体检中偶然发现。CT平扫:右肺下叶外基底段见一磨玻璃密度结节,直径约9 mm,边缘欠清晰,见浅分叶,病灶内见血管纹理穿过,相邻胸膜未见胸膜凹陷,与肺门间无血管集束征,肺门部及纵隔内未见明显肿大淋巴结(图 1中A)。手术中,于胸腔镜下楔形切除病变肺段。病理:肉眼观病变区呈灰黄色结节,实性,与周围组织界限清楚,直径约7 mm。镜下见肺泡间隔增厚,上皮细胞稍增大,沿肺泡壁单层生长,细胞间排列紧密,但不连续,局部见细胞聚集成簇状和假乳头状,细胞核大小一致,胞质较少,核质比例轻度失调,有轻度异型性,未见核分裂象。病理诊断:AAH。
病例2,女性,43岁。无明显临床症状和体征,于肺低剂量CT体检中偶然发现。CT平扫:右肺中叶外侧段胸膜下见一磨玻璃密度结节,直径约9 mm,边缘清晰,未见分叶及毛刺,肺门部及纵隔内未见明显肿大淋巴结(图 1中B)。手术中,于胸腔镜下楔形切除病变肺段。病理:肉眼观病变呈灰白色结节,实性,与周围组织界限清楚,直径约8 mm。镜下见肺泡壁增厚,肺泡上皮沿肺泡间隔增生,细胞间无重叠、挤压,细胞核有异型,见纤维增生,染色质增粗。病理诊断:AAH。
病例3,女性,47岁。咳嗽、喘憋3个月,听诊双肺闻及哮鸣音,未闻及干湿性啰音,临床诊断:支气管炎。CT平扫:右肺上叶后段见一磨玻璃密度结节,直径约9 mm,边缘清晰,但欠规整,见浅分叶,未见毛刺,邻近胸膜无胸膜牵拉、凹陷,肺门部及纵隔内未见肿大淋巴结(图 1中C)。手术切除右肺上叶。病理:肉眼观病变区呈灰白色结节,实性,边界清楚,直径约8 mm。镜下见肺泡间壁轻度增厚,上皮细胞沿肺泡壁呈单层生长,细胞呈立方形、矮柱状,细胞间不连续,细胞核见轻度异型,未见核分裂象,病变区域支气管、血管无异常改变。病理诊断:AAH。
-
肺癌是当前呼吸系统常见的恶性肿瘤,发现时多数已属中晚期,严重威胁人类身体健康。近年来,由于环境污染的日趋严重和吸烟人群的不断扩大,肺癌发病率有明显升高倾向,因此,癌前病变的研究显得尤为重要,是世界各国十分重视的研究领域。AAH是一种轻到中度不典型的立方或矮柱状细胞沿着轻度增宽的肺泡壁生长的增生性疾病,与肺腺癌的发生、发展密切相关,是病理学界认可的肺腺癌癌前病变,特别是细支气管肺泡癌(bronchiolealveolar carcinoma,BAC),目前大多数研究者认为AAH是BAC的前驱病变。世界卫生组织提出,肺腺癌的前期病变为AAH,1999和2004年其被正式列入世界卫生组织的肺癌组织学分类[1-2]。笔者复习相关文献资料,就AAH流行病学、病理学及影像学表现等方面进行回顾性分析、总结,旨在提高对AAH影像表现的认识。
-
王建卫等[3]检索文献得知:AAH发病平均年龄为57.0±13.6岁,女性略多于男性,可以为多发;尸检结果表明,AAH在包括各年龄组的人群中的发病率为2.8%;在60岁以上老年组中的发病率为6.6%,其中恶性肿瘤组AAH的发病率高于非恶性肿瘤组(10.2%和3.4%);在肺癌患者中的发病率为12.1%。有研究报告称,AAH可能与既往恶性肿瘤史相关,如直肠癌、肝癌、乳腺癌、甲状腺癌、头颈部癌和恶性淋巴瘤[4]。AAH与吸烟史、家族肿瘤史的相关性仍无定论,有待进一步研究。
AAH通常无明显临床症状和体征,多数于肺低剂量CT普查,或因其他原因做肺CT,还有肺癌手术切除标本中偶然发现,病理组织学诊断是唯一的确诊方法。
-
AAH可单发或多发,肺切面上可见分散、柔软的灰白色、灰黄色实变区,病变内肺泡间隙呈斑点状凹陷,AAH常位于近胸膜处,与周围界限清楚,一般直径1~4 mm,个别>10 mm,但随着AAH体积的增大,细胞的异型性亦随之增大,诊断时要充分观察其细胞的异型程度,以免误诊[3]。
-
显微镜下看,AAH是一种肺实质病变,常发生在中央肺泡接近呼吸性细支气管处。AAH的组织学诊断标准为:①病变边缘清晰,病变区域细胞为单层不典型上皮细胞增生,沿肺泡壁单层生长,局部可出现假乳头和细胞簇,细胞排列紧密,但未见重叠及挤压,有轻微的异型性;②细胞浆丰富,细胞呈圆形或穹隆状,类似肺泡Ⅱ型上皮细胞;③肺泡间隔可因胶原、纤维母细胞和淋巴细胞的存在而增厚,但病灶中心无萎陷或疤痕形成,肺泡间隔上衬覆以不典型立方形或矮柱状细胞或呈“鞋钉”样突出,有轻到中度异型性,可见双核细胞,核分裂极少;④细胞核深染,核仁显著,核质比例轻度失调,有轻度异型性[5-8]。
-
X线胸片很难发现AAH,高分辨率CT对于AAH的检出具有独到的优势。肺高分辨率CT显示AAH为类圆形小病灶,大小多数在10 mm以下,王建卫等[3]提出,因病理所见的皆为萎陷、固定后的标本,故影像中看到的AAH病灶多大于病理所见。AAH常表现为非实性结节,密度淡至中等,呈均匀的毛玻璃或磨砂玻璃样病变,低度透光,不遮蔽其下的肺实质。磨砂玻璃样病变不是AAH的特殊影像学表现,其病理学基础是由于肺泡内气体减少、细胞数量相对增多、肺泡上皮细胞增生、肺泡间隔增厚及终末气道部分充填等因素所致。AAH也可以表现为部分实性结节,密度不均匀,其密度低于BAC,偶尔可以看到细支气管充气征和微小空泡,Takashima等[9]认为,AAH的实性成分,在病理上解释为肺泡腔缩小、肺泡壁增厚,而病变中细支气管充气征则与含气的呼吸性细支气管和肺泡相对应。AAH这种表现是非特异性的,还包括其他病变,如炎性病变、局灶性纤维化、肺泡癌和腺癌等。AAH大多边界清楚,部分病变边缘模糊,可以有浅分叶,主要是由于病变增生不均匀所致,当边缘出现毛刺和胸膜牵拉征时,则不应诊断为AAH,肺纤维化通常没有细小毛刺和分叶等边缘征象,炎性病变可自行消失或经抗炎治疗后消散,而恶性结节则持续存在。王建卫等[10]总结AAH影像诊断指标为:①偶尔发现的肺结节,无症状;②病变通常直径≤10 mm;③多层螺旋高分辨率CT表现为非实性结节,可有空泡或空气支气管征;④多层螺旋高分辨率CT无毛刺征和胸膜牵拉征等表现。
-
随着低剂量CT肺癌筛查的开展,CT发现了越来越多的肺结节,影像学的主要任务是区分结节的良恶性,AAH和早期的非黏液性BAC在病理形态上有时难以区别,但临床处理及预后上有很大差别,故将二者区分具有重要的理论和实际意义。AAH与BAC相比,肉眼观察AAH很少>10 mm,但小体积BAC与AAH鉴别困难,BAC平均直径较大,通常>10 mm[11];Nomori等[12]认为CT值可以帮助鉴别AAH与BAC,AAH的平均CT值为(-697±56)HU,BAC的平均CT值为(-564±73)HU,两者差异有统计学意义;结节中的实性成分、毛刺和胸膜牵拉有助于BAC的诊断,Takashima等[11]通过分析CT图像,发现随着肿瘤的进展,影像中病变的实性成分、毛刺和胸膜牵拉征逐步增多,说明了小腺癌的演进过程;AAH发病年龄通常比BAC早。因此,结合病灶大小、边缘、密度和患者年龄等因素分析,有利于AAH与BAC、肺腺癌的鉴别诊断[12]。
-
对于单个AAH建议定期随访,怀疑恶性可手术切除,如果肺癌患者合并有此类病灶,建议同期手术切除,术后需长期随访。
综上所述,尽管AAH的临床及影像学表现并不特异,与BAC有很大的重叠,鉴别困难,但通过随诊,动态观察AAH病变的演进过程,选择合适的手术时机切除AAH,有望避免病灶癌变。本研究中病例数较少,可能部分个案不能充分体现整体的共有特征,有待积累更多病例进一步探讨。
肺不典型腺瘤样增生三例
-
-
关键词:
- 肺 /
- 癌前状态 /
- 体层摄影术, X线计算机 /
- 不典型腺瘤样增生
-
[1] Travis WD, Colby TV, Corrin B, et al. Histological typing of lung and pleural tumours[M]. 3rd ed. Berlin:Springer, 1999:29. [2] Travis WD, Muller-Hermelink HK, Harris CC, et al. Pathology and genetics of tumours of the lung, pleura, thymus and heart[M]. Lyon:IARC Press, 2004:73-77. [3] 王建卫, 吴宁, 林冬梅.浅谈对肺不典型腺瘤样增生的认识[J].中华放射学杂志, 2008, 42(5):558-560. doi: 10.3321/j.issn:1005-1201.2008.05.042
[4] Yokose T, DoiM, Tanno K, et al. Atypical adenomatous hyperplasia of the lung in autopsy cases[J]. Lung Cancer, 2001, 33(2/3):155-161. [5] Carey FA, Wallace WA, Fergusson RJ, et al. Alveolar atypical hyperplasia in association with primary pulmonary adenocarcinoma:a clinicopathological study of 10 cases[J]. Thorax, 1992, 47(12):1041-1043. doi: 10.1136/thx.47.12.1041 [6] Mori M, Tezuka F, Chiba R, et al. Atypical adenomatous hyperplasia and adenocarcinoma of the human lung:their heterology in form and analogy in immunohistochemical characteristics[J]. Cancer, 1996, 77(4):665-674. [7] 宋艳, 李凌, 张询.肺不典型腺瘤样增生——肺的癌前病变之一[J].中国肺癌杂志, 2003, 6(5):399-401. doi: 10.3779/j.issn.1009-3419.2003.05.22
[8] 徐艳, 周晓军, 黄文斌.肺不典型腺瘤样增生和细支气管肺泡癌的鉴别诊断[J].临床与实验病理学杂志, 2008, 24(3):362-365. doi: 10.3969/j.issn.1001-7399.2008.03.028
[9] Takashima S, Maruyama Y, Hasegawa M, et al. CT findings and progression of small peripheral lung neoplasms having a replacement growth pattern[J]. AJR Am J Roentgenol, 2003, 180(3):817-826. doi: 10.2214/ajr.180.3.1800817 [10] 王建卫, 张宏图, 马霄虹, 等.肺不典型腺瘤样增生的影像与病理对照分析[J].中华放射学杂志, 2007, 41(5):483-486. doi: 10.3760/j.issn:1005-1201.2007.05.009
[11] 柳学国, 易先平, 梁明柱, 等.关于《肺不典型腺瘤样增生的影像与病理对照分析》一文中部分病例诊断结果的商榷[J].中华放射学杂志, 2008, 42(5):557-558. doi: 10.3321/j.issn:1005-1201.2008.05.041
[12] Nomori H, Ohtsuka T, Naruke T, et al. Differentiating between atypical adenomatous hyperplasia and bronchioloalveolar carcinoma using the computed tomography number histogram[J]. Ann Thorac Surg, 2003, 76(3):867-871. doi: 10.1016/S0003-4975(03)00729-X -





 下载:
下载: