-
电离辐射导致动脉粥样硬化(atherosclerosis,AS)于1959年被首次报道[1]。AS发病原因十分复杂,其确切病因尚未完全阐明,大量流行病学调查显示,众多遗传或环境因素与AS的发生存在明显相关性,但是尚不能确定具有直接的因果关系,习惯上称这些因素为AS的危险因素。与高血压、高血脂、吸烟和糖尿病一样,电离辐射也是诱发AS的独立危险因素之一,其亦可与其他因素一起共同作用于动脉血管,加速AS的形成。辐射所致的AS被认为是辐射导致心血管疾病致死的主要原因,尤其是照射10年之后,其发病率大大提高[2-3]。
-
人类接触电离辐射的来源很多,有环境来源的照射和职业照射,公众在接受诊断和治疗疾病的过程中也会受到电离辐射,尤其是接受放疗的患者局部会受到大剂量的照射。电离辐射可诱发癌症,接受颈部放疗的患者会产生很严重的后遗症,包括中风和短暂性脑缺血发作[4]。心血管疾病成为长期存活的癌症患者除肿瘤以外首要的致死因素,流行病学调查研究表明,在进行胸部放疗后长期存活的癌症患者中,心血管疾病的发病率明显增加,例如:霍奇金淋巴瘤患者或者儿童期患有癌症的患者,在接受2 Gy的分割照射、总剂量为30~40 Gy照射后,由心血管疾病导致的病死率提高了2~7倍,且受照射时年龄越小,因心血管疾病发作而死亡的概率越高[5]。目前,AS的发病机制还不清楚,通常认为AS是一种炎症性疾病,全身受照射可导致炎症因子的持续增加[6],炎症介质在AS的发病过程中起着重要作用。Little等[7]研究表明,单核细胞死亡和单核趋化蛋白1(MCP-1)水平增加在低剂量辐射所致的AS起始和发展阶段有着重要影响。
由于早期诊断技术和先进治疗手段的不断产生,肿瘤患者存活时间大大增加,这使得肿瘤患者的预后受到广泛重视。全球肿瘤患者至少有1/2接受了放疗,放疗的早期和晚期副作用严重影响了患者的生活质量和存活期。实际上,很多需要放疗的肿瘤,如头颈部肿瘤、乳腺癌、霍奇金淋巴瘤均出现心脑血管疾病并发症[2, 8-9]。临床研究资料表明,颈动脉照射可导致AS的发生,并导致血管的狭窄、血栓和中风[3, 10],电离辐射还会导致与年龄有关的AS的快速发展[11]。
另一方面,临床和实验室研究表明,原子弹爆炸幸存者受辐射的剂量与胆固醇水平增加、血压升高有关,并且其亚临床的炎症标志物,如:IL-6、C反应蛋白(CRP)水平在受照射后持续升高,同时,其WBC、红细胞血沉、唾液酸、α-1和α-2球蛋白均升高[12-13]。与辐射诱导的肿瘤的病死率相比,辐射诱导的心血管疾病的病死率是其2倍。近年来,AS作为辐射诱导的非肿瘤性疾病受到国际科学组织重视,且尤为重视受到慢性照射的人群[14]。
-
心血管系统是辐射轻度敏感组织,但是血管内层的内皮细胞是中度敏感组织细胞,血管内皮细胞的衰老和凋亡是AS发生的关键因素[15-16]。受损的内皮细胞和单核细胞的粘附能力增加[通过一些炎症因子,如:人E选择素(E-selectin),血管细胞粘附分子-1(VCAM-1)和细胞间黏附分子-1(ICAM-1)],进而会通过MCP-1跨膜进入内膜。单核细胞会吞噬低密度脂蛋白,形成富含脂质的巨噬细胞,即AS的早期斑块。内皮细胞在受到 > 2 Gy照射后会导致内皮细胞的炎症反应,分泌粘附分子,促进白细胞的粘附[17-18]。
DNA的损伤被认为是辐射引起细胞损伤的最主要的起始事件,最终导致癌症的发生和遗传性疾病。同时,大量数据表明,氧化应激导致的DNA损伤和端粒功能失调对AS斑块的发展以及并发症的发生有重要作用[19]。在人AS斑块中,有的细胞DNA损伤非常严重,如:整个或部分染色体的丢失或增加;有较轻的损伤,包括杂合子的丢失、微卫星的不稳定性(DNA区域的突变,进而影响基因表达)、DNA链的断裂、修饰(包括氧化)及聚合。研究表明,严重缩短的端粒导致了血管细胞的衰老,白细胞的端粒长度可以用来预测心血管疾病的发生及其导致的病死率[20]。端粒的缩短、DNA损伤均与DNA损伤信号通路关系密切,这些会导致细胞周期的阻滞、促进修复,但是如果损伤严重则会诱导凋亡的发生。如果DNA损伤不能修复,会导致凋亡或者持久的细胞周期阻滞,致使细胞处于衰老的状态。未修复的DNA损伤会导致基因突变,最终导致细胞功能的改变[21]。
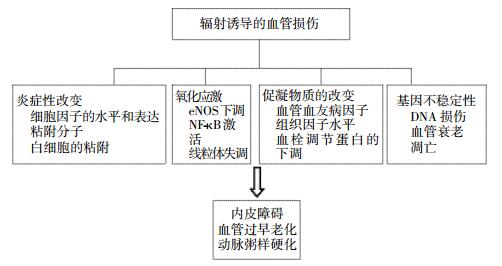
对于超过1 Sv的辐射,体内、体外实验均证实内皮细胞的受损、炎症、凝血机制、血小板的活性、DNA损伤、老化和细胞死亡等多方面因素与辐射诱导的心血管疾病有关(图 1)[22]。高剂量辐射效应模型与一些人类流行病学调查数据是一致的,高剂量辐射加速了AS的发展,容易形成炎症、血栓,特别是ApoE(-/-)基因缺陷型小鼠更易形成AS[23-24]。
图 1 辐射诱导的血管损伤的生物学性状和分子水平的改变[22]
Figure 1. Biological and molecular alterations in radiation-induced vascular effects
利用ApoE-/-小鼠的实验研究表明,p53对辐射诱导的AS具有调控作用。在疾病发生的早期,p53功能的降低不影响低剂量率、低剂量辐射对早期AS有保护作用,但在AS的晚期阶段,p53功能的降低产生了损伤作用,不能对p53正常小鼠起到保护性作用[25]。这些研究提示了低剂量照射对于AS的影响机制是多样的,其中p53起着重要作用。而辐射的剂量率也是辐射诱导AS一个很重要的因素,高剂量和低剂量辐射诱导的AS在疾病的早、晚期阶段的表现是不同的。
分子检测表明,低剂量辐射(200 mGy)对于内皮细胞蛋白表达的影响是显著的,而高剂量率(190 mGy/min)辐射比低剂量率(20 mGy/min)更能改变蛋白质的表达。通过生物信息学分析辐射信号通路表明,低剂量辐射效应依赖于氧化还原电位和活性氧的水平[26]。蛋白组学和miRNA研究表明,单次剂量200 mGy照射原代人冠状动脉内皮细胞会引起miRNA和后续的蛋白表达改变,进而调控DNA损伤和早衰[27-28]。辐射诱导的DNA损伤和氧化应激会导致p53、p21的激活,抑制原代人脐静脉内皮细胞增殖,导致早衰[29]。因此,导致辐射诱导AS的另一个可能因素是基因的不稳定性和血管的内皮细胞衰老[30]。
总的来说,这些研究表明辐射会诱导或者加速AS的基因损伤,辐射所致的DNA基因修复通路的改变对于辐射诱导的心血管疾病有一定影响。
-
长期以来,辐射生物学的传统观念一直认为电离辐射直接作用或通过电离辐射水分子产生的间接作用引起受照射细胞的DNA损伤,此损伤是导致细胞突变、转化、死亡等一系列生物学效应的主要原因。1992年,Nagasawa和Little研究发现[31],用极低剂量(0.03~0.25 cGy)α粒子照射中国仓鼠卵巢细胞(CHO)发现,当α粒子穿过1%或低于1%的细胞时,有30%~50%的细胞发生姊妹染色单体互换(SCE),次黄嘌呤磷酸核糖基转移酶(HPRT)基因突变的频率远远高于受照射细胞的比例,微核率的增加比例也远远大于受照射的细胞比例,说明未受到照射的中国仓鼠卵巢细胞诱发了DNA损伤,这种现象被称为辐射旁效应。在后来的很多研究中,辐射旁效应得到证实,因此也逐渐成为辐射生物学的一个热点研究领域。受照射细胞可以分泌损伤信号,包括活性氧(ROS)和活性氮(RNS)自由基以及一些细胞因子(包括炎症因子),对共培养的未受照射细胞产生一系列生物学效应[32-33]。
单核巨噬细胞作为免疫细胞介导了电离辐射旁效应,同时也可能参与AS的形成。有研究证实,局部受照射的淋巴瘤患者,其未受照射部位的内皮细胞会受到损伤[34],由于内皮细胞受损是AS的始动因素,电离辐射所致AS的形成过程中,辐射旁效应也可能发挥了重要作用。Xiao等[33]研究发现,受照射的单核巨噬细胞可通过释放NO损伤未受照射的内皮细胞,单核巨噬细胞是重要的旁效应细胞,参与了AS的发生发展。Yuan[35]等研究表明,受照射的单核巨噬细胞表面粘附因子增多。这些结果表明,辐射旁效应可能参与了辐射诱导的AS。
-
目前,已证实电离辐射与心血管疾病存在显著相关性,这对实际工作中的辐射防护有着重要的指导意义。虽然辐射诱导的心血管疾病是小概率事件,但是随着核医学与放射医学诊断与治疗人数的增加,受辐射人群日益增加。全世界大约有3000万工作人员受到不同剂量的辐射,其中介入透视的工作人员(包括专门做心脏手术的医生、专家,以及放射科的医生)接受的剂量最大,辐射诱导心血管疾病的风险也相应增加。因此,了解电离辐射诱导心血管疾病的机制,获得更为敏感的血管损伤和心血管疾病的分子标志物,对预防和降低辐射诱发AS的风险性具有重要意义。
电离辐射诱发动脉粥样硬化的研究进展
Research progress of radiation induced atherosclerosis
-
摘要: 电离辐射可以诱发动脉粥样硬化(AS)。随着接受辐射治疗后长期存活肿瘤患者的增多, 受照射人群心血管疾病的发病率也明显增加。辐射诱发AS涉及炎症性改变、氧化应激及基因不稳定性等过程, 电离辐射旁效应也可能与AS的发病存在一定相关性。笔者对近年来辐射诱发AS的相关研究进行了概述, 试图为深入研究辐射诱导AS的形成机制、为放射治疗预防药物靶点的选择提供一定的思路。Abstract: Ionizing radiation can induce atherosclerosis(AS). With increasing survival of patients after radiation therapy, the incidence of cardiovascular disease has increased significantly in the irradiated population. It is important to know the pathogenesis of ionizing radiation-induced AS. Amount of studies showed that the occurrence of AS is related to radiation-induced inflammatory, oxidative stress and genomic instability. Radiation induced bystander effect might also plays an effective role in AS induction. We hereby reviewed recent reports about radiation-induced AS and try to increase the knowledge of targeting therapy.
-
Key words:
- Radiation, Ionizing /
- Atherosclerosis /
- Bystander effect
-
图 1 辐射诱导的血管损伤的生物学性状和分子水平的改变[22]
Figure 1. Biological and molecular alterations in radiation-induced vascular effects
-
[1] Thomas E, Forbus WD. Irradiation injury to the aorta and the lung[J]. AMA Arch Pathol, 1959, 67(3):256-263. [2] Dorresteijn L D, Kappelle A C, Boogerd W, et al. Increased risk of ischemic stroke after radiotherapy on the neck in patients younger than 60 years[J]. J Clin Oncol, 2002, 20(1):282-288. [3] Cheng SW, Ting AC, Ho P, et al. Accelerated progression of carotid stenosis in patients with previous external neck irradiation[J]. Journal of Vascular Surgery, 2004, 39(2):409-415. doi: 10.1016/j.jvs.2003.08.031 [4] Wethal T, Nedregaard B, Andersen R, et al. Atherosclerotic lesions in lymphoma survivors treated with radiotherapy[J]. Radiother Oncol, 2014, 110(3):448-454. doi: 10.1016/j.radonc.2013.10.029 [5] Tukenova M, Guibout C, Oberlin O, et al. Role of cancer treatment in long-term overall and cardiovascular mortality after childhood cancer[J]. J Clin Oncol, 2010, 28(8):1308-1315. doi: 10.1200/JCO.2008.20.2267 [6] Hayashi T, Kusunoki Y, Hakoda M, et al. Radiation dose-dependent increases in inflammatory response markers in A-bomb survivors[J]. Int J Radiat Biol, 2003, 79(2):129-136. doi: 10.1080/0955300021000038662 [7] Little M P, Tawn E J, Tzoulaki I, et al. Review and meta-analysis of epidemiological associations between low/moderate doses of ionizing radiation and circulatory disease risks, and their possible mechanisms[J]. Radiat Environ Biophys, 2010, 49(2):139-153. doi: 10.1007/s00411-009-0250-z [8] Darby S, Mcgale P, Peto R, et al. Mortality from cardiovascular disease more than 10 years after radiotherapy for breast cancer:nationwide cohort study of 90 000 Swedish women[J]. BMJ, 2003, 326(7383):256-257. doi: 10.1136/bmj.326.7383.256 [9] Aleman BP, van den Belt-Dusebout AW, Klokman WJ, et al. Long-term cause-specific mortality of patients treated for Hodgkin's disease[J]. J Clin Oncol, 2003, 21(18):3431-3439. doi: 10.1200/JCO.2003.07.131 [10] Martin JD, Buckley AR, Graeb D, et al. Carotid artery stenosis in asymptomatic patients who have received unilateral head-and-neck irradiation[J]. Int J Radiat Oncol Bilo Phys, 2005, 63(4):1197-1205. doi: 10.1016/j.ijrobp.2005.04.017 [11] Hoving S, Heeneman S, Gijbels MJ, et al. Anti-inflammatory and anti-thrombotic intervention strategies using atorvastatin, clopidogrel and knock-down of CD40L do not modify radiation-induced atherosclerosis in ApoE null mice[J]. Radiother Oncol, 2011, 101(1):100-108. [12] Hayashi T, Kusunoki Y, Hakoda M, et al. Radiation dose-dependent increases in inflammatory response markers in A-bomb survivors[J]. Int J Radiat Biol, 2003, 79(2):129-136. doi: 10.1080/0955300021000038662 [13] Sasaki H, Wong FL, Yamada M, et al. The effects of aging and radiation exposure on blood pressure levels of atomic bomb survivors[J]. J Clin Epidemiol, 2002, 55(10):974-981. doi: 10.1016/S0895-4356(02)00439-0 [14] Little MP, Azizova TV, Bazyka D, et al. Systematic review and meta-analysis of circulatory disease from exposure to low-level ionizing radiation and estimates of potential population mortality risks[J]. Environ Health Perspect, 2012, 120(11):1503-1511. doi: 10.1289/ehp.1204982 [15] Lusis AJ. Atherosclerosis[J]. Nature, 2000, 407(6801):233-241. doi: 10.1038/35025203 [16] Andreassi MG, Piccaluga E, Gargani L, et al. Subclinical carotid atherosclerosis and early vascular aging from long-term low-dose ionizing radiation exposure:a genetic, telomere, and vascular ultrasound study in cardiac catheterization laboratory staff[J]. JACC Cardiovasc Interv, 2015, 8(4):616-627. [17] Schultz-Hector S, Trott KR. Radiation-induced cardiovascular diseases:is the epidemiologic evidence compatible with the radiobiologic data?[J]. Int J Radiat Oncol Biol Phys, 2007, 67(1):10-18. doi: 10.1016/j.ijrobp.2006.08.071 [18] Stewart FA, Hoving S, Russell NS. Vascular Damage as an Underlying Mechanism of Cardiac and Cerebral Toxicity in Irradiated Cancer Patients[J]. Radiation Research, 2010, 174(62):865-869. [19] Mercer J, Mahmoudi M, Bennett M. DNA damage, p53, apoptosis and vascular disease[J]. Mutat Res, 2007, 621(1/2):75-86. [20] Fyhrquist F, Saijonmaa O, Strandberg T. The roles of senescence and telomere shortening in cardiovascular disease[J]. Nat Rev Cardiol, 2013, 10(5):274-283. doi: 10.1038/nrcardio.2013.30 [21] Andreassi MG. DNA damage, vascular senescence and atherosclerosis[J]. J Mol Med(Berl), 2008, 86(9):1033-1043. [22] Gabriels K, Hoving S, Gijbels MJ, et al. Irradiation of existing atherosclerotic lesions increased inflammation by favoring pro-inflammatory macrophages[J]. Radiother Oncol, 2014, 110(3):455-460. [23] Hoving S, Heeneman S, Gijbels MJ, et al. Single-dose and fractionated irradiation promote initiation and progression of atherosclerosis and induce an inflammatory plaque phenotype in ApoE(-/-)mice[J]. Int J Radiat Oncol Biol Phys, 2008, 71(3):848-857. doi: 10.1016/j.ijrobp.2008.02.031 [24] Stewart FA, Heeneman S, Te Poele J, et al. Ionizing radiation accelerates the development of atherosclerotic lesions in ApoE-/- mice and predisposes to an inflammatory plaque phenotype prone to hemorrhage[J]. Am J Pathol, 2006, 168(2):649-658. doi: 10.2353/ajpath.2006.050409 [25] Mitchel RE, Hasu M, Bugden M, et al. Low-dose radiation exposure and protection against atherosclerosis in ApoE(-/-)mice:the influence of P53 heterozygosity[J]. Radiat Res, 2013, 179(2):190-199. [26] Pluder F, Barjaktarovic Z, Azimzadeh O, et al. Low-dose irradiation causes rapid alterations to the proteome of the human endothelial cell line EA. hy926[J]. Radiat Environ Biophys, 2011, 50(1):155-166. doi: 10.1007/s00411-010-0342-9 [27] Wang Y, Scheiber MN, Neumann C, et al. MicroRNA regulation of ionizing radiation-induced premature senescence[J]. Int J Radiat Oncol Biol Phys, 2011, 81(3):839-848. doi: 10.1016/j.ijrobp.2010.09.048 [28] Barjaktarovic Z, Anastasov N, Azimzadeh O, et al. Integrative proteomic and microRNA analysis of primary human coronary artery endothelial cells exposed to low-dose gamma radiation[J]. Radiat Environ Biophys, 2013, 52(1):87-98. doi: 10.1007/s00411-012-0439-4 [29] Yentrapalli R, Azimzadeh O, Barjaktarovic Z, et al. Quantitative proteomic analysis reveals induction of premature senescence in human umbilical vein endothelial cells exposed to chronic low-dose rate gamma radiation[J]. Proteomics, 2013, 13(7):1096-1107. doi: 10.1002/pmic.201200463 [30] Sabatino L, Picano E, Andreassi MG. Telomere shortening and ionizing radiation:a possible role in vascular dysfunction?[J]. Int J Radiat Biol, 2012, 88(11):830-839. doi: 10.3109/09553002.2012.709307 [31] Nagasawa H, Little J B. Induction of sister chromatid exchanges by extremely low doses of alpha-particles[J]. Cancer Res, 1992, 52(22):6394-6396. [32] Shao C, Aoki M, Furusawa Y. Bystander effect in lymphoma cells vicinal to irradiated neoplastic epithelial cells:nitric oxide is involved[J]. J Radiat Res, 2004, 45(1):97-103. doi: 10.1269/jrr.45.97 [33] Xiao L, Liu W, Li J, et al. Irradiated U937 cells trigger inflammatory bystander responses in human umbilical vein endothelial cells through the p38 pathway[J]. Radiat Res, 2014, 182(1):111-121. [34] Wethal T, Nedregaard B, Andersen R, et al. Atherosclerotic lesions in lymphoma survivors treated with radiotherapy[J]. Radiother Oncol, 2014, 110(3):448-454. [35] Yuan Y, Lee S H, Wu S. The role of ROS in ionizing radiation-induced VLA-4 mediated adhesion of RAW264. 7 cells to VCAM-1 under flow conditions[J]. Radiat Res, 2013, 179(1):62-68. -





 下载:
下载: