-
SAPHO综合征由Chamot等[1]于1987年首先提出,即滑膜炎(synovitis)、痤疮(acne)、掌跖脓疱病(palmoplantar pustulosis)、骨肥厚(hyperostosis)和骨炎(osteitis)多种病变的总称,临床较为少见。患者往往因为骨关节疼痛和(或)皮肤病变而就诊于某一专科,临床表现不具特异性,且实验室检查诊断价值有限[2-3],容易漏诊或误诊。18F-FDG PET/CT在该病中的应用国外多见于个例报道[4-9],国内尚未见PET/CT相关报道。本研究分析5例SAPHO综合征患者的PET/CT影像及临床特征,并进行文献复习,以期提高对该病的认识和诊断水平。
-
回顾性分析2011年3月至2013年8月行PET/CT检查的5例SAPHO综合征患者的临床资料和PET/CT影像,其中女性3例、男性2例,年龄59~74岁(平均67.2岁)。前期影像检查后,因诊断困难或需要排除肿瘤而行PET/CT检查。SAPHO综合征的诊断参照kahn标准[10],1例患者进行了左侧锁骨病变组织病理学检查,5例患者均经影像和临床随访6个月以上。
-
通过查阅患者病历及补充询问病史进行采集。记录患者首诊的时间和症状,有无皮肤病变及皮肤病变的变化情况。观察患者红细胞沉降率(erythrocyte sedimentation rate,ESR)、C-反应蛋白(C-reactive protein,CRP)、人类白细胞抗原B27(human leucocyte antigen B27,HLA-B27)、类风湿因子(rheumatoid factor,RF)、可提取性核抗原(extractable nuclear antigen,ENA)多肽抗体谱及抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibodies,ANCA)的检查结果。PET/CT检查时未检测的实验室项目,PET/CT检查后通过随访补充完善。
-
注射显像剂之前,5例患者均禁食6 h以上,空腹血糖介于6.5~8.16 mmol/L。按体重4 MBq/kg静脉注射18F-FDG(放化纯度 > 98%),静息60 min后行PET/CT扫描(Discovery VCT,GE Healthycare),范围从头颅至股骨中段。PET数据使用三维采集模式,每个床位2 min,共6~8个床位,矩阵128×128,迭代法重建,内插2次,子集14个,半高宽为6 mm。CT采集参数:管电压120 kV,管电流80 mA,层厚3.75 mm,层间隔3.27 mm,螺距因子0.984,部分部位使用诊断剂量CT扫描。
由两位有经验的核医学医师共同阅片,意见不同时再次阅片并达成一致。观察病变累及部位,分析受累骨关节CT特征和18F-FDG摄取情况。
-
5例患者以前胸壁和(或)脊柱受累部位疼痛而首次就诊,到PET/CT检查时持续平均时间为3.78年。2例女性患者在就诊期间有伴随皮肤病变(图 1中G),1例女性患者伴右侧肋-胸-锁关节区肿胀。3例患者有ESR和CRP水平升高。1例患者HLA-B27为阳性,4例患者为阴性。5例患者RF、ENA多肽抗体谱和ANCA均为阴性(表 1)。
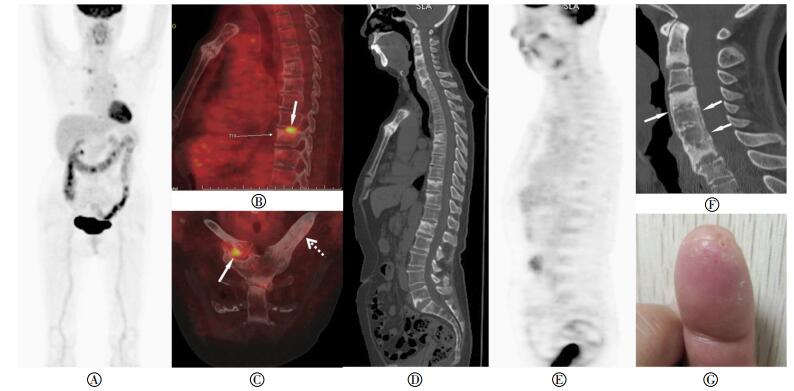
图 1 患者女性,71岁,SAPHO综合征18F-FDG PET/CT图像图中,A为PET最大密度投影图像;B和C为PET/ CT融合图像,PET/CT融合图像见胸10椎体间盘连接面骨质破坏区18F-FDG摄取增高,右侧胸锁关节周围软组织18F-FDG摄取增高(白色实箭头),左侧锁骨骨肥厚及骨炎形成(白色虚箭头);D和E为同平面矢状位CT和PET图像,CT见多个椎体间盘面虫蚀状破坏且周围骨质硬化;PET显示除胸10椎体外,受累胸骨柄体关节及脊柱多数未见明显18F-FDG摄取;F为颈椎矢状位CT图像,多个颈椎椎体骨质硬化,累及大部分或全部椎体,椎间隙变窄、骨性融合,前后纵韧带骨化(白色箭头);G为患者食指脓疱愈合过程中形成深褐色脓点,并结痂、脱屑。
Figure 1. 18-FDG PET/CT images of SAPHO syndrome
患者 性别 年龄
(岁)首诊症状/就诊过程中
是否伴随皮肤病变实验室检查 发病到PET/CT
检查持续时间(年)1 女 71 前胸壁、颈背部疼痛/第1、2远节指骨指腹、大鱼际脓疱病* ESR为34 mm/h,CRP为7.18 mg/L,RF、HLA-B27、ENA多肽抗体谱及ANCA为阴性 11 2 男 64 腰部疼痛/不伴皮肤病变 ESR为14 mm/h,CRP为4.41 mg/L,RF、HLA-B27、ENA多肽抗体谱及ANCA为阴性 3.2 3 女 74 前胸壁疼痛/不伴皮肤病变 ESR为17 mm/h,CRP为4.79 mg/L,RF、HLA-B27、ENA多肽抗体谱及ANCA为阴性 1.8 4 女 68 右胸锁关节区肿胀伴疼痛/第1、2、3远节趾骨、跖骨掌面脓疱病* ESR为23 mm/h,CRP为13.1 mg/L,RF、HLA-B27、ENA多肽抗体谱及ANCA为阴性 2.4 5 男 59 腰部疼痛/不伴皮肤病变 ESR为42 mm/h,CRP为18.56 m//L,HLA-B27阳性,RF、ENA多肽抗体谱及ANCA为阴性 0.5 平均 67.2 - - 3.78ф 表中,患者1曾进行左侧锁骨穿刺活检,病理提示骨髓炎。*患者1和患者4在PET/CT检查时仍表现皮肤脓疱病,并且既往有多次出现并自然消退的情况。ESR:红细胞沉降率;CRP:C-反应蛋白;RF:类风湿因子;HLA-B27:人类白细胞抗原B27;ENA:可提取性核抗原;ANCA:抗中性粒细胞胞浆抗体。ф由于病例数较少,从发病到PET/CT诊断的平均持续时间可能不具有统计学意义。 表 1 5例SAPHO综合征患者临床资料
Table 1. Clinical data of 5 patients with SAPHO syndrome
-
5例患者均有前胸壁和脊柱受累。前胸壁受累包括11个关节(其中胸锁关节7个、胸肋关节2个、胸骨柄体联合2个),1例锁骨骨髓炎和骨肥大。脊柱受累1例涉及单个椎体,其余4例患者涉及多个椎体,共35个椎体受累(共涉及58处间盘侧椎体骨性关节面)。
CT表现为受累前胸壁骨性关节面和椎体间盘侧骨质虫蚀状侵蚀或孔洞状骨质破坏,伴随骨质硬化。此外,关节间隙狭窄、关节骨性融合,关节周围软组织肿胀、增厚和钙化亦可见。PET显像见前胸壁骨关节(6/11)及椎体间盘连接处(17/58)共23处表现18F-FDG摄取增高,SUVmax为1.76~9.74,其余受累骨关节18F-FDG摄取类似或低于邻近同类组织。1例患者CT表现锁骨骨肥大、骨髓炎,PET见18F-FDG摄取,SUVmax为2.68(图 1~图 2)。
-
SAPHO综合征比较少见,结合临床,从病理角度理解其PET/CT表现,有助于深化对此病的认识,并及时、准确作出诊断。
-
SAPHO综合征确切的发病机制仍不清楚。随着认识的不断深化,有多种病因学机制被提出,包括痤疮丙酸杆菌感染、病毒感染、自身免疫性炎性反应、基因学异常和血清阴性脊柱关节病等[2]。低毒力病菌感染(特别是痤疮丙酸杆菌)在一些皮肤和骨关节病灶的细菌培养中得到证实[11]。更多研究认为,病菌感染触发并放大的自身免疫性炎症可能是SAHPO综合征发病的主要机制[2]。动物模型实验显示,18号染色体的基因突变可能与慢性多灶性骨髓炎有关[12],也有家族聚集发病的记录[13]。临床研究显示,SAPHO综合征与血清阴性脊柱关节病有某些共有临床特征,如类风湿因子阴性、骶髂关节和肌腱易受累,可伴发炎性肠病等[2]。
性别分布上女性等于或略多于男性,青年人和成人多见[10, 12, 14]。SAPHO综合征的临床主要表现为受累骨关节疼痛和掌跖脓疱或痤疮病,可伴低热,缓解和复发往往交替出现,多数患者诊断前已持续较长时间[14]。近期文献报道显示,SAPHO综合征从发病到诊断平均间隔时间为3.8年[15]。本研究中的5例患者病情均有反复,从出现症状到PET/CT检查的平均持续时间为3.78年。
需要指出的是,合并皮肤病变并不是SAPHO综合征诊断的必要条件,无皮肤病变并不能排除SAPHO综合征。文献报道,15.3%~80%患者合并皮肤病变[1-2, 11, 14, 16]。皮肤病变可以与骨关节病变同时出现、或发生于骨关节病变之前或之后。本研究5例患者中,2例伴有皮肤病变。实验室检查显示,ESR和CRP水平可能正常或轻度升高[11, 17],少部分患者HLA-B27呈阳性[3, 11]。Aljuhani等[18]报道,41例SAPHO患者中36例进行过HLA-B27水平检测,检测结果均为阴性。本研究病例中,2例患者ESR和CRP水平有轻度升高,1例男性患者HLA-B27为阳性。
无菌性骨炎是SAPHO综合征的标志性特征,这种非特异性炎症不同于细菌感染性炎症[16, 19]。在急性期,表现为以中性粒细胞浸润为主的水肿伴反应性骨形成;疾病进展到中期,表现为以淋巴细胞浸润为主的慢性炎症;后期主要表现为显著骨小梁增生硬化伴明显的骨髓纤维化和轻微炎症[20]。
-
除皮肤病变外,骨及关节受累是SAPHO综合征另一重要特征,主要包括骨炎、骨肥厚、滑膜炎及附着点关节病。成人患者的前胸壁最易受累,包括胸锁关节或第一肋-胸-锁关节、胸骨柄体关节及胸肋关节,约占60%~95%[1-2, 11, 14, 16];其次是脊柱,包括椎体和椎旁软组织,约占32%~52%[11, 16, 21]:再次是骶髂关节,约占13%~52%[11, 16, 19]。四肢周围骨及关节可能受累[2, 16, 19]。本研究5例患者均有前胸壁和脊柱受累,PET/CT未见骶髂关节和其他周围骨关节受累。
影像学检查在SAPHO综合征的诊断中扮演重要角色[2, 22]。病变早期以骨侵蚀为主,后期以骨质增生硬化为主,但两种病变常同时存在。骨质侵蚀往往发生于骨性关节面或椎体间盘连接面,CT表现为关节面下骨质和椎体间盘连接处虫蚀状或小孔洞状骨质侵蚀,破坏灶边缘毛糙。骨肥厚和骨炎是慢性炎性反应分别累及骨皮质和骨髓所形成,其放射学所见为骨质增生硬化,CT表现为骨皮质增厚、均匀或不均匀髓腔硬化和狭窄,骨炎与骨肥厚往往同时出现[14, 16, 22]。本研究观察发现,骨性关节面侵蚀破坏的程度与其周围骨质增生硬化往往呈“不匹配”性改变——骨侵蚀相对较小,而其周围骨硬化范围相对较大,部分骨硬化甚至累及整个椎体,可能与炎症反复和长期慢性过程有关。
本研究病例中,CT发现前胸壁11处骨关节、脊柱涉及35个椎体的58个间盘连接面受累,18F-FDG PET显像仅见前胸壁6处(6/11)、17个椎体间盘连接面(17/58)18F-FDG摄取增高,其余病变代谢类似或低于邻近骨关节。CT能显示轻微骨质病变[15]和PET无18F-FDG摄取增高的病变。病变区18F-FDG摄取增高,可能提示明显的活动性炎症,未见18F-FDG摄取增高的病变区可能提示非活性或慢性炎症。此外,本研究还发现,同一患者多个CT上形态结构及大小类似的骨破坏病灶,表现在18F-FDG摄取程度上差异很大,或许说明活动期SAPHO综合征患者多个病灶可能处于不同的病理阶段。
滑膜和肌肉附着点炎症在CT上表现为关节周围软组织肿胀、增厚,随时间推移韧带或肌腱附着点处钙盐沉积,形成骨桥和韧带骨化,最终导致关节间隙或椎间隙变窄和关节骨性融合[2-3, 16, 21]。18F-FDG PET能显示CT不能显示的滑膜、肌腱或韧带附着点炎症。本研究病例中,1例患者除CT显示胸锁关节软组织肿胀外,PET显示胸锁关节软组织18F-FDG摄取增高。
病变涉及典型部位、有典型的CT表现和伴随皮肤病变时,SAPHO综合征诊断并不困难。但需要与细菌性慢性硬化性骨髓炎、银屑病关节炎、强直性脊柱炎、转移瘤等相鉴别[3, 16, 22]。
18F-FDG PET/CT在SAPHO综合征中的应用优势在于发现单部位CT和MRI容易遗漏的病变,准确显示病变部位和典型CT征象,有助于早期明确诊断,有效排除恶性肿瘤。在一定程度上PET能区别活动性与非活动性病灶,有助于治疗后评价和监测。
SAPHO综合征18F-FDG PET/CT显像和临床分析
18F-FDG PET/CT imaging and clinical features of SAPHO syndrome
-
摘要:
目的 分析滑膜炎、痤疮、掌跖脓疱病、骨肥厚、骨炎(SAPHO)综合征18F-FDG PET/CT影像及临床特征。 方法 回顾性分析2011年3月至2013年8月行PET/CT检查的5例SAPHO综合征患者, 并复习相关文献。诊断依据kahn标准。 结果 (1) 临床分析显示, 5例患者以骨关节疼痛或皮肤病变就诊。2例患者伴随皮肤病变, 3例患者C-反应蛋白和红细胞沉降率水平升高, 1例患者人白细胞抗原B27阳性。5例患者类风湿因子、可提取性核抗原多肽抗体谱和抗中性粒细胞胞浆抗体均为阴性, 平均诊断周期为3.78年。(2)PET/CT影像:5例患者均有前胸壁和脊柱受累。前胸壁受累包括胸锁关节、胸肋关节、胸骨柄体关节, 共11个关节, 1例锁骨肥大和骨髓炎。脊柱受累1例表现涉及单椎体, 其余4例表现涉及多个椎体, 共35个椎体受累, 涉及58个椎体间盘连接处。CT表现为关节面或椎间盘连接面虫蚀状、孔洞状骨质破坏, 周围相对广泛骨质硬化, 硬化甚至涉及整个椎体。部分受累关节间隙变窄, 甚至关节骨性融合。关节周围软组织的肿胀、增厚或钙化亦可被观察到。PET显像见6处前胸壁骨关节(6/11)和17处椎体间盘连接处(17/58)18F-FDG摄取增高, SUVmax为1.76~9.74, 骨硬化区和其余受累骨关节18F-FDG摄取类似或低于邻近正常同类组织。1例患者CT见锁骨肥大、骨髓炎, PET可见18F-FDG摄取, SUVmax为2.68。 结论 前胸壁骨关节和脊柱是SAPHO综合征最常见受累部位, 可伴有或不伴皮肤病变。PET/CT扫描能发现更多隐匿性病灶, 发现活动性炎性病灶并能有效排除肿瘤。 -
关键词:
- 获得性骨肥大综合征 /
- 骨 /
- 正电子发射断层显像术 /
- 体层摄影术, X线计算机 /
- 氟脱氧葡萄糖F18
Abstract:Objective To analyze the 18F-FDG PET/CT imaging and the clinical features of patients with synovitis, acne, pustulosis, hyperostosis, and osteitis(SAPHO) syndrome and improved the diagnosis and awareness level about the disease. Methods This study retrospectively analyzed the PET/CT images and clinical features of five patients(including 3 females and 2 males; age range: 59-74 years old; average age: 67.2 years old) with SAPHO syndrome, as well as reviewed relevant literature. The PET/CT examinations were performed from March 2011 to August 2013. SAPHO syndrome was diagnosed through biopsy, imaging, follow-up results, and according to the Kahe Standard. Results (1) Clinic: Five patients sought treatment in the hospital for bone joint pain or skin lesions. Two of the five patients had no skin lesions, three patients exhibited elevated serum CRP and ESR levels, and one patient was positive for HLA-B27. Rheumatoid factor, extractable nuclear antigen peptide antibody spectrum and antineutrophil cytoplasmic antibodies were negative in 5 patients. The average diagnosis period was 3.78 years. (2)PET/CT imaging: Five patients showed anterior chest wall and spine involvement. Anterior chest wall involvement included 11 bone joints, such as the sternoclavicular joint, sternocostal joint, and sternal-body joint. One patient showed hypertrophy and osteomyelitis of the clavicle. Only one patient showed an involvement of a single vertebra, whereas the others showed an involvement of multiple sites of the spine, including 35 vertebra and 58 vertebral disc connections. The CT revealed the worm-eaten and hole-shaped bone destruction on the articular surface of the anterior chest wall and intervertebral disc junction. They were surrounded by relatively extensive osteosclerosis, even involving the entire vertebral body. The partially involved joints also showed joint space narrowing and even joint bone fusion. In addition, swelling, thickening, and calcification of periarticular soft tissues were observed. The PET revealed that only a part of the involved bone joints of anterior chest wall lesions(6/11) and intervertebral disc junctions(17/58) exhibited an increased 18F-FDG uptake, and the SUVmax ranged from 1.76 to 9.74. 18F-FDG uptake of the other involved bone joint lesions was similar or lower than that of the adjacent similar organization. The clavicle with hypertrophy and osteomyelitis in the patient showed an 18F-FDG uptake SUVmax of 2.68. Conclusion The anterior chest wall and spine are the common sites of involvement in SAPHO syndrome patients with or without skin lesions. 18F-FDG PET/CT scan can reveal more occult lesions and active inflammation as well as effectively exclude neoplastic lesions. -
图 1 患者女性,71岁,SAPHO综合征18F-FDG PET/CT图像图中,A为PET最大密度投影图像;B和C为PET/ CT融合图像,PET/CT融合图像见胸10椎体间盘连接面骨质破坏区18F-FDG摄取增高,右侧胸锁关节周围软组织18F-FDG摄取增高(白色实箭头),左侧锁骨骨肥厚及骨炎形成(白色虚箭头);D和E为同平面矢状位CT和PET图像,CT见多个椎体间盘面虫蚀状破坏且周围骨质硬化;PET显示除胸10椎体外,受累胸骨柄体关节及脊柱多数未见明显18F-FDG摄取;F为颈椎矢状位CT图像,多个颈椎椎体骨质硬化,累及大部分或全部椎体,椎间隙变窄、骨性融合,前后纵韧带骨化(白色箭头);G为患者食指脓疱愈合过程中形成深褐色脓点,并结痂、脱屑。
Figure 1. 18-FDG PET/CT images of SAPHO syndrome
表 1 5例SAPHO综合征患者临床资料
Table 1. Clinical data of 5 patients with SAPHO syndrome
患者 性别 年龄
(岁)首诊症状/就诊过程中
是否伴随皮肤病变实验室检查 发病到PET/CT
检查持续时间(年)1 女 71 前胸壁、颈背部疼痛/第1、2远节指骨指腹、大鱼际脓疱病* ESR为34 mm/h,CRP为7.18 mg/L,RF、HLA-B27、ENA多肽抗体谱及ANCA为阴性 11 2 男 64 腰部疼痛/不伴皮肤病变 ESR为14 mm/h,CRP为4.41 mg/L,RF、HLA-B27、ENA多肽抗体谱及ANCA为阴性 3.2 3 女 74 前胸壁疼痛/不伴皮肤病变 ESR为17 mm/h,CRP为4.79 mg/L,RF、HLA-B27、ENA多肽抗体谱及ANCA为阴性 1.8 4 女 68 右胸锁关节区肿胀伴疼痛/第1、2、3远节趾骨、跖骨掌面脓疱病* ESR为23 mm/h,CRP为13.1 mg/L,RF、HLA-B27、ENA多肽抗体谱及ANCA为阴性 2.4 5 男 59 腰部疼痛/不伴皮肤病变 ESR为42 mm/h,CRP为18.56 m//L,HLA-B27阳性,RF、ENA多肽抗体谱及ANCA为阴性 0.5 平均 67.2 - - 3.78ф 表中,患者1曾进行左侧锁骨穿刺活检,病理提示骨髓炎。*患者1和患者4在PET/CT检查时仍表现皮肤脓疱病,并且既往有多次出现并自然消退的情况。ESR:红细胞沉降率;CRP:C-反应蛋白;RF:类风湿因子;HLA-B27:人类白细胞抗原B27;ENA:可提取性核抗原;ANCA:抗中性粒细胞胞浆抗体。ф由于病例数较少,从发病到PET/CT诊断的平均持续时间可能不具有统计学意义。 -
[1] Chamot AM, Benhamou CL, Kahn MF, et al. Acne-pustulosis-hyperostosis-osteitis syndrome. Results of a National survey. 85 cases[J]. Rev Rhum Mal Osteoartic, 1987, 54(3):187-196. [2] Boutin RD, Resnick D. The SAPHO syndrome:an evolving concept for unifying several idiopathic disorders of bone and skin[J]. AJR Am J Roentgenol, 1998, 170(3):585-591. doi: 10.2214/ajr.170.3.9490935 [3] Salles M, Olive A, Perez-Andres RA, et al. The SAPHO syndrome:a clinical and imaging study[J]. Clin Rheumatol, 2011, 30(2):245-249. [4] Pichler R, Weiglein K, Schmekal B, et al. Bone scintigraphy using Tc-99m DPD and F18-FDG in a patient with SAPHO syndrome[J]. Scand J Rheumatol, 2003, 32(1):58-60. [5] Kohlfuerst S, Igerc I, Lind P. FDG PET helpful for diagnosing SAPHO syndrome[J]. Clin Nucl Med, 2003, 28(10):838-839. doi: 10.1097/01.rlu.0000090943.11941.26 [6] Inoue K, Yamaguchi T, Ozawa H, et al. Diagnosing active inflammation in the SAPHO syndrome using 18FDG-PET/CT in suspected metastatic vertebral bone tumors[J]. Ann Nucl Med, 2007, 21(8):477-480. [7] Takeuchi K, Matsusita M, Takagishi K. A case of SAPHO(synovitis-acne-pustulosis-hyperostosis-osteomyelitis) syndrome in which[18F] fluorodeoxyglucose positron emission tomography was useful for differentiating from multiple metastatic bone tumors[J]. Mod Rheumatol, 2007, 17(1):67-71. [8] Patel CN, Smith JT, Rankine JJ, et al. F-18 FDG PET/CT can help differentiate SAPHO syndrome from suspected metastatic bone disease[J]. Clin Nucl Med, 2009, 34(4):254-257. [9] Abuhid IM, Silva LC, Martins GP, et al. Diagnosing SAPHO syndrome in suspected metastatic bone tumors[J]. Clin Nucl Med, 2010, 35(3):172-174. [10] Kahn MF. Psoriatic arthritis and synovitis, acne, pustulosis, hyperostosis, and osteitis syndrome[J]. Curr Opin Rheumatol, 1993, 5(4):428-435. doi: 10.1097/00002281-199305040-00005 [11] Colina M, Govoni M, Orzincolo C, et al. Clinical and radiologic evolution of synovitis, acne, pustulosis, hyperostosis, and osteitis syndrome:a single center study of a cohort of 71 subjects[J]. Arthritis Rheum, 2009, 61(6):813-821. doi: 10.1002/art.24540 [12] Ferguson PJ, Bing X, Vasef MA, et al. A missense mutation in pstpip2 is associated with the murine autoinflammatory disorder chronic multifocal osteomyelitis[J]. Bone, 2006, 38(1):41-47. doi: 10.1016/j.bone.2005.07.009 [13] Tlougan BE, Podjasek JO, O'haver J, et al. Chronic recurrent multifocal osteomyelitis(CRMO) and synovitis, acne, pustulosis, hyperostosis, and osteitis(SAPHO)syndrome with associated neutrophilic dermatoses:a report of seven cases and review of the literature[J]. Pediatr Dermatol, 2009, 26(5):497-505. doi: 10.1111/j.1525-1470.2009.00984.x [14] Earwaker JW, Cotten AS. SAPHO:Syndrome or concept? Imaging findings[J]. Skeletal Radiol, 2003, 32(6):311-327. doi: 10.1007/s00256-003-0629-x [15] Witt M, Meier J, Hammitzsch A, et al. Disease burden, disease manifestations and current treatment regimen of the SAPHO syndrome in Germany:results from a nationwide patient survey[J]. Semin Arthritis Rheum, 2014, 43(6):745-750. doi: 10.1016/j.semarthrit.2013.10.010 [16] Cotten A, Flipo RM, Mentre A, et al. SAPHO syndrome[J]. RadioGraphics, 1995, 15(5):1147-1154. doi: 10.1148/radiographics.15.5.7501856 [17] Mann B, Shaerf DA, Sheeraz A, et al. SAPHO syndrome presenting as widespread bony metastatic disease of unknown origin[J]. Rheumatol Int, 2012, 32(2):505-507. doi: 10.1007/s00296-010-1742-5 [18] Aljuhani F, Tournadre A, Tatar Z, et al. The SAPHO syndrome:a single-center study of 41 adult patients[J]. J Rheumatol, 2015, 42(2):329-334. doi: 10.3899/jrheum.140342 [19] Maugars Y, Berthelot JM, Ducloux JM, et al. SAPHO syndrome:a followup study of 19 cases with special emphasis on enthesis involvement[J]. J Rheumatol, 1995, 22(11):2135-2141. [20] Reith JD, Bauer TW, Schils JP. Osseous manifestations of SAPHO(synovitis, acne, pustulosis, hyperostosis, osteitis)syndrome[J]. Am J Surg Pathol, 1996, 20(11):1368-1377. [21] Laredo JD, Vuillemin-Bodaghi V, Boutry N, et al. SAPHO syndrome:MR appearance of vertebral involvement[J]. Radiology, 2007, 242(3):825-831. [22] Depasquale R, Kumar N, Lalam RK, et al. SAPHO:what radiologists should know[J]. Clin Radiol, 2012, 67(3):195-206. -





 下载:
下载: