-
电离辐射会直接或间接产生过多的活性氧,最终造成细胞功能异常、死亡和基因突变等[1]。核转录因子E2相关因子2(nuclear factor-erythroid 2 p45-related factor 2,Nrf2)在细胞抗氧化保护作用中起着中枢调节作用[2]。其在电离辐射引起的应激反应中起到非常重要的作用[3]。姜油树脂是一种以CO2超临界萃取法于姜科植物中提取出来的一种酚类混合物。已有研究证实,其中的成分之一姜黄素可以抑制紫外线导致的氧化损伤[4]。有研究指出,姜黄素发挥药理作用的重要分子机制为激活Nrf2,进而活化其下游一系列抗氧化酶及Ⅱ相解毒酶,如血红素加氧酶(heme oxygenase-1,HO1)、还原型辅酶Ⅰ醌类氧化还原酶[NAD(P)H:quinone oxidoreductase 1,NQO1]等,这些酶类发挥作用,成为电离辐射自由基清除的有效途径[5]。本研究通过探讨姜油树脂对电离辐射所造成间充质干细胞(mesenchymal stem cells,MSCs)中Nrf2及其下游靶基因的表达影响来进一步明确其分子机制。
-
Nrf2抗体、NQO1抗体、HO1抗体(美国Abcam公司),鼠抗、β-tublin、兔抗(武汉博士德公司)。Trizol试剂(美国Invitrogen公司),逆转录试剂盒(日本TaKaRa公司),FastStart Universal SYBR Green Master(Rox)(瑞士Roche公司)。MTT(上海碧云天生物技术有限公司)。MSCs用含10%胎牛血清(美国Gibco公司)的DMEM-F12培养基于37℃、5% CO2饱和湿度恒温培养箱中传代培养。应用放射源为137Cs γ射线(Gammacell-40,加拿大原子能有限公司)的辐射装置对MSCs进行照射,剂量率为1.02 Gy/min,源靶距15 cm。依据本实验室的前期研究结果,采用的吸收剂量为4 Gy。
-
取指数生长期细胞进行下游试验,将细胞悬液浓度调整为3×104个/ml,以每孔100 μl接种于96孔板中,待细胞贴壁后,换为含0、10-6、10-5、10-4、10-3 g/ml姜油树脂的新鲜培养基,每组设12个复孔,继续培养24、48、72 h后每孔加入10 μl MTT,4 h后吸弃培养基,每孔加入150 μl二甲基亚砜,置于微型振荡器震荡混匀10 min,采用酶标仪于492 nm波长处测定各孔吸光度(A)值。细胞存活率(%)=实验组A值/对照组A值×100%,实验重复3次,取平均值。
-
MSCs分为2组:未照射组和照射组,这两组又分别分为4个亚组,依次为0(不作任何处理)、10-6、10-5、10-4 g/ml姜油树脂处理组和0(单纯照射组)、10-6、10-5、10-4 g/ml姜油树脂处理联合照射组。用处于指数期的MCSs进行试验,采用Trizol试剂提取总RNA,测定RNA浓度,之后使用逆转录试剂盒,将mRNA逆转录为cDNA,然后使用实时PCR试剂Rox进行PCR,25 μl体系。以GAPDH作为内参基因来校正目的基因的表达,引物由上海生工生物有限公司合成(表 1)。
基因名称 上游引物序列 下游引物序列 Nrf2 5′TCAGCGACGGAAAGAGTATGA 3′ 5′CCACTGGTTTCTGACTGGATGT 3′ HO1 5′AGAGGGAATTCTCTTGGCTGGCTT3′ 5′ATGCCATAGGCTCCTTCCTCCTTT3′ NQO1 5′AGGAAGAGCTAATAAATCTCTTCTTTGCTG3′ 5′TCATATTGCAGATGTACGGTGTGGATTTAT3′ GAPDH 5′TGACTTCAACAGCGACACCCA3′ 5′CACCCTGTTGCTGTAGCCAAA3′ 表 1 实时PCR反应所用引物
Table 1. Primers in real time-PCR
-
MSCs分为2组:未照射组和照射组,这两组又分别分为3个亚组,依次为0(不作任何处理)、10-5、10-4 g/ml姜油树脂处理组和0(单纯照射组)、10-5、10-4 g/ml姜油树脂联合照射组。在24 h处理的实验条件下,收集指数生长期细胞,每1×106个MSCs中加入100 μl蛋白裂解液,于4℃下裂解30 min,之后13000 r/min离心10 min(离心半径为7 cm),上清收集于1.5 ml EP管中,采用二喹啉甲酸法进行蛋白定量。取25 μg蛋白进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,通过湿转的转膜方法将蛋白样本转移至聚偏二氟乙烯膜上,设置110 V,130 min,含1%牛血清白蛋白的封闭液封闭1 h,一抗4℃下过夜,TBST洗膜5次,每次5 min,加入对应二抗室温孵育1 h,室温TBST洗膜4次,每次10 min,增强化学发光法检测,凝胶成像系统显影。
-
采用SPSS 19.0统计学软件进行分析,各组数据用x±s表示,两组数据比较采用两独立样本t检验,P<0.05表示差异具有统计学意义。
-
姜油树脂对MSCs的细胞毒性见表 2,10-6、10-5、10-4 g/ml浓度的姜油树脂在72 h内对MSCs没有细胞毒性(24 h: t=7.12、8.09、12.51, P>0.05; 48 h: t=3.78、6.18、2.93, P>0.05; 72 h: t=1.86、2.97、3.75, P>0.05),而10-3 g/ml浓度的姜油树脂从24 h开始会显著降低MSCs的细胞活力(t=56.71、60.13、78.09,P<0.01)。所以后续实验放弃使用对细胞具有毒性的剂量浓度10-3 g/ml姜油树脂。
姜油树脂浓度(g/ml) 时间(h) 24 48 72 0 100.00 100.00 100.00 10-6 108.10±3.84 100.80±4.87 98.53±0.66 10-5 109.90±5.01 103.40±6.38 97.51±4.44 10-4 118.90±5.12 98.14±4.09 97.15±5.68 10-3 24.18±4.06 20.68±4.17 15.13±1.23 表 2 姜油树脂对间充质干细胞存活率的影响(%,x±s)
Table 2. Effects of ginger oleoresin on mesenchymal stem cells viability(%, x±s)
-
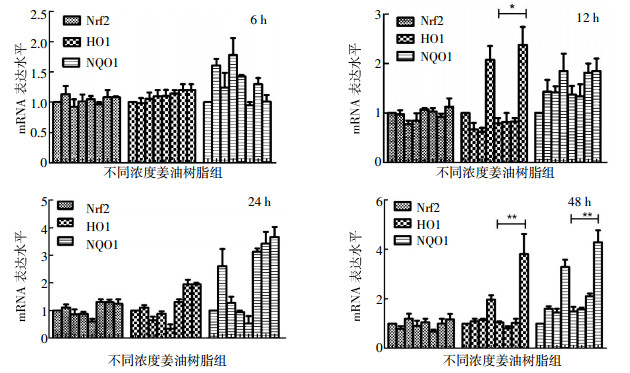
用姜油树脂分别处理6、12、24、48 h后进行实时PCR,结果如图 1。4个时间段中的Nrf2基因的mRNA水平变化不是很明显,但在24 h时,10-5、10-4 g/ml姜油树脂联合照射组中下游的HO1、NQO1的mRNA表达水平分别高于10-5、10-4 g/ml姜油树脂处理组(HO1:t=14.58、13.86,P<0.05;NQO1:t=25.23、27.65,P<0.01)和单纯照射组(HO1:t=19.89,P<0.05;NQO1:t=19.59,P<0.05),差异具有统计学意义。
图 1 在照射和未照射情况下,不同浓度的姜油树脂处理后对各基因转录水平的影响 图中,8个组别依次为0(不作任何处理)、10-6、10-5、10-4 g/ml姜油树脂处理组和0(单纯照射组)、10-6、10-5、10-4 g/ml姜油树脂处理联合照射组;Nrf2:核转录因子EI相关因子2;HO1:血红素加氧酶;NQO1:还原型辅酶Ⅰ醌类氧化还原酶;*t=13.57,P<0.05;**t=39.12、42.16,P<0.01。
Figure 1. Expression level of genes after different ginger oleoresin treats with or without radiation
-
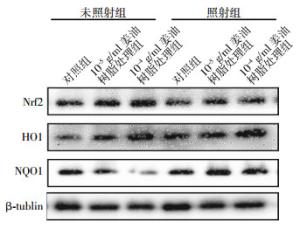
如图 2,其中以骨架蛋白β-tublin作为内参蛋白,各组间蛋白水平的变化与转录水平的变化一致:Nrf2蛋白变化不是很明显,而10-5、10-4 g/ml姜油树脂联合照射组中的HO1、NQO1蛋白水平明显升高。
-
电离辐射一方面会直接导致生物大分子的损伤,造成DNA链的断裂、蛋白酶失活或者破坏细胞内膜的结构,另一方面射线会间接作用于水分子,继而作用于生物大分子,引起其物理和化学变化,最终导致细胞死亡[6-7]。电离辐射会产生大量的活性氧,因此,抗氧化一直是辐射防护研究的主要方向。
有研究表明,在体内多种细胞中,Nrf2信号通路具有抗氧化应激损伤作用[8]。正常条件下,Nrf2和位于胞浆中的抑制蛋白Kelch样环氧氯丙烷相关蛋白1一起被固定在胞质内,通过泛素连接酶被泛素化,而维持在一个较低的表达水平[9-10]。当细胞受到一些外源或内源性的氧化刺激时,Nrf2发生变构或者被磷酸化而活化,转移至细胞核内与抗氧化反应元件结合,通过这种顺式作用启动其下游抗氧化酶及Ⅱ相解毒酶的表达[11-12]。上述研究绝大多数都集中在Nrf2的抗氧化方面,而针对辐射防护的研究较少,因此,本研究的重点在于探索姜油树脂对辐射后MSCs Nrf2基因及其靶基因表达的影响,初步明确姜油树脂辐射防护作用的机理,为其作为天然辐射防护剂提供理论依据。
为研究姜油树脂在MSCs受到辐射损伤后能否激活Nrf2通路,本研究在确定了对MSCs无毒性作用的姜油树脂浓度的基础上,将姜油树脂与MSCs共培养后进行照射,照后不同时间观察Nrf2及其下游基因的表达水平,结果发现,姜油树脂并未对Nrf2的转录和表达产生明显影响,而对其下游靶基因的表达产生了明显的促进作用。众所周知,电离辐射可以导致细胞内活性氧明显增加,进而造成细胞的氧化损伤。姜油树脂明显促进了HO1和NQO1等抗氧化基因的激活和表达,将明显降低辐射诱导的氧化损伤,进而产生辐射防护作用。
综上所述,姜油树脂虽然未对Nrf2的表达产生影响,但可能对Nrf2在细胞核内或核外的分布产生了影响,即发生了由胞浆到细胞核内的移位过程,进而激活其下游抗氧化靶基因的转录和翻译,发挥其抗氧化作用。上述假说有待在进一步的实验研究中进行验证。
姜油树脂对辐射后间充质干细胞Nrf2及其靶基因表达的影响
Ginger oleoresin induced expression of Nrf2 and its target genes in mesenchymal stem cells after radiation
-
摘要:
目的 探索姜油树脂对辐射后间充质干细胞中核转录因子E2相关因子2(Nrf2)及其下游靶基因表达变化的影响。 方法 采用MTT、实时PCR以及Western Blot检测不同浓度姜油树脂、不同时间点处理后Nrf2及其下游靶基因血红素加氧酶(HO1)和还原型辅酶Ⅰ醌类氧化还原酶(NQO1)的表达变化。 结果 姜油树脂对辐射后间充质干细胞中Nrf2基因本身的影响并不大,但在给予姜油树脂24 h后,10-5和10-4 g/ml姜油树脂联合照射组下游靶基因HO1和NQO1的mRNA及蛋白水平均有所上升。 结论 姜油树脂不影响Nrf2的转录和表达,但可提高其下游抗氧化基因的表达,发挥辐射防护作用。 -
关键词:
- 姜油树脂 /
- 辐射 /
- 核转录因子E2相关因子2 /
- 血红素加氧酶 /
- 还原型辅酶Ⅰ醌类氧化还原酶
Abstract:Objective To explore ginger oleoresin induced the change of expression of nuclear factor-erythroid 2 p45-related factor 2(Nrf2) and its target genes in mesenchymal stem cells after radiation damage. Methods A combined approach include MTT, real time-PCR and Western blot were used to test the changes on expression level of Nrf2 and its downstream genes, including heme oxygenase-1(HO1) and NAD(P)H: quinone oxidoreductase 1(NQO1). Results The results showed that ginger oleoresin has little effect on Nrf2. However, the expression of HO1 and NQO1 increased in the 10-5, 10-4 g/ml ginger oleoresin group when incubated 24 h after radiation. Conclusions Ginger oleoresin has no effect on the transcription and expression of Nrf2, but can increase the expression of the target antioxidant genes of Nrf2. Ginger oleoresin may be a potential protective agent in the future. -
图 1 在照射和未照射情况下,不同浓度的姜油树脂处理后对各基因转录水平的影响 图中,8个组别依次为0(不作任何处理)、10-6、10-5、10-4 g/ml姜油树脂处理组和0(单纯照射组)、10-6、10-5、10-4 g/ml姜油树脂处理联合照射组;Nrf2:核转录因子EI相关因子2;HO1:血红素加氧酶;NQO1:还原型辅酶Ⅰ醌类氧化还原酶;*t=13.57,P<0.05;**t=39.12、42.16,P<0.01。
Figure 1. Expression level of genes after different ginger oleoresin treats with or without radiation
表 1 实时PCR反应所用引物
Table 1. Primers in real time-PCR
基因名称 上游引物序列 下游引物序列 Nrf2 5′TCAGCGACGGAAAGAGTATGA 3′ 5′CCACTGGTTTCTGACTGGATGT 3′ HO1 5′AGAGGGAATTCTCTTGGCTGGCTT3′ 5′ATGCCATAGGCTCCTTCCTCCTTT3′ NQO1 5′AGGAAGAGCTAATAAATCTCTTCTTTGCTG3′ 5′TCATATTGCAGATGTACGGTGTGGATTTAT3′ GAPDH 5′TGACTTCAACAGCGACACCCA3′ 5′CACCCTGTTGCTGTAGCCAAA3′ 表 2 姜油树脂对间充质干细胞存活率的影响(%,x±s)
Table 2. Effects of ginger oleoresin on mesenchymal stem cells viability(%, x±s)
姜油树脂浓度(g/ml) 时间(h) 24 48 72 0 100.00 100.00 100.00 10-6 108.10±3.84 100.80±4.87 98.53±0.66 10-5 109.90±5.01 103.40±6.38 97.51±4.44 10-4 118.90±5.12 98.14±4.09 97.15±5.68 10-3 24.18±4.06 20.68±4.17 15.13±1.23 -
[1] 郭月凤, 张慧芳, 杨彪, 等.急性辐射损伤的生物剂量估算方法[J].辐射研究与辐射工艺学报, 2012, 30: 135-141.
[2] Que LL, Wang HX, Cao BS, et al. The regulation and functions of transcription factor Nrf2 in cancer chemoprevention and chemoresistance[J]. J Chin Pharm Sci, 2011, 20(1): 5-19. [3] Kannan S, Jaiswal AK. Low and high dose UVB regulation of transcription factor NF-E2-Related factor 2[J]. Cancer Res, 2006, 66(17): 8421-8429. doi: 10.1158/0008-5472.CAN-06-1181 [4] Phillips J, Moore-Medlin T, Sonavane K, et al. Curcumin inhibits UV radiation-induced skin cancer in SKH-1 mice[J]. Otolaryngol Head Neck Surg, 2013, 148(5): 797-803. doi: 10.1177/0194599813476845 [5] Singh S, Khar A. Biological effects of curcumin and its role in cancer chemoprevention and therapy[J]. Anticancer Agents Med Chem, 2006, 6(3): 259-270. [6] 王崇道, 强亦忠.电离辐射所致自由基对机体的损伤与自由基清除剂的研究[J].中华放射医学与防护杂志, 2002, 22(6): 461-463. doi: 10.3760/cma.j.issn.0254-5098.2002.06.034
[7] Wu JL, Wu C, Lei C, et al. Chemical- and irradiation-induced mutants of indica rice IR64 for forward and reverse genetics[J]. Plant Mol Biol, 2005, 59(1): 85-97. doi: 10.1007/s11103-004-5112-0 [8] Shibata T, Kokubu A, Gotoh M, et al. Genetic alteration of Keap1 confers constitutive Nrf2 activation and resistance to chemotherapy in gallbladder cancer[J]. Gastroenterology, 2008, 135(4): 1358-1368. [9] Liew PL, Hsu CS, Liu WM. Prognostic and predictive Values of Nrf2. Keap1, p16 and E-cadherin expression in ovarian epithelial carcinoma[J]. Int J Clin Exp Pathol, 2015, 8(5): 5642-5649. [10] Lee YJ, Lee DM, Lee SH. Nrf2 expression and apoptosis in quercetin-treated malignant mesothelioma cells[J]. Mol Cells, 2015, 38(5): 416-425. doi: 10.14348/molcells.2015.2268 [11] Kanamori M, Higa T, Sonoda Y, et al. Activation of the NRF2 pathway and its impact on the prognosis of anaplastic glioma patients[J]. Neuro Oncol, 2015, 17(4): 555-565. doi: 10.1093/neuonc/nou282 [12] Brown RH, Reynolds C, Brooker A, et al. Sulforaphane improves the bronchoprotective response in asthmatics through Nrf2-mediated gene pathways[J]. Respir Res, 2015, 15(16): 106. -





 下载:
下载: