-
肿瘤的发生是多基因、多因素共同作用的复杂生物学过程,迄今为止还不清楚各种肿瘤的明确病因。研究表明,DNA损伤修复的能力在一定程度上决定了肿瘤的发生[1-2]。及时、有效的DNA修复,有利于维持生物体基因组的完整性和抑制肿瘤的发生。人类X射线修复交叉互补基因(X-ray repair cross complementary gene,XRCC)家族最初因其具有对哺乳动物细胞电离辐射损伤的防护作用而被发现,是辐射损伤后DNA修复不可缺少的基因[3]。XRCC2是XRCC家族成员之一,通过DNA同源重组修复途径参与DNA双链断裂重接。本研究采用XRCC2基因沉默结肠癌细胞系,观察XRCC2基因沉默对结肠癌细胞体外增殖能力的影响,阐明XRCC2基因沉默与结肠癌细胞辐射敏感性的关系。
-
DMEM/F12培养基由美国Gibco公司生产,XRCC2 shRNA质粒、control shRNA质粒、嘌呤酶素和鼠抗人XRCC2单克隆抗体由上海Santa Cruz公司生产,Lipofectamine 2000由美国Invitrogen公司生产,MTT和碘化丙啶由Amressco公司生产,Annexin V-FITC kit由美国BD公司生产,X射线照射源由美国Rad Source公司生产,酶标仪为美国Thermo公司产品,流式细胞仪由美国Beckman公司生产。
-
人结肠癌细胞系T84细胞(由中国医学科学院基础医学研究所细胞资源中心提供)培养于含10%小牛血清、青霉素105 μ/L、链霉素100 mg/L的DMEM/F12培养基中,在37℃含5%CO2饱和湿度条件下培养。实验分组:对照组(T84细胞不接受任何处理)、shRNA-SC组[T84细胞转染control shRNA质粒,作为阴性干扰对照,control shRNA质粒(μg):Lipofectamine 2000(μl)为1:4]、shRNA-XRCC2组(稳定表达XRCC2基因沉默的T84/XRCC2-shRNA细胞系)、8 Gy组(T84细胞接受8 Gy X射线照射,剂量率为0.99 Gy/min)和shRNA-XRCC2+8 Gy组(T84/XRCC2-shRNA细胞系接受8 Gy X射线照射,剂量率为0.99 Gy/min)。
-
将(0.5~2)×105个人结肠癌T84细胞悬浮于500 μl不含抗生素的培养基中,接种至24孔培养板。待细胞处于对数生长期时,将1 μg XRCC2 shRNA质粒与20 μl Lipofectamine 2000混合孵育,48 h后加入含嘌呤酶素(10 μg/ml)的培养基筛选稳定转染的细胞。14 d后将细胞接种于96孔板中,单克隆化,在倒置显微镜下筛选稳定表达克隆,扩大培养,建立稳定表达XRCC2基因沉默的T84/XRCC2-shRNA细胞系。
-
将1×106个人结肠癌T84细胞接种于100 mm培养皿中,以蛋白裂解液裂解细胞。采用二辛宁可酸蛋白定量检测试剂盒(武汉博士德生物工程公司)测定蛋白浓度。蛋白样品经十二烷基磺酸钠-聚丙烯酰胺胶电泳后转膜,封闭液封闭2 h;加鼠抗人XRCC2单克隆抗体(1:1000稀释,上海Santa Cruz公司),4℃孵育过夜,加入辣根过氧化物酶标记的山羊抗鼠IgG抗体(1:3000稀释,上海Santa Cruz公司)室温孵育1 h,用增强化学发光法检测蛋白表达,同时以β-actin抗体(上海Santa Cruz公司)为内参。用Quantity One version 4.6.2软件分析条带灰度值。
-
取对数生长期的结肠癌T84细胞,胰酶消化后计数,用DMEM/F12培养基重悬细胞,调整细胞浓度为1×104个/ml。将细胞接种在96孔培养板中,每孔接种100 μl(即1×103个细胞),每组设5个平行孔,在37℃、5% CO2条件下培养。在培养的第1、3、5和7天,加入5 μg/ml MTT液20 μl,孵育4 h后加入150 μl二甲基亚砜(天津大学科威公司),测定570 nm处的吸光度(A)值,计算细胞生长抑制率:抑制率=(实验组A值-对照组A值)/对照组A值×100%。
-
取对数生长期的结肠癌T84细胞,胰酶消化后计数,用DMEM/F12培养基重悬细胞。将800个细胞接种于55 mm培养皿中,每组设3个平行皿,置于37℃、5%CO2孵箱中培养。每隔2~3 d换液一次,细胞培养到第14天弃去培养液,加入新配制的固定液,即甲醇:冰醋酸=3:1,固定5 min。弃去固定液,待稍干燥后加入5%结晶紫染色液(天津大学科威公司),当克隆着色足够时用水冲洗残余的染色液。在显微镜下进行克隆计数,以每团细胞数大于50个作为一个克隆。
-
取对数生长期结肠癌T84细胞,胰酶消化后计数,按每孔1×105个细胞接种于6孔板内。待细胞贴壁后进行8 Gy X射线照射。培养24 h后采用胰酶消化法收集细胞,并用PBS缓冲液洗涤。将细胞用预冷的70%乙醇固定1 h,-20℃保存。细胞检测前用PBS缓冲液洗涤,离心后将细胞悬于500 μl碘化丙啶(50 μg/ml)溶液中,4℃避光反应30 min,上流式细胞仪488 nm波长检测细胞周期分布。
-
取对数生长期结肠癌T84细胞,胰酶消化后计数,按每孔1×105个细胞接种于6孔板内。待细胞贴壁后进行8 Gy照射。培养24 h后采用胰酶消化法收集细胞,用PBS缓冲液洗2次。加入500 μl结合缓冲液[含10 μl Annexin V-FITC kit(0.5 μg/ml)和5 μl碘化丙啶(5μg/ml)],室温避光反应30 min,上流式细胞仪488 nm波长检测细胞凋亡。
-
所有数据均用x±s表示。采用SPSS 16.0统计学软件进行分析,各组间比较采用独立样本t检验,P < 0.05表示差异有统计学意义。
-
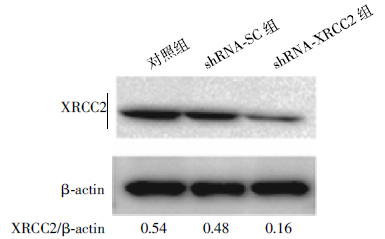
如图 1所示,稳定转染的shRNA-XRCC2细胞中XRCC2蛋白表达明显下降,与对照组细胞和shRNA-SC组细胞相比,约分别减少了70%和65%。结果表明,XRCC2 shRNA质粒转染T84细胞后,有效地抑制了XRCC2蛋白的表达,成功建立了稳定的XRCC2基因沉默的结肠癌细胞系(T84/ XRCC2-shRNA)。
-
对照组和shRNA-SC组细胞稳定生长,生长的速度基本一致;而shRNA-XRCC2组细胞于培养的第3天开始,与对照组和shRNA-SC组细胞相比,增殖速度明显减慢。不同培养时间结肠癌T84细胞的生长抑制率显示,从培养的第3天开始,shRNA-XRCC2组细胞生长抑制率一直平稳地维持在50%左右,明显低于shRNA-SC组(t=17.62、12.84、9.24,P < 0.05),见表 1。结果表明,沉默XRCC2表达有效地抑制了体外结肠癌T84细胞的增殖。
培养时间(d) 抑制率 shRNA-SC shRNA-XRCC2 1 1.1±0.2 5.3±1.6 3 5.3±1.5 46.7±8.0 5 14.8±3.5 49.9±8.8 7 22.1±4.1 49.7±9.5 注:表中,XRCC2:X射线修复交叉互补基因2。 表 1 不同培养时间结肠癌T84细胞的生长抑制率(%,x±s)
Table 1. The growth inhibition rate at different culture time of colorectal cancer T84 cells(%, x±s)
-
从图 2可见,对照组和shRNA-SC组细胞克隆形成数目基本一致,分别为498.5±43.5和512.3±38.5;shRNA-XRCC2组和8 Gy组的细胞克隆形成数目明显减少,分别为422.7±43.4和389.5±24.4,与对照组细胞相比,差异有统计学意义(t=3.02、5.35,P均 < 0.05);shRNA-XRCC2+8 Gy组细胞克隆形成数最少(223.3±32.9),与对照组细胞克隆形成数相比,两者之间的差异有统计学意义(t=12.34,P < 0.01),与shRNA-XRCC2组和8 Gy组相比,差异有统计学意义(t=8.96、9.92,P均 < 0.01)。结果表明,XRCC2基因沉默联合辐射降低了结肠癌T84细胞的克隆形成能力。
-
从流式分析结果可见,8 Gy X射线照射后,shRNA-XRCC2组停留在G2/M期的细胞增加(38.51±4.15)%,与对照组和shRNA-SC组相比,差异有统计学意义(t=3.92、5.49,P均 < 0.05),而G0/G1期和S期细胞减少;shRNA-XRCC2组细胞的凋亡率最高,达到(33.16±2.69)%,约是对照组和shRNA-SC组的5倍(t=15.31、12.78,P均 < 0.01)(表 2)。结果表明,XRCC2基因沉默联合辐射促使结肠癌T84细胞主要阻滞在G2/M期,大量细胞发生细胞凋亡。
组别 细胞周期 细胞凋亡率 G0/G1 G2/M S 对照组 48.83±1.61 26.20±3.50 24.97±4.82 6.90±1.40 shRNA-SC组 67.58±1.16 24.64±1.38 7.78±0.42 7.76±2.15 shRXNRAC-C2组 41.13±7.85 38.51±4.15 20.36±11.47 33.16±2.69 注:表中,XRCC2:X射线修复交叉互补基因2。 表 2 XRCC2基因沉默联合辐射后T84细胞的细胞周期和细胞凋亡率(%,x±s)
Table 2. The cell cycle distribution and cell apoptosis of T84 cells of silencing XRCC2 gene combined with radiation(%, x±s)
-
RNA干扰(RNA interference,RNAi)技术是目前研究基因功能、肿瘤基因失活、开发肿瘤治疗新手段的实验工具[4-6]。它是利用与目的mRNA具有同源性的siRNA诱发序列特异性的转录后基因沉默,产生类似于“基因敲除”的生物表型,能够高效、特异地抑制靶基因。RNAi技术在转染细胞后短期(48 h)内即可了解抑制靶基因表达后的生物学现象,操作简便。为了建立稳定的XRCC2基因沉默结肠癌细胞系,本实验采用RNAi技术,将XRCC2 shRNA质粒转染结肠癌T84细胞以降低XRCC2表达水平,转染后用嘌呤酶素进行细胞筛选。经鉴定证实,结肠癌细胞中XRCC2蛋白表达被特异地阻断,成功建立了稳定的XRCC2基因沉默的结肠癌细胞系。同时本实验将control shRNA质粒作为阴性干扰对照即“零乱”siRNA,其将特异性siRNA的序列打乱,防止与目的靶细胞中的其他基因有同源性。
细胞失去调控进而无限生长是肿瘤细胞表型的重要表现之一。那么沉默XRCC2表达对结肠癌T84细胞的增殖会产生什么影响?本实验发现,XRCC2基因沉默的细胞于培养的第3天开始,增殖速度明显减慢,细胞生长抑制率平稳地维持在50%左右,沉默XRCC2表达有效地抑制了体外结肠癌T84细胞的增殖。克隆形成实验由于可准确检测到存活细胞而成为辐射敏感性判定的“金标准”[7-9]。本实验采用经典的克隆形成法观察沉默XRCC2表达的结肠癌细胞对X射线敏感性的变化,结果发现,XRCC2基因沉默的T84细胞经X射线照射后,与单纯XRCC2基因沉默组和照射组相比,克隆形成数显著减少,XRCC2基因沉默大大提高了结肠癌细胞对X射线的辐射敏感性。以上结果均提示,XRCC2有希望在结肠癌的临床放射治疗中作为一个敏感靶向基因出现。本实验结果与Zheng等[10]用RNAi技术沉默XRCC2表达,有效地提高了胶质母细胞瘤的辐射敏感性的结果相一致。
肿瘤细胞的辐射敏感性对肿瘤的放射治疗效果有重要的影响。细胞周期是影响辐射敏感性的重要因素之一。M期细胞或接近M期的细胞是放射最敏感的细胞,G2期细胞通常较敏感,其敏感性与M期的细胞相似[11]。本实验发现,X射线照射后,XRCC2基因沉默的结肠癌细胞处于G2/M期细胞的比例增加,(38.51±4.15)%的细胞阻滞于G2/M期。结果提示,由于细胞从G1期逃逸而进入G2期,G2期细胞对辐射较敏感,因此结肠癌细胞表现出辐射敏感性的增强。
细胞凋亡不仅是影响肿瘤形成的一个重要机制,而且是影响肿瘤放疗疗效的重要因素之一。细胞凋亡与肿瘤细胞的辐射敏感性密切相关[12]。本实验结果表明,XRCC2基因沉默导致辐射诱导的大量结肠癌T84细胞凋亡,凋亡率达到(33.16±2.69)%。结果提示,降低XRCC2表达的细胞经辐射后对细胞凋亡较敏感。
生物个体中XRCC家族的表达直接影响对DNA损伤的修复能力,也反映了对电离辐射的敏感性。研究表明,当XRCC2缺陷时,细胞系因DNA修复缺陷而表现出对电离辐射的敏感性增高,或造成个体发育阶段中的死亡[13]。我们前期研究发现,放射诱导结肠癌细胞内XRCC2表达水平的异常升高,可以抵抗射线对肿瘤细胞DNA的损伤作用,造成肿瘤细胞对辐射的抗性。本研究通过沉默结肠癌T84细胞XRCC2的表达,抑制了肿瘤细胞的生长,增强了肿瘤细胞对辐射的敏感性,辐射敏感性的增强与促使结肠癌细胞阻滞在G2/M期和促进结肠癌细胞发生细胞凋亡相关。本研究提示,XRCC2基因沉默有可能作为结肠癌治疗的一种放射增敏措施,以提高临床肿瘤放射治疗的疗效。
沉默XRCC2基因表达联合电离辐射对结肠癌细胞增殖能力的影响
The effect of silencing XRCC2 gene combined with ionizing radiation on growth of colorectal cancer cells
-
摘要: 目的阐明shRNA干扰沉默X射线修复交叉互补基因2(XRCC2)对体外结肠癌T84细胞辐射敏感性的影响。方法采用MTT法检测稳定表达XRCC2基因沉默的结肠癌T84细胞的生长并计算细胞生长抑制率,克隆形成实验检测经X射线照射后T84细胞的克隆形成能力,采用流式细胞术检测经X射线照射后T84细胞的细胞周期和细胞凋亡率。结果shRNA-XRCC2组细胞于培养的第3天开始,增殖速度明显减慢,细胞生长抑制率平稳地维持在50%左右,明显低于shRNA-SC组(t=17.62、12.84、9.24,P < 0.05)。shRNA-XRCC2组和8 Gy组的细胞克隆形成数目分别为422.7±43.4和389.5±24.4,shRNA-XRCC2+8 Gy组细胞克隆形成数最少(223.3±32.9),与shRNA-XRCC2组和8 Gy组相比,差异有统计学意义(t=8.96、9.92,P < 0.01)。shRNA-XRCC2组停留在G2/M期的细胞增加(38.51±4.15)%,与对照组相比,差异有统计学意义(t=3.92,P < 0.05);shRNA-XRCC2组细胞的凋亡率最高,达(33.16±2.69)%,与对照组相比,差异有统计学意义(t=15.31,P < 0.01)。结论XRCC2基因沉默有效地抑制了体外结肠癌T84细胞的增殖,XRCC2基因沉默联合辐射促使T84细胞阻滞在G2/M期并发生细胞凋亡,从而提高了T84细胞对辐射的敏感性。
-
关键词:
- 辐射 /
- 结肠肿瘤 /
- RNA干扰 /
- X射线修复交叉互补基因2
Abstract: Objective To investigate the effect of silencing X-ray repair cross complementary gene 2(XRCC2) through shRNA interference on the radiosensitivity of colorectal cancer cells. Methods The growth of colorectal cancer T84 cells of silencing XRCC2 was determined with MTT assay and the growth inhibition rate of T84 cells was detected. The ability to form colonies of T84 cells after exposure to X-ray radiation was examined with colony formation assay. The cell cycle distribution or cell apoptosis of T84 cells irradiated with X-ray radiation was performed by flow cytometric analysis. Results The cell growth of shRNA-XRCC2 group slowed down markedly from the third day of cell culture and the growth inhibition rate of shRNA-XRCC2 group steadily maintained about 50%, which was significantly less than that of shRNA-SC group(t=17.62, 12.84, 9.24, all P < 0.05). The number of colonies formed in shRNA-XRCC2 cells and 8 Gy radiation cells was 422.7±43.4 and 389.5±24.4 respectively. The number of colonies in shRNA-XRCC2+8 Gy radiation group was the least(223.3±32.9), which was decreased significantly compared with that of shRNA-XRCC2 group or 8 Gy group(t=8.96 and 9.92, both P < 0.01). Cells of shRNA-XRCC2 group arrested at G2/M phase were increased, reached(38.51±4.15)%, significantly higher than that of control group(t=3.92, P < 0.05). Cells apoptosis ratio of shRNA-XRCC2 group cells was the highest, reached(33.16±2.69)%, and there were significant differences compared with that of control(t=15.31, P < 0.01). Conclusion Knockdown of XRCC2 inhibited effectively the growth of colorectal cancer T84 cells in vitro. Silencing XRCC2 combined with radiation led to T84 cells arrested at G2/M phase and cells apoptosis and rendered T84 cells more sensitive to radiation. -
表 1 不同培养时间结肠癌T84细胞的生长抑制率(%,x±s)
Table 1. The growth inhibition rate at different culture time of colorectal cancer T84 cells(%, x±s)
培养时间(d) 抑制率 shRNA-SC shRNA-XRCC2 1 1.1±0.2 5.3±1.6 3 5.3±1.5 46.7±8.0 5 14.8±3.5 49.9±8.8 7 22.1±4.1 49.7±9.5 注:表中,XRCC2:X射线修复交叉互补基因2。 表 2 XRCC2基因沉默联合辐射后T84细胞的细胞周期和细胞凋亡率(%,x±s)
Table 2. The cell cycle distribution and cell apoptosis of T84 cells of silencing XRCC2 gene combined with radiation(%, x±s)
组别 细胞周期 细胞凋亡率 G0/G1 G2/M S 对照组 48.83±1.61 26.20±3.50 24.97±4.82 6.90±1.40 shRNA-SC组 67.58±1.16 24.64±1.38 7.78±0.42 7.76±2.15 shRXNRAC-C2组 41.13±7.85 38.51±4.15 20.36±11.47 33.16±2.69 注:表中,XRCC2:X射线修复交叉互补基因2。 -
[1] 程晋, 邹仲敏. DNA损伤修复及细胞周期检控点激活的研究进展[J].国际放射医学核医学杂志, 2009, 33(6):360-364.
[2] 张占春.电离辐射损伤与DNA修复基因[J].国外医学:放射医学核医学分册, 2004, 28(1):26-29.
[3] 王芹. X射线修复交叉互补基因功能的研究进展[J].国外医学:放射医学核医学分册, 2005, 29(3):132-136.
[4] Asada S, Watanabe S, Fujii T, et al. RNAi knockdown of potent sugar sensor in Cellulase-Producing fungus acremonium cellulolyticus[J]. Appl Biochem Biotechnol, 2014, 172(6):3009-3015. [5] Smialowska A, Djupedal I, Wang JW, et al. RNAi mediates post-transcriptional repression of gene expression in fission yeast Schizosaccharomyces pombe[J]. Biochem Biophys Res Commun, 2014, 444(2):254-259. [6] Mollaie HR, Monavari SH, Arabzadeh SA, et al. RNAi and miRNA in viral infections and cancers[J]. Asian Pac J Cancer Prev, 2013, 14(12):7045-7056. [7] Hirota Y, Masunaga SI, Kondo N, et al. High linear-energy-transfer radiation can overcome radioresistance of glioma stem-like cells to low linear-energy-transfer radiation[J]. J Radiat Res, 2014, 55(1):75-83. [8] Bajinskis A, Natarajan AT, Erixon K, et al. DNA double strand breaks induced by the indirect effect of radiation are more efficiently repaired by non-homologous end joining compared to homologous recombination repair[J]. Mutat Res, 2013, 756(1-2):21-29. [9] Zhuang HQ, Bo QF, Yuan ZY, et al. The different radiosensitivity when combining erlotinib with radiation at different administration schedules might be related to activity variations in c-MET-PI3K-AKT signal transduction[J/OL]. Onco Targets Ther, 2013, 6:603-608[2014-11-05]. http://dx. doi. org/10. 2147/OTT. S44505. [10] Zheng ZM, Ng WL, Zhang XM, et al. RNAi-Mediated targeting of noncoding and coding sequences in DNA repair gene messages efficiently radiosensitizes human tumor cells[J]. Cancer Res, 2012, 72(5):1221-1228. [11] Pawlik TM, Keyomarsi K. Role of cell cycle in mediating sensitivity to radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2004, 59(4):928-942. [12] Yunlan L, Juan Z, Qingshan L. Antitumor activity of di-n-butyl-(2, 6-difluorobenzohydroxamato)Tin(IV)against human gastric carcinoma SGC-7901 cells via G2/M cell cycle arrest and cell apoptosis[J/OL]. PLoS One, 2014, 9(3):e90793[2014-11-05]. http://www. ncbi. nlm. nih. gov/pubmed/24643073. [13] Liu YH, Shete S, Wang LE, et al. Gamma-radiation sensitivity and polymorphisms in RAD51L1 modulate glioma risk[J]. Carcinogenesis, 2010, 31(10):1762-1769. -






 下载:
下载: