-
头颈部肿瘤包括颈部肿瘤、耳鼻喉科肿瘤以及口腔颌面部肿瘤三大部分。头颈部所发生的肿瘤,其原发部位和病理类型之多,居全身肿瘤之首。根据国际流行病学研究机构提供的资料,我国近年头颈部肿瘤的年发病率为15.22/10万,占全身恶性肿瘤的4.45%,其中,超过90%的头颈部肿瘤为鳞状细胞癌。最近10年,全球头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)的发病率明显上升,特别是在女性中。同时,由于头颈部重要器官比较集中,解剖关系复杂,因此该部位发生的肿瘤限制了扩大切除手术的应用,从而影响到单纯手术的疗效。大剂量化疗除了其本身对全身系统的损伤难以避免外,还存在血脑屏障的问题。而放疗的参与,可以明显提高手术的局部控制率、改善远期生存,而且相当一部分的头颈部早期肿瘤通过单纯放疗也可获得满意的治愈率,同时又可理想地保留头颈部器官的功能(如鼻咽癌、早期头颈部癌和头颈部低分化癌)。因此,放疗在头颈部肿瘤的治疗中显得尤为重要。
转化医学是近十年来国际生物医学领域出现的新概念和重点研究方向,将科研过程及其成果与临床紧密结合,尤其体现在通过检测患者肿瘤组织中的基因突变靶点及基因单核苷酸多态性(single nucleotide polymorphism,SNP)分型、mRNA基因定量表达,为临床提供靶向及个体化放疗的依据,能显著提高治疗的有效率。
因此,为了进一步完善HNSCC放疗的治疗策略,需要认识和研究以下几个方面的内容:① DNA损伤反应和修复机制;②辐射诱导细胞间与细胞内信号传导;③微观环境;④肿瘤生物标志物和分子靶向分析。
-
DNA损伤反应和修复的重要性,特别是针对DNA损伤反应和修复途径来确定细胞的放射敏感性是近年来放射生物学研究的热点。电离辐射可引起各种DNA损伤,包括氧化的碱基损伤、脱碱基位点、单链断裂以及双链断裂等。如果不进行有效的修复,这些损伤会促进正常和肿瘤组织的细胞死亡,即直接激活细胞凋亡和自噬,或更常见的促有丝分裂的损伤[1-3]。DNA双链断裂是最致命的损伤,其修复机制复杂,包括进行非同源的末端连接和同源重组。其他的修复过程,如碱基切除修复,也对保持基因组完整性及细胞的存活至关重要。在这些基本的修复机制中,关键的DNA损伤信号修复分子起到了重要的作用,如共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)、DNA依赖蛋白酶的催化亚单位(catalytic subunit of the DNA dependent protein kinase,DNA-PKcs)和多聚腺苷二磷酸-核糖聚合酶(polyadpribosepolymerase,PARP)等[4-5]。因此,研究这些修复分子的抑制剂是杀伤HNSCC细胞的关键。然而,有些抑制剂虽然在体外实验中是非常有效的敏化癌细胞的因素,但在体内的放疗过程中不可能选择性杀灭癌细胞,因为其也将增加正常细胞的放射敏感性。因此,预测可能的生物标志物是必要的。例如,PARP的抑制剂已处在Ⅰ~Ⅲ期临床试验阶段,这些药物的目标是单链断裂和碱基切除修复过程。临床前试验表明,在异种移植肿瘤中抑制PARP可以增加肿瘤放疗的临床效果,现研究正在进行中[6]。染色质重组是DNA修复的另一个重要方面,最近的研究报道并确定了几种组织损伤信号和DNA修复过程中的染色质改性剂,其有助于保护异染色质区基因组的完整性[7]。DNA损伤修复以及染色质重塑损伤修复机制的深入研究将为头颈部肿瘤的放疗提供新的靶向选择。
-
尽管许多信号通路影响头颈部肿瘤细胞对辐射的反应,但基础与临床研究都表明,其中一些信号通路具有特殊的重要性,包括哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)/磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)经典的信号传导途径。这些途径中潜在的靶点对于提高肿瘤的辐射敏感性和放疗疗效有重要作用[8-10]。
mTOR/Akt信号通路通常是通过生长因子受体的配体PI3K激活的,电离辐射也可以通过促进DNA修复调控而激活这条通路。Akt信号通路促进细胞存活和DNA修复,针对这条通路的各种拮抗剂包括上游的膜受体的抗体和通路激酶的小分子抑制剂的研究较多。有研究证实,放疗联合应用目前最成功的表皮生长因子受体特异性抗体——西妥昔单抗,在头颈部肿瘤Ⅲ期临床试验中显著提高了局部控制率并延长了患者总生存期[11-12]。针对这些激酶活性途径中的小分子抑制剂已经有新的临床前数据支持,这也为辐射增敏带来了曙光。深入了解细胞基质之间的相互作用和细胞辐射敏感性,特别是肿瘤细胞内环境,无疑为放射肿瘤学开辟了分子靶向的方向。
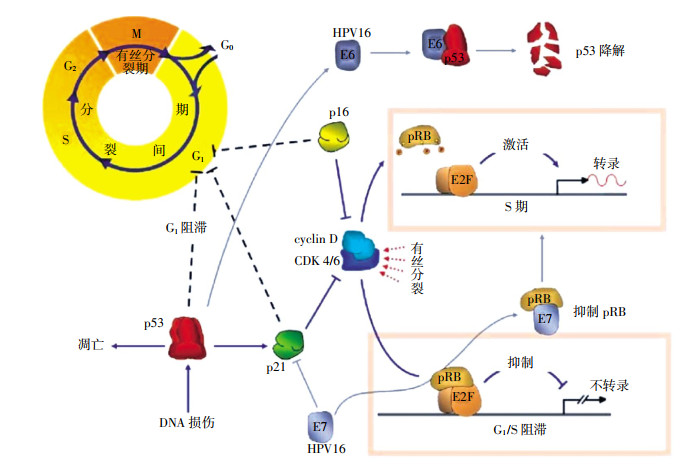
处于细胞周期不同时相的细胞放射敏感性不同。G2期细胞对辐射最敏感,其次为G1期细胞,而S期细胞对辐射较不敏感。电离辐射通过诱导细胞周期G1阻滞、G2阻滞、S期延迟及S/M期解偶联,从而影响细胞周期进程。在头颈部肿瘤中,p53、p21、p16和cyclin D等蛋白参与G1期阻滞,通过技术手段干预这些因子,可以设计合理的肿瘤治疗方案,提高放疗疗效(图 1)[13]。
-
肿瘤微环境因素包括氧、基质成分、细胞因子和各种宿主细胞(免疫细胞、骨髓衍生细胞和内皮细胞),其在头颈部肿瘤放射治疗期间和之后的组织缺氧反应中起着至关重要的作用,包括细胞增殖、存活、血管生成、DNA修复、细胞自噬、免疫监视、代谢以及肿瘤的侵袭和转移等过程。肿瘤细胞缺氧反应中重要的信号传导途径,包括乏氧诱导因子、未折叠蛋白反应和mTOR等[14-16]。由于氧代谢改变,影响恶性肿瘤的治疗反应,利用这些特性并通过成像方法以及针对缺氧的肿瘤细胞的治疗,目前已经在实验室研究和临床试验中开展。
肿瘤血管生成是晚期癌症及促进癌细胞侵袭和转移的标志。超过90%的HNSCC表达血管新生因子,如血管内皮生长因子。一些临床前研究支持HNSCC血管生成标记对预后的影响[17],目前这是一个有吸引力的实体瘤治疗目标。由于放疗是HNSCC最常用的治疗方法之一,因而确定抗血管新生治疗和放疗之间的相互作用,并开发联合治疗,用以改善临床结果是十分必要的。抗血管新生的电离辐射机制是复杂的,涉及到很多的脉管系统,以及肿瘤间质和肿瘤细胞之间的相互作用。肿瘤细胞的增殖和转移依赖于血管生成。快速增长的肿瘤会导致组织缺氧,刺激肿瘤细胞的生长,乏氧诱导因子和血管内皮生长因子均能引起更多的肿瘤增殖和血管生成,增加了辐射抗性[18]。因此,通过调节肿瘤血管和肿瘤血管形成可以改善肿瘤微环境、肿瘤血流量和氧合作用,增强辐射敏感性。未来利用抗血管新生疗法改善HNSCC对辐射的敏感性,将是一种很有前景的治疗方法。
过去几十年的放射生物学研究发现,癌干细胞(cancer stem cells,CSC)引起肿瘤治疗后复发,同时增强肿瘤细胞的辐射抗性[19]。然而,给予重要的信号通路和肿瘤微环境改变,不同肿瘤的CSC放疗敏感性不同,因而对相应肿瘤的放疗有不同影响[20-21]。目前,这一领域的研究试图在分子水平上阐明干细胞的重要生物学特性,包括DNA修复和生存信号。了解个体的CSC生物学特征,便于制定特定的目标,优化放疗的策略。根据临床外科的研究成果可以认为,CSC对HNSCC具有潜在影响。B细胞特异性莫洛尼鼠白血病病毒插入位点1(B-cell-specific Moloney murine leukemia virus insertion site 1,BMI1)作为CSC标记,基于其特定位置的具体数据具有检测HNSCC预后的价值[22]。
-
近十年中,通过高通量分析技术和人类基因组测序工作,有关个体肿瘤的表征已经积累了大量数据。初期的数据在很大程度上集中在基因表达谱上,并应用于不同类型肿瘤的预后预测。这些数据也有助于识别信号传导通路,制定控制肿瘤的生长和治疗的具体方法。许多研究也在试图寻找遗传变异,主要是在SNP,从而确定能够提高个人辐射灵敏度的潜在位点以及探寻肿瘤组织与正常组织之间辐射反应差异的决定因素。这些具体的鉴定细胞类型和细胞功能的描述作为辐射反应的生物标志物,可以优化患者的分类并制定个性化的肿瘤治疗方案,尤其充实了放射肿瘤学中分子靶向方法。基因突变,如DNA拷贝数变异(copy number variation,CNV)和杂合性损失(loss of heterozygosity,LOH),已经证明与HNSCC的发生和发展有关。某些CNV和LOH未来可用于HNSCC复发和病死率的预测。最近的高分辨率SNP有可能识别更多的基因变化和全基因组CNV和(或)等位基因,可能对HNSCC的预后进行预测[23-25]。虽然现在检测SNP序列的方法可以做到同时检测CNV和LOH,但还没有应用高分辨率SNP(如500k SNP等)来检测HNSCC基因畸变或预测HNSCC预后。即便SNP提供了一个潜在识别的基因标记方法,可以用来更好地预测预后,但目前也需要克服很多挑战。这些挑战主要涉及需要收集大量的一直监测肿瘤复发和生存的HNSCC患者的高质量DNA样品。
miRNA通过调控其靶基因的表达,在头颈部肿瘤的发生发展中起着重要的作用,其中miR-21作为癌基因在头颈部肿瘤中高表达,而抑癌基因miR-375和miR-125b-1表达降低[26-28]。检测HNSCC患者中miRNA的表达在肿瘤的个性化放疗方案的制定中具有应用前景。
近年来,在各种生理和病理的情况下对肿瘤组织和正常组织辐射反应的分子基础的研究,为研究放射敏感性带来了曙光。结合肿瘤放射治疗技术上的进步,这种转化医学相关的新理论在不久的将来将为制定更具体的有针对性的优化辐射治疗方案提供重要策略。
头颈部肿瘤放疗中转化医学相关机制的研究进展
Development in translational medicine-related mechanisms of radiotherapy for head and neck cancer
-
摘要: 头颈部肿瘤是目前世界上最常见的肿瘤之一,超过90%的头颈部肿瘤为鳞状细胞癌。放疗在头颈部肿瘤的治疗中显得尤为重要,目前国内治疗早期肿瘤可以单纯放疗为主,晚期肿瘤则选择综合性治疗。转化医学是近些年来新的研究重点,将科研过程及其成果与临床紧密结合,尤其体现在通过检测患者肿瘤组织中的基因突变靶点及基因单核苷酸多态性分型、mRNA基因定量表达,为临床提供靶向及个体化放疗的依据,能显著提高治疗的有效率。Abstract: Head and neck cancer is currently one of the most common tumors worldwide. More than 90% of head and neck tumors are squamous cell carcinoma. Radiotherapy is particularly important in the treatment of head and neck cancer. Current domestic treatment is sole radiotherapy for early tumors, but comprehensive treatment is administered for late tumors. Translational medicine, which closely connects results from studies and clinical medicine, has emerged as a new research focus in recent years. This method is expected to provide basis for target and individual radiotherapy through the detection of target gene mutations, gene single nucleotide polymorphism classification, and mRNA gene expression in tumor tissues of patients. Thus, this method can be used to evidently improve the efficiency of clinical treatment of tumors.
-
[1] Gewirtz DA, Hilliker ML, Wilson EN. Promotion of autophagy as a mechanism for radiation sensitization of breast tumor cells[J]. Radiother Oncol, 2009, 92(3):323-328. [2] Turesson I, Nyman J, Qvarnström F, et al. A low-dose hypersensitive keratinocyte loss in response to fractionated radiotherapy is associated with growth arrest and apoptosis[J]. Radiother Oncol, 2010, 94(1):90-101. [3] Vitale I, Galluzzi L, Castedo M, et al. Mitotic catastrophe:a mechanism for avoiding genomic instability[J]. Nat Rev Mol Cell Biol, 2011, 12(6):385-392. doi: 10.1038/nrm3115 [4] Begg AC, Stewart FA, Vens C. Strategies to improve radiotherapy with targeted drugs[J]. Nat Rev Cancer, 2011, 11(4):239-253. doi: 10.1038/nrc3007 [5] Rainey MD, Charlton ME, Stanton RV, et al. Transient inhibition of ATM kinase is sufficient to enhance cellular sensitivity to ionizing radiation[J]. Cancer Res, 2008, 68(18):7466-7474. doi: 10.1158/0008-5472.CAN-08-0763 [6] Chalmers AJ, Lakshman M, Chan N, et al. Poly(ADP-ribose) polymerase inhibition as a model for synthetic lethality in developing radiation oncology targets[J]. Semin Radiat Oncol, 2010, 20(4):274-281. doi: 10.1016/j.semradonc.2010.06.001 [7] Goodarzi AA, Jeggo P, Lobrich M. The influence of heterochromatin on DNA double strand break repair:Getting the strong, silent type to relax[J]. DNA Repair(Amst), 2010, 9(12):1273-1282. doi: 10.1016/j.dnarep.2010.09.013 [8] Toulany M, Kehlbach R, Rodemann HP, et al. Radiocontrast media affect radiation-induced DNA damage repair in vitro and in vivo by affecting Akt signalling[J]. Radiother Oncol, 2010, 94(1):110-116. [9] Meyn RE, Munshi A, Haymach JV, et al. Receptor signaling as a regulatory mechanism of DNA repair[J]. Radiother Oncol, 2009, 92(3):316-322. [10] Florczak U, Toulany M, Kehlbach R, et al. 2-Methoxyestradiol-induced radiosensitization is Independent of SOD but depends on inhibition of Akt and DNA-PKcs activities[J]. Radiother Oncol, 2009, 92(3):334-338. [11] Bonner JA, Harari PM, Giralt J, et al. Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer:5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival[J]. Lancet Oncol, 2010, 11(1):21-28. doi: 10.1016/S1470-2045(09)70311-0 [12] Bonner JA, Harari PM, Giralt J, et al. Radiotherapy plus cetuximab for squamous-cell carcinoma of the head and neck[J]. N Engl J Med, 2006, 354(6):567-578. doi: 10.1056/NEJMoa053422 [13] Dietz A, Wichmann G. Translational research in head and neck cancer. Biological characteristics and general aspects. HNO, 2011, 59(9):874-884. doi: 10.1007/s00106-011-2361-5 [14] Van Den Beucken T, Ramaekers CH, Rouschop K, et al. Deficient carbonic anhydrase 9 expression in UPR-impaired cells is associated with reduced survival in an acidic microenvironment[J]. Radiother Oncol, 2009, 92(3):437-442. [15] Sørensen BS, Horsman MR, Vorum H, et al. Proteins upregulated by mild and severe hypoxia in squamous cell carcinomas in vitro identified by proteomics[J]. Radiother Oncol, 2009, 92(3):443-449. [16] Mujcic H, Rzymski T, Rouschop KM, et al. Hypoxic activation of the unfolded protein response(UPR) induces expression of the metastasis-associated gene LAMP3[J]. Radiother Oncol, 2009, 92(3):450-459. [17] Zang J, Li C, Zhao LN, et al. Prognostic value of vascular endothelial growth factor in patients with head and neck cancer:a meta-analysis[J]. Head Neck, 2013, 35(10):1507-1514. [18] Hui EP, Chan AT, Pezzella F, et al. Coexpression of hypoxia-inducible factors 1α and 2α, carbonic anhydrase IX, and vascular endothelial growth factor in nasopharyngeal carcinoma and relationship to survival[J]. Clin Cancer Res, 2002, 8(8):2595-2604. [19] Jung YS, Vermeer PD, Vermeer DW, et al. CD200:association with cancer stem cell features and response to chemoradiation in head and neck squamous cell carcinoma[J]. Head Neck, 2015, 37(3):327-335. doi: 10.1002/hed.23608 [20] Nguyen GH, Murph MM, Chang JY. Cancer stem cell radioresistance and enrichment:where frontline radiation therapy May fail in lung and esophageal cancers[J]. Cancers(Basel), 2011, 3(1):1232-1252. [21] Hsu HS, Huang PI, Chang YL, et al. Cucurbitacin I inhibits tumorigenic ability and enhances radiochemosensitivity in nonsmall cell lung cancer-derived CD133-positive cells[J]. Cancer, 2011, 117(13):2970-2985. doi: 10.1002/cncr.25869 [22] Lo WL, Yu CC, Chiou GY, et al. MicroRNA-200c attenuates tumour growth and metastasis of presumptive head and neck squamous cell carcinoma stem cells[J]. J Pathol, 2011, 223(4):482-495. doi: 10.1002/path.2826 [23] Andreassen CN, Alsner J. Genetic variants and normal tissue toxicity after radiotherapy:a systematic review[J]. Radiother Oncol, 2009, 92(3):299-309. [24] Andreassen CN. Searching for genetic determinants of normal tissue radiosensitivity—are we on the right track?[J]. Radiother Oncol, 2010, 97(1):1-8. [25] West C, Rosenstein BS. Establishment of a radiogenomics consortium[J]. Radiother Oncol, 2010, 94(1):117-118. [26] Hui AB, Lenarduzzi M, Krushel T, et al. Comprehensive MicroRNA profiling for head and neck squamous cell carcinomas[J]. Clin Cancer Res, 2010, 16(4):1129-1139. doi: 10.1158/1078-0432.CCR-09-2166 [27] Chen D, Cabay RJ, Jin Y, et al. MicroRNA deregulations in head and neck squamous cell carcinomas[J/OL]. J Oral Maxillofac Res, 2013, 4(1): e2[2014-11-17]. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3886106. [28] Nakanishi H, Taccioli C, Palatini J, et al. Loss of miR-125b-1 contributes to head and neck cancer development by dysregulating TACSTD2 and MAPK pathway[J]. Oncogene, 2014, 33(6):702-712. doi: 10.1038/onc.2013.13 -





 下载:
下载: