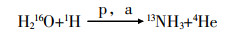-
PET探针13N-氨水在临床被广泛应用于心肌血流测定和局部脑血流显像,13N-氨水联合18F-FDG心肌显像已成为评价心肌存活的影像学金标准[1]。而且,临床还发现,13N-氨水对脑胶质瘤[2]、无症状的纤维肉瘤[3]和星型细胞瘤[4]的检测比18F-FDG更有独特的优势,其在临床上的应用范围日益扩展。
作为被中国药典收录,可以进行临床应用的12种静脉注射的正电子显像剂之一的13N-氨水,与目前临床最常用的18F-FDG一样,在使用前必须进行药物的系列质量控制,其中,对药物进行鉴别和放射化学纯度的检测是其中最重要的常规质控之一。但是,由于13N-氨水的化学量是痕量的,而13N的半衰期极短,只有10 min,所以要求鉴别确认和放射化学纯度的检测过程必须快速、简单。目前,国内对13N-氨水还没有出台相关的质量标准和检测方法,美国药典推荐了13N-氨水的鉴别和放射化学纯度的检测方法——使用氯化铵(NH4Cl)作为标准液,电导池检测器作为检测器进行13N-氨水的鉴别确认和放射化学纯度的检测[5]。由于受检测器的限制,该方法难于普及。本研究使用最常用的高效液相色谱(high performance liquid chromatography,HPLC)紫外(ultraviolet,UV)检测器,对13N-氨水进行了有效的鉴别确认和放射化学纯度的分析,现报道如下。
-
仪器:RDS-111加速器(美国CTI公司),HPLC仪(美国Waters公司),UV检测器(美国Waters 2489),CRC-15R型活度计(美国Capintec公司),精密电子天平(德国Sartorius公司),放射性流动计数器Flow-count(美国Bioscan公司),AQ-C18色谱柱(规格250 mm × 4.6 mm,5 μm)(美国Ultimate公司)。
试剂:无水乙醇(分析纯)、无水乙腈(HPLC级)、硝酸钠(分析纯)、25%浓氨水(分析纯)均为广州试剂厂产品,去离子水由我院药理实验室提供。
-
在500 ml的无菌注射用水中加入0.14 ml的美国药典级别乙醇,混合均匀得到5 mmol/L的反应原料,装载在加速器上,开启加速器,将混合好的乙醇水溶液压入靶中,回旋加速器加速后的质子轰击预先装载在靶内的含有5 mmol/L乙醇的无菌水,在靶内发生16O(p,α)13N核反应得到13NH3,经IC-OH柱纯化后,无菌过滤得到临床使用的显像剂13N-氨水,其反应的合成原理如图 1所示。
-
色谱柱为AQ-C18柱(250 mm × 4.6 mm,5 μm),流动相为5 mmol/L的辛烷磺酸钠水溶液和乙腈,紫外吸收波长为210 nm。放射性流动计数器为Flow-Count,计数档为200千次/min。
-
用移液管取浓度为25%的浓氨水0.2 ml,加入0.2 ml去离子水,充分摇匀后得到浓度为12.5%的氨水标准液,溶液经精密pH试纸测得pH=11。
用精密电子天平称取硝酸钠200.0 mg,置于50 ml的容量瓶中,加水到刻度,摇匀,得到浓度为4.0 mg/ml的标准溶液,用移液器取上述标准溶液0.5 ml到20 ml的容量瓶中,加水到刻度,摇匀,得到浓度为0.1 mg/ml的硝酸钠标准液。
分别取2 μl氨水标准液和硝酸钠标准液进样检测,得到它们的UV色谱图,从图中可以得到对应的硝酸根离子和氨水的保留时间。
-
取回旋加速器生产的未经纯化的放射性显像剂13N-氨水0.1 ml(pH=7),取5 μl进样,按上述HPLC色谱的分析得到未纯化的13N-氨水的放射性色谱图和UV吸收色谱图,对比UV的保留时间可以在放射性色谱图上确认出13N-氨水的放射性色谱峰的位置。
-
取回旋加速器生产的经IC-OH柱纯化后的13N-氨水0.1 ml,取5 μl进样,按上述HPLC的分析条件进行HPLC的UV-放射性色谱检测,测定13N-氨水的放射化学纯度,每个样品重复测定3次。
-
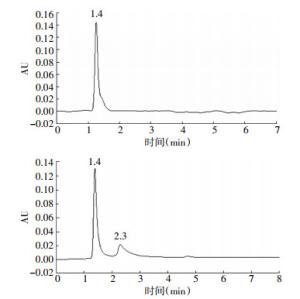
氨水的UV吸收很弱,高浓度下其UV吸收峰才能被检测器检测,而硝酸钠的硝酸根则具有强的UV吸收,低浓度的硝酸钠即可以被UV检测器检测,因此本实验使用了高浓度的氨水(通过1:1稀释)和低浓度的硝酸钠(0.1 mg/ml)作为标准液。通过优化流动相的比例后发现,在以辛烷磺酸钠水溶液和乙腈为流动相,体积比为3:1,流速为0.5 ml/min时,杂质和样品可以有效被分离。从图 2中的色谱图可以知道,杂质硝酸钠的保留时间为1.4 min,样品氨水的保留时间为2.3 min,两种物质分离良好,硝酸钠对210 nm的UV具有强的吸收,而氨水则表现为弱吸收。另外,在标准液氨水中明显存在硝基化合物类的杂质,其保留时间与硝酸钠的保留时间基本一致。
-
对比图 3中的UV吸收色谱图和放射性色谱图可以看出,未经纯化的13N-氨水的保留时间为3.3 min,硝基类化合物的保留时间为1.7 min,它们各自的放射性检测的保留时间分别为5.8 min和3.1 min,两种物质分离良好。
-
连续生产4批次的13N-氨水并经同样的方法处理后在同样的色谱条件下进行检测,进样量均为5 μl,其放射化学纯度分别为(99.3±0.4)%、(99.9±0.1)%、(99.9±0.1)%和(99.4±0.5)%,各批次13N-氨水的放射化学纯度都大于95%,符合美国药典规定的要求。
-
13N-氨水的合成可通过戴氏合金还原法和在线还原法两种常用方法生产[6]。戴氏合金还原法通过核反应12C(d,n)13N或13C(p,n)13N得到13NO3和13NO2,再利用戴氏合金将13NO3和13NO2还原为13NH3[7-8],13NH3被蒸馏到生理盐水中得到13N-氨水。在线还原法通过回旋加速器轰击含少量氧化自由基清除剂甲醇或乙醇的靶水,发生核反应16O(p,a)13N并直接得到13N-氨水,经纯化、除菌、热源检测后用于临床[9-10]。本研究中所使用的13N-氨水采用后者进行生产得到,其整个反应过程简单,没有其他物质的参与,13N-氨水中仅存在少量的副产物硝基类化合物(NOx-)。
对于13N-氨水注射液,国内还没有对其制定统一的质量控制标准,而美国药典规定的鉴别和放射化学纯度的检测方法在当前国内的PET中心难于实施。考虑到鉴别和放射化学纯度质控是药物质量控制的重要指标,也是要求在临床使用前必须完成的项目,有必要建立与国情相适应的新方法。
由于普通的氨水溶液中氨的挥发性和较低的UV吸收能力,本研究没有对其进行定量方面的研究。美国药典使用的方法是以氯化铵作为标准物质,其没有挥发性,可以进行定量的分析,这是其优势所在,但该方法使用特殊的、不具普遍性的电导池检测器进行鉴别确认和测定,受仪器条件的限制难于进行广泛应用。而本研究所使用的UV检测器是HPLC最常用的检测器,在实际工作中更具有优势。
作为半衰期极短的正电子显像剂13N-氨水,其质量控制必须简单快速,本研究通过建立新的HPLC的方法,可以在6 min内完成13N-氨水的鉴别和放射化学纯度检测,适合目前国内PET中心的应用和推广,并为13N-氨水的质量控制方法提供了借鉴。
高效液相色谱与放射性流动计数器联用确证13N-氨水及测定放射化学纯度的研究
Identification of 13N-NH3 and analysis of its radiochemical purity using high performance liquid chromatography-ultraviolet-flow-count
-
摘要:
目的 建立新的快速鉴别正电子显像剂13N-氨水及测定其放射化学纯度的有效方法。 方法 采用高效液相色谱-紫外检测器联用放射性流动计数器(HPLC-UV-Flow-Count)的方法,以12.5%的氨水和0.1 mg/ml硝酸钠(NaNO3)作为标准液,AQ-C18柱为分离柱,流动相为5 mmol/L的辛烷磺酸钠水溶液和乙腈(体积比为3:1),流速为0.5 ml/min,紫外吸收波长为210 nm。将氨水和硝酸钠标准液进样检测,得到它们的色谱图后对比保留时间进行鉴别。 结果 在上述的洗脱条件下,氨水和硝酸钠的UV保留时间分别为2.3和1.4 min,13N-氨水和杂质13N-NOx-的放射性保留时间分别为5.8和3.1 min,两种物质分离良好。放射性显像剂13N-氨水的放射化学纯度大于95%,符合临床应用的要求。 结论 该方法简单、快速,适合半衰期极短的13N-氨水正电子显像剂的鉴别和放射化学纯度的测定。 Abstract:Objective To establish a new, rapid, and effective method to identify 13N-NH3 and analyze its radiochemical purity. Methods The chromatographic method of high performance liquid chromatography-ultraviolet(HPLC-UV)-flow-count was performed using a C18 column with mobile phase of acetonitrile and 5 mmol/L sodium 1-octanesulfonate solution(V/V=1/3)at a flow rate of 0.5 ml/min and a wavelength of 210 nm. 15% 13N-NH3 and 0.1 mg/ml NaNO3 were detected separately, and their retention times were compared and identified. Results The UV retention times of NH3 and NaNO3 were 2.3 and 1.4 min, respectively, and the retention times of 13N-NH3 and 13N-NOx- were 5.8 and 3.1 min, respectively. The established separation method using HPLC-UV-flow-count showed good efficiency. Conclusion HPLC-UV-flow-count is a simple, valid, and rapid method to identify 13N-NH3 and analyze its radiochemical purity. -
Key words:
- Chromatography, high pressure liquid /
- 13N-NH3 /
- Radiochemical purity
-
-
[1] Ryzhkova DV, Krasil′nikova LA, Nifontov EM, et al. Evaluation of coronary bed function by positron emission tomography using 13N-ammonium during cold stimulation[J]. Vestn Rentgenol Radiol, 2011, 3(1):30-35. [2] Shi X, Liu Y, Zhang X, et al. The comparison of 13N-ammonia and 18F-FDG in the evaluation of untreated gliomas[J]. Clin Nucl Med, 2013, 38(7):522-526. doi: 10.1097/RLU.0b013e318295298d [3] Harisankar CN, Mittal BR, Watts A, et al. Utility of dynamic perfusion PET using 13N-ammonia in diagnosis of asymptomatic recurrence of fibrosarcoma[J]. Clin Nucl Med, 2011, 36(2):150-151. [4] Xiangsong Z, Changhong L, Weian C, et al. PET imaging of cerebral astrocytoma with 13N-ammonia[J]. J Neurooncol, 2006, 78(2):145-151. doi: 10.1007/s11060-005-9069-x [5] The United States Pharmacopeial Convention. United States Pharmacopoeia(USP 35)[Z]. 2010. [6] Berridge MS, Landmeier BJ. In-target production of [13N] ammonia:target design, products, and operating parameters[J]. Appl Radiat Isot, 1993, 44(12):1433-1441. doi: 10.1016/0969-8043(93)90096-S [7] 鄢敏, 秦志星, 程鹏亮, 等.住友CLC模块在线优化合成13N-NH3·H2O的研究[J].国际放射医学核医学杂志, 2014, 38(6):360-362.
[8] Firouzbakht ML, Schlyer DJ, Wolf AP, et al. Mechanism of nitrogen-13-labeled ammonia formation in a cryogenic water target[J]. Nucl Med Biol, 1999, 26(4):437-441. doi: 10.1016/S0969-8051(99)00002-5 [9] Krasikova RN, Fedorova OS, Korsakov MV, et al. Improved [13N]ammonia yield from the proton irradiation of water using methane gas[J]. Appl Radiat Isot, 1999, 51(4):395-401. doi: 10.1016/S0969-8043(99)00062-7 [10] Okada M, Nakao R, Hosoi R, et al. In vivo monitoring of extracellular 13N-glutamine derived from blood-borne 13N-ammonia in rat striatum using microdialysis with radio-LC method[J]. J Neurosci Methods, 2009, 184(1):37-41. -





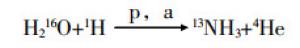
 下载:
下载: