-
急性上呼吸道感染约70%~80%是由病毒引起,另有20%~30%为细菌引起,可单纯发生或继发于病毒感染之后[1]。而我国下呼吸道感染相关流行病学统计,80%左右的患者也均是由各种病毒引起[2-3]。因此可见,病毒是引起上下呼吸道感染疾病的主要元凶。而可引起上下呼吸道感染的病毒有鼻病毒、流感病毒、呼吸道合胞病毒和柯萨奇病毒等几十种[4-5],单一抗病毒药物局限性较大,广谱抗病毒药物是治疗本类疾病的首选。α干扰素(Interferon-α,IFN-α)是人体内源性物质,是产品说明书中唯一提及具有广谱抗病毒作用的生物药。目前IFN-α多采用皮下或肌注的给药方式,因患者多为婴幼儿,因此常规给药方式给患儿带来了极大的痛苦。近年来临床上出现了雾化给药干扰素的相关报道,并展示出了一定的治疗优越性[6-7]。本研究比较了采用肌肉注射与雾化吸入两种不同途径给药干扰素α2b(Interferon α-2b,IFNα2b),其在兔体内的药代动力学及组织分布的差异,为临床选择具有更好疗效的IFNα2b雾化吸入给药方式提供实验依据。
-
IS In-Vivo FX小动物活体成像系统(美国Carestream Health公司);2470型全自动γ计数仪(美国PerkinElmer公司);AR-2000放射性薄层扫描仪(thin-layer chromatography,TLC)(美国Bioscan公司);UX4200H动物天平(日本SHIMADZU公司);BS223S分析天平(德国Sartorius公司)。
-
注射用重组人IFNα2b(假单胞菌)(商品名:利分能)原液(哈药集团生物工程有限公司),生物学活性1.26×108 IU/ml,蛋白质含量1.17 mg/ml;Na125I溶液(美国PerkinElmer公司);葡萄糖凝胶G-50(美国Pharmacia公司);氯胺-T和偏重亚硫酸钠(天津市博迪化工有限公司);盐酸赛拉嗪注射液(吉林省华牧动物保健品有限公司),其他试剂均为国产,分析纯。
-
日本大耳白兔36只,雄性,体质量2.0~2.2 kg,购自北京沙河通利试验动物养殖场[许可证号:SCXK(京)2013-0007]。动物自由摄食饮水。
-
取100 μl(即1260万IU)IFNα2b溶液加至抗蛋白黏附的1.5 ml离心管中,之后向反应管中加入7.4×107 Bq Na125I和50 μl氯胺-T溶液(10 mg/ml),室温震荡反应3 min,加入50 μl偏重亚硫酸钠溶液,震荡终止反应。采用葡聚糖凝胶色谱法(Sephadex G-50)对标记物进行纯化。标记率和放化纯度通过TLC进行检测。
-
分别取纯化后的125I-IFNα2b 30 μl加入100 μl PBS溶液和兔血浆中,放置在37 ℃的恒温摇床中震动,分别在0、24和48 h取样,进行薄层层析,通过TLC测定不同时间点的放化纯度。
-
将大耳白兔分为两组,即雾化吸入组和肌肉注射组。药代动力学实验中大耳白兔共6只,雾化吸入组和肌肉注射组各3只。组织分布实验中大耳白兔共30只,每组15只。麻醉后将大耳白兔固定。雾化吸入组的给药方法为:将125I标记的IFNα2b按照45万IU/kg体质量的给药量加入至雾化器中,再加入5 ml生理盐水。将呼吸面罩固定于兔头部,出气孔对准鼻部,利用氧气雾化泵将药物雾化,通过调节氧气的出气量使雾化器中药物在30 min内全部雾化完毕。肌肉注射组采用臀部肌肉注射给药,给药剂量为45万IU/kg体质量。
-
按照1.6小节中所述给药方式给药后分别在15 min、30 min、45 min、1 h、2 h、3 h、4 h、6 h、8 h、12 h、24 h、36 h和48 h进行耳缘静脉采血,称重并利用γ计数仪进行放射性计数,利用ORIGIN 8.0软件作图,绘制血药浓度-时间曲线。
-
按照1.6小节中所述给药方式给药后分别在0.5、2、4、8和12 h各取3只大耳白兔,静脉栓塞处死后取肺脏、心脏、部分肝脏、脾脏和肾脏,利用IS In-Vivo FX多功能小动物活体成像系统进行组织的放射性同位素成像。成像完成后,分别取肺脏的不同解剖位置(左上叶、左中叶、左下叶、右上叶、右中叶、右下叶、气管和支气管),称重并利用γ计数仪进行放射性计数,测定肺组织中不同部位的药物分布情况。计算放射性摄取率,以每克组织放射性占注射量的百分比(%ID/g)表示。
-
采用SPSS 19.0软件对数据进行统计学分析,数据以x±s表示。以非房室模型计算药代动力学参数,P<0.05为差异有统计学意义。
-
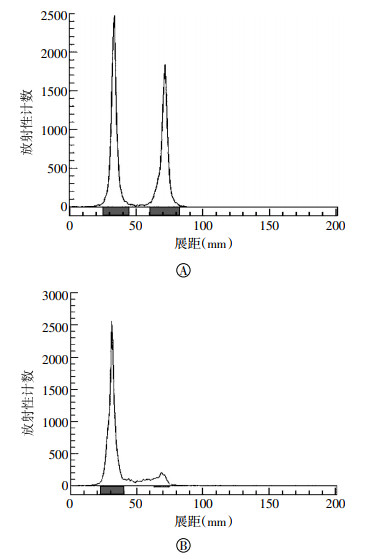
IFNα2b中含有酪氨酸,因此可以进行125I的标记。氯胺-T标记法条件温和,通常不会对蛋白的结构和活性造成影响,是蛋白分子进行放射性核素标记的常用方法。同时,有文献研究表明,125I标记不会影响干扰素的生物学性能[8]。在乙醇和水的层析液中,在硅胶板上游离125I会随层析液向上移动,而蛋白会留在原位。由图 1中A可以看出,125I可以对IFNα2b进行标记,标记率为55.35%。经Sephadex G-50柱分离后,标记化合物的放化纯度为98.2%(图 1中B),能够满足后续实验的要求。
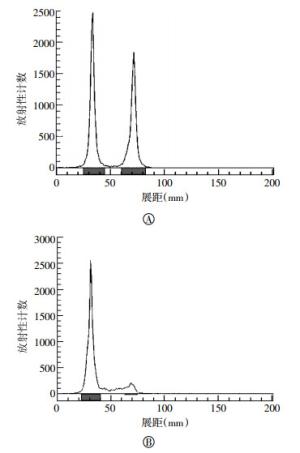
图 1 125I-IFNα2b的放射性薄层扫描结果 图中,A:标记率结果;B:放化纯度结果。IFNα2b:干扰素α2b。
Figure 1. The thin-layer chromatography results of 125I-IFNα2b
因放射性检测的信号是核素125I,为了检测的准确性,必须保证125I-IFNα2b有足够的稳定性,从而使125I不会在检测期间脱离下来。从图 2可以看出,无论是在PBS溶液还是血浆中125I-IFNα2b均具有良好的稳定性,48 h血浆中的稳定性在92%以上,因此标记化合物的稳定性能够符合实验的要求。
-
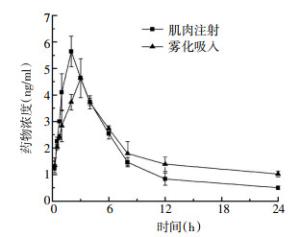
单剂量肌肉注射和雾化吸入IFNα2b后,主要药代动力学参数见表 1。肌肉注射组和雾化吸入组的0~24 h的药物浓度-时间曲线下面积(area under concentration-time curve,AUC0-24)分别为(39.20±1.89)、(45.10±4.65)ng·h-1·ml-1;平均驻留时间(mean retention time,MRT)分别为(6.90±0.21)、(16.10±1.37)h;消除相半衰期T1/2分别为(7.30±0.38)、(12.10±1.19)h。两种方式给药IFNα2b在兔体内的药代动力学参数存在明显的差异。
组别 AUC0-24
(ng·h-1·ml-1)AUC0-inf
(ng·h-1·ml-1)MRT
(h)CL
(ml·kg-1·h-1)Vss
(ml·kg-1)T1/2(h) Cmax
(ng·ml-1)Tmax(h) 肌肉注射组 39.20±1.89 44.50±2.10 6.90±0.21 0.09±0.004 0.60±0.04 7.30±0.38 5.60±0.60 2.00±0.00 雾化吸入组 45.10±4.65 73.10±14.70 16.10±1.37 0.06±0.010 0.90±0.10 12.10±1.19 4.60±0.01 3.00±0.00 t值 2.042 3.334 11.624 4.827 4.247 9.059 3.045 - P值 0.111 0.029 0.000 0.008 0.013 0.001 0.038 - 注:表中,AUC0-24为0~24 h的药物浓度-时间曲线下面积;AUC0-inf为0-下确界的药物浓度-时间曲线下面积;MRT为药物平均驻留时间;CL为药物清除速率;Vss为稳态分布容积;T1/2为半衰期;Cmax为峰浓度;Tmax为达峰时间;-为无此项数据。 表 1 不同方式给药IFNα2b在兔体内的药代动力学参数(n=3,x±s)
Table 1. Pharmacokinetic parameters of IFNα2b in rabbit with different administrations(n=3, x±s)
各时间点测得的血药浓度结果见图 3,雾化吸入IFNα2b的达峰时间比肌肉注射组要晚1 h,最大血药浓度稍低于肌肉注射组,但在血液中的消除更慢,24 h的血药浓度明显高于肌肉注射组(t=6.996,P < 0.01)。
-
不同时间点主要组织IFNα2b的分布结果见图 4。雾化吸入给药后IFNα2b主要分布在肺中,而且清除较慢,给药后12 h仍能观察到放射性信号,而其他组织未观察到放射性信号。肌肉注射给药2 h后在肾脏中检测到较强的放射性信号,之后慢慢减弱,12 h后放射性信号完全消失,表明IFNα2b已经通过肾脏较快地排出体外。
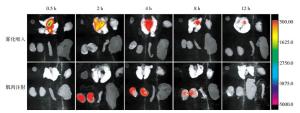
图 4 不同方式给药IFNα2b的组织分布成像 图中,IFNα2b:干扰素α2b。
Figure 4. The imaging of IFNα2b in main organs with different administrations
肺部不同位置的放射性计数见表 2和表 3。由两种给药方式的比较可以看出,雾化吸入组肺部IFNα2b的浓度显著高于肌肉注射组,呈现由气管慢慢向肺部四周扩散的趋势,不同位置的药物浓度存在一定的差异。而肌肉注射组肺部药物浓度呈现先高后低的趋势,不同位置的药物浓度分布基本一致。
肺脏不同部位 0.5 h 2 h 4 h 8 h 12 h 左上叶 8.05±2.11 5.63±1.57 2.55±0.75 3.02±0.63 1.63±0.17 右上叶 6.97±1.83 9.23±2.17 5.72±1.39 4.22±1.08 2.13±0.38 左中叶 7.66±2.37 4.66±1.10 5.99±1.14 3.13±0.86 1.06±0.42 右中叶 10.37±3.13 6.90±2.14 7.35±2.26 3.79±1.10 2.55±0.11 左下叶 3.35±1.09 4.22±0.94 4.50±1.18 2.10±0.37 1.92±0.30 右下叶 4.76±2.05 2.17±0.47 3.38±1.02 1.58±0.61 0.92±0.18 气管 17.34±3.18 10.23±2.93 6.20±2.03 3.22±0.92 1.07±0.16 支气管 5.98±1.37 4.01±1.06 2.48±0.55 2.03±0.46 1.39±0.20 表 2 雾化吸入IFNα2b肺脏不同部位的药物分布(×10-2 %ID/g,n=3,x±s)
Table 2. The distribution of IFNα2b in lung administered via atomization inhalation(×10-2 %ID/g, n=3, x±s)
肺脏不同部位 0.5 h 2 h 4 h 8 h 12 h 左上叶 1.13±0.09 2.09±0.09 0.88±0.15 0.50±0.04 0.58±0.10 右上叶 1.20±0.11 2.23±0.08 0.94±0.04 0.64±0.09 0.65±0.08 左中叶 1.09±0.05 2.58±0.06 0.92±0.10 0.45±0.08 0.46±0.08 右中叶 1.18±0.08 2.10±0.19 0.97±0.07 0.46±0.10 0.52±0.12 左下叶 1.24±0.02 2.07±0.14 1.00±0.19 0.54±0.08 0.54±0.12 右下叶 1.20±0.08 3.07±0.09 0.89±0.12 0.45±0.07 0.56±0.11 气管 1.05±0.18 2.01±0.06 0.91±0.12 0.52±0.10 0.49±0.10 支气管 1.12±0.09 2.12±0.02 0.83±0.08 0.48±0.11 0.47±0.03 表 3 肌肉注射IFNα2b肺脏不同部位的药物分布(×10-2 %ID/g,n=3,x±s)
Table 3. The distribution of IFNα2b in lung administered via intramuscular injection(×10-2 %ID/g, n=3, x±s)
-
上下呼吸道感染疾病高发,特别是儿童及老年等特殊群体患者,其病原体绝大多数为病毒,且病毒多种多样,单一抗病毒药物局限性较大,给疾病的治疗带来了极大的困难。IFNα2b为人体内源性物质,具有广谱抗病毒和调节人体机体免疫的作用。其能够诱导细胞合成抗病毒蛋白体,阻断病毒mRNA与宿主细胞核糖体之间的结合,进而抑制病毒多肽链的合成,阻断病毒的繁殖从而起到抗病毒的作用,因此干扰素对病毒繁殖的抑制具有广谱性。同时干扰素还可增强自然杀伤细胞(NK细胞)、巨噬细胞和T淋巴细胞的活力,从而起到免疫调节作用,并增强抗病毒能力[9-10]。而假单胞菌为人类非致病菌,不含毒性脂多糖成分,培养时间短,表达产品具有许多大肠杆菌表达产品不可比拟的优势,被认为是优于大肠杆菌表达的第二代基因工程干扰素[11]。
IFN-α是目前临床治疗病毒性疾病的常规用药,对于上下呼吸道感染疾病传统的给药方式为皮下或肌肉注射,由于用药后经常出现发热等感冒样症状,患者用药依从性不佳。2012年儿童常见病雾化吸入专家共识指出,可雾化吸入使用的抗病毒药物有干扰素及利巴韦林两种广谱抗病毒药物,但由于利巴韦林需要连续雾化吸入11 h,且需要在封闭空间进行,故不作常规推荐,因此可见干扰素是最为适合的雾化吸入广谱抗病毒药物[12]。第八版《儿科学》也指出,急性支气管炎、支气管肺炎等病毒引起的呼吸系统疾病,可使用IFN-α进行治疗,连续使用5~7 d,肌肉注射或雾化吸入均可。雾化吸入既可起到较为理想的抗病毒疗效,患者用药依从性又极佳,临床用药潜力十分巨大[13]。
虽然在IFNα2b的给药途径中雾化吸入国内报道较多,但几乎没有药代动力学研究。同时,我们采用放射性核素125I标记的技术研究IFNα2b的药代动力学,与传统的酶联免疫吸附法用于干扰素的体内分布研究[14-15]相比具有操作简单、灵敏度高和可以进行直观成像等优势。本研究中,我们比较了雾化吸入与肌肉注射方式给药IFNα2b在兔体内的药代动力学差异,实验结果显示,雾化吸入给药的血液药物浓度Tmax比肌肉注射给药的Tmax晚1 h,两种给药方式下MRT及T1/2存在显著性差异。雾化吸入给药IFNα2b的MRT显著延长,由肌肉注射的约7 h延长至约16 h,MRT延长了一倍多,消除相半衰期由肌肉注射的7.3 h延长至12.1 h,说明IFNα2b通过雾化吸入体内后,药物的作用时间更持久,可以减少给药频次。
组织分布及肺组织不同部位的γ计数结果表明,雾化吸入组给药后IFNα2b主要分布在肺中,药物浓度显著地高于肌肉注射组,且IFNα2b在肺组织内的MRT较长,12 h时仍可通过组织成像检测到药物的分布。而肌肉注射组仅在肾组织中检测到放射性信号,表明IFNα2b主要是通过肾脏排出体内,而且体内代谢较快。
以上实验结果证实:雾化吸入IFNα2b血药浓度比肌肉注射达峰时间晚1 h,最大血药浓度无显著差异,但可以显著提高药物在肺脏中的含量,延长药物作用时间,对于治疗上下呼吸道感染疾病具有更佳的效果。
125I标记注射用干扰素α2b(假单胞菌)研究雾化吸入与肌肉注射的代谢及组织分布差异
Pharmacokinetics and tissue distribution of interferon α2b(Pseudomonas putida) administered via atomization inhalation and intramuscular injection by 125I labeling
-
摘要:
目的 比较采用雾化吸入与肌肉注射两种不同方式给药注射用重组人干扰素α2b(假单胞菌)(IFNα2b),其在兔体内的药代动力学和组织分布差异。 方法 采用125I标记法对IFNα2b进行放射性核素标记,按45万IU/kg体质量(参考人推荐用量15万IU/kg体重)的剂量分别进行雾化吸入和肌肉注射给药,利用放射性同位素示踪技术研究IFNα2b在大耳白兔体内的药代动力学;在0.5、2、4、8和12 h通过活体成像和γ计数检测不同组织和肺脏不同部位的干扰素分布情况。 结果 药代动力学结果表明,肌肉注射组的0~24 h的血药浓度-时间曲线下面积(AUC0-24)为(39.20±1.89)ng·h-1·ml-1,平均驻留时间(MRT)为(6.90±0.21)h,清除速率(CL)为(0.09±0.004)ml·kg-1·h-1,半衰期(T1/2)为(7.30±0.38)h;雾化吸入组的AUC0-24为(45.10±4.65)ng·h-1·ml-1,MRT为(16.10±1.37)h,CL为(0.06±0.010)ml·kg-1·h-1,T1/2为(12.10±1.19)h。体内组织分布结果表明,雾化吸入给药方式IFNα2b主要分布在肺中,12 h仍可观察到肺中有放射性信号,而肌肉注射方式在2 h可观察到肾脏中有较高的放射性信号,之后逐渐减弱。 结论 雾化吸入给药较肌肉注射给药能够明显延长IFNα2b在体内的作用时间,且肺部药物浓度更高。与常规肌肉注射相比,雾化吸入IFNα2b的给药方式可能对治疗肺部病毒性感染和呼吸道感染具有更长的药物作用时间和更好的疗效。 Abstract:Objective To compare the in vivo pharmacokinetics and tissue distribution difference of interferon α2b(IFNα2b, Pseudomonas putida) in rabbits administered via atomization inhalation and intramuscular injection. Methods IFNα2b was radiolabeled with iodine-125 and then administered to rabbits at a dose of 450 000 IU/kg body weight(according to the recommended dosage for humans of 150 000 IU/kg body weight)via atomization inhalation and intramuscular injection. The pharmacokinetics of IFNα2b in rabbits was studied using radioisotope tracer technique. The distribution of IFNα2b in different tissues and the different parts of the lung at 0.5, 2, 4, 8, and 12 h was detected by ex vivo imaging and γ-counting methods. Results The pharmacokinetic results showed that the area under the curve, mean retention time, clearance, and half-life time of intramuscular injection group were (39.20 ± 1.89) ng·h-1·ml-1, (6.90± 0.21) h, (0.09±0.004) ml·kg-1·h-1, and (7.30±0.38) h, respectively, and the corresponding data of atomization inhalation group were (45.10±4.65) ng·h-1·ml-1, (16.10±1.37) h, (0.06 ± 0.010) ml·kg-1·h-1, and(12.10±1.19) h, respectively. The tissue distribution results indicated that the IFNα2b administered via atomization inhalation was mainly distributed in the lung, with the detectable radioactive signal as long as 12 h. However, high radioactive signals were observed in the kidney in the intramuscular injection group at 2 h, and then the signals gradually diminished. Conclusions Compared with the conventional intramuscular injection, atomization inhalation could evidently prolong the in vivo residence time of IFNα2b and exhibited higher lung accumulation. Consequently, the atomization inhalation of IFNα2b may have better therapeutic effect and longer duration of drug action for pulmonary viral and respiratory tract infections. -
Key words:
- Interferon α2b /
- Radiolabeling /
- Iodine radioisotopes /
- Pharmacokinetics /
- Tissue distribution
-
表 1 不同方式给药IFNα2b在兔体内的药代动力学参数(n=3,x±s)
Table 1. Pharmacokinetic parameters of IFNα2b in rabbit with different administrations(n=3, x±s)
组别 AUC0-24
(ng·h-1·ml-1)AUC0-inf
(ng·h-1·ml-1)MRT
(h)CL
(ml·kg-1·h-1)Vss
(ml·kg-1)T1/2(h) Cmax
(ng·ml-1)Tmax(h) 肌肉注射组 39.20±1.89 44.50±2.10 6.90±0.21 0.09±0.004 0.60±0.04 7.30±0.38 5.60±0.60 2.00±0.00 雾化吸入组 45.10±4.65 73.10±14.70 16.10±1.37 0.06±0.010 0.90±0.10 12.10±1.19 4.60±0.01 3.00±0.00 t值 2.042 3.334 11.624 4.827 4.247 9.059 3.045 - P值 0.111 0.029 0.000 0.008 0.013 0.001 0.038 - 注:表中,AUC0-24为0~24 h的药物浓度-时间曲线下面积;AUC0-inf为0-下确界的药物浓度-时间曲线下面积;MRT为药物平均驻留时间;CL为药物清除速率;Vss为稳态分布容积;T1/2为半衰期;Cmax为峰浓度;Tmax为达峰时间;-为无此项数据。 表 2 雾化吸入IFNα2b肺脏不同部位的药物分布(×10-2 %ID/g,n=3,x±s)
Table 2. The distribution of IFNα2b in lung administered via atomization inhalation(×10-2 %ID/g, n=3, x±s)
肺脏不同部位 0.5 h 2 h 4 h 8 h 12 h 左上叶 8.05±2.11 5.63±1.57 2.55±0.75 3.02±0.63 1.63±0.17 右上叶 6.97±1.83 9.23±2.17 5.72±1.39 4.22±1.08 2.13±0.38 左中叶 7.66±2.37 4.66±1.10 5.99±1.14 3.13±0.86 1.06±0.42 右中叶 10.37±3.13 6.90±2.14 7.35±2.26 3.79±1.10 2.55±0.11 左下叶 3.35±1.09 4.22±0.94 4.50±1.18 2.10±0.37 1.92±0.30 右下叶 4.76±2.05 2.17±0.47 3.38±1.02 1.58±0.61 0.92±0.18 气管 17.34±3.18 10.23±2.93 6.20±2.03 3.22±0.92 1.07±0.16 支气管 5.98±1.37 4.01±1.06 2.48±0.55 2.03±0.46 1.39±0.20 表 3 肌肉注射IFNα2b肺脏不同部位的药物分布(×10-2 %ID/g,n=3,x±s)
Table 3. The distribution of IFNα2b in lung administered via intramuscular injection(×10-2 %ID/g, n=3, x±s)
肺脏不同部位 0.5 h 2 h 4 h 8 h 12 h 左上叶 1.13±0.09 2.09±0.09 0.88±0.15 0.50±0.04 0.58±0.10 右上叶 1.20±0.11 2.23±0.08 0.94±0.04 0.64±0.09 0.65±0.08 左中叶 1.09±0.05 2.58±0.06 0.92±0.10 0.45±0.08 0.46±0.08 右中叶 1.18±0.08 2.10±0.19 0.97±0.07 0.46±0.10 0.52±0.12 左下叶 1.24±0.02 2.07±0.14 1.00±0.19 0.54±0.08 0.54±0.12 右下叶 1.20±0.08 3.07±0.09 0.89±0.12 0.45±0.07 0.56±0.11 气管 1.05±0.18 2.01±0.06 0.91±0.12 0.52±0.10 0.49±0.10 支气管 1.12±0.09 2.12±0.02 0.83±0.08 0.48±0.11 0.47±0.03 -
[1] 陆再英, 钟南山.内科学[M]. 7版.北京:人民卫生出版社, 2008:11.
[2] 肖霓光, 张兵, 段招军, 等. 1165例急性下呼吸道感染住院儿童的病毒病原学分析[J].中国当代儿科杂志, 2012, 14(1):28-32.
[3] 王娟, 肖霓光, 周琼华, 等.儿童急性下呼吸道感染常见病毒的流行状态分析[J].中国医师杂志, 2011, 13(1):29-32.
[4] 尹云欢, 陈敬国, 陈琼, 等.小婴儿社区获得性呼吸道感染的病毒源性观察[J].航空航天医学杂志, 2014, 25(7):965-966. doi: 10.3969/j.issn.2095-1434.2014.07.045
[5] 胡兴文, 王维鹏.不同呼吸道病毒在武汉地区儿童中的流行特征分析[J].检验医学与临床, 2014, 11(6):770-772. doi: 10.3969/j.issn.1672-9455.2014.06.021
[6] Diaz KT, Skaria S, Harris K, et al. Delivery and safety of inhaled interferon-γ in idiopathic pulmonary fibrosis[J]. J Aerosol Med Pulm Drug Deliv, 2012, 25(2):79-87. doi: 10.1089/jamp.2011.0919 [7] Gao XF, Yang ZW, Li J. Adjunctive therapy with interferon-gamma for the treatment of pulmonary tuberculosis:a systematic review[J]. Int J Infect Dis, 2011, 15(9):e594-600. doi: 10.1016/j.ijid.2011.05.002 [8] 周尧远, 张荣军, 蔡刚明, 等. 125I-白蛋白融合干扰素α2b大鼠体内分布研究[J].核技术, 2009, 32(2):150-153. doi: 10.3321/j.issn:0253-3219.2009.02.018
[9] Siegal FP, Kadowaki N, Shodell M, et al. The nature of the principal type 1 interferon-producing cells in human blood[J]. Science, 1999, 284(5421):1835-1837. doi: 10.1126/science.284.5421.1835 [10] Diebold SS, Montoya M, Unger H, et al. Viral infection switches non-plasmacytoid dendritic cells into high interferon producers[J]. Nature, 2003, 424(6946):324-328. doi: 10.1038/nature01783 [11] 张磊, 田莉.干扰素的开发现状及趋势[J].天津药学, 2000, 12(4):11-12.
[12] 洪建国, 陈强, 陈志敏, 等.儿童常见呼吸道疾病雾化吸入治疗专家共识[J].中国实用儿科杂志, 2012, 27(4):265-269.
[13] 王卫平, 毛萌, 李廷玉, 等.儿科学[M]. 8版.北京:人民卫生出版社, 2013:283.
[14] 叶志伟, 梁文权.干扰素-α脂质体的药代动力学和体内分布性质研究[C].全国生化与生物技术药物学术研讨会, 2003: 117-120.
[15] 杨丽, 刘茜, 王东凯, 等.重组人干扰素α2b纳米粒小鼠体内药物动力学及组织分布[J].沈阳药科大学学报, 2006, 23(11):690-693. doi: 10.3969/j.issn.1006-2858.2006.11.003
-





 下载:
下载: