-
Graves甲状腺功能亢进症(简称甲亢)是最常见的甲状腺自身免疫性甲状腺毒症(thyrotoxicosis)。Graves甲亢需要与甲状腺炎导致的破坏性的甲状腺毒症进行鉴别,后者主要包括亚急性甲状腺炎(subacute thyroiditis)、无痛性甲状腺炎(painless thyroiditis,PT)和产后甲状腺炎(postpartum thyroiditis)。二者鉴别的临床意义在于治疗方案的不同,前者的治疗方法包括抗甲状腺药物治疗、131I治疗和手术治疗,后者以对症治疗或给予糖皮质激素治疗为主[1-3]。临床上PT并不少见,占甲状腺毒症的9%~23%;PT可以发生在Graves甲亢治疗后的缓解期,而多次反复发作的PT缓解后也可以出现Graves甲亢。目前,最佳的鉴别诊断方法是甲状腺摄131I率(radioactive iodine uptake,RAIU)测定或甲状腺静态显像。RAIU用于辅助诊断甲亢和甲状腺功能减退症(简称甲减),在体外利用甲状腺功能仪探测甲状腺吸收131I发射的γ射线,可以获得不同时间甲状腺部位的放射性计数,从而判定甲状腺的功能状态。甲状腺静态显像目前在临床上用于了解甲状腺的位置、形态、大小及功能状态,并可以辅助诊断及鉴别甲亢与甲状腺炎[4]。但这两项检查具有一定的辐射损伤性,因此存在一定的局限性[5-6]。
MRI弥散加权成像(diffusion-weighted imaging,DWI)是目前在活体上进行组织水分子弥散运动测量与成像的唯一方法。在DWI中,表观弥散系数(apparent diffusion coefficient,ADC)代表水分子移动的自由度,是反映水分子弥散的参数,ADC与组织的细胞密度呈负相关。早期对ADC的研究主要是在神经系统研究方面,目前更多地集中在肿瘤研究中,因为癌组织的细胞密度大、水分子弥散受限导致ADC降低。已经有研究证明ADC和反映肿瘤葡萄糖代谢的18F-FDG PET/CT的SUV是呈负相关的,这些研究也包括在头颈部肿瘤中的研究[7-9]。目前尚未见到使用ADC鉴别Graves甲亢与PT的报道。
本研究旨在通过前瞻性研究,探讨DWI、RAIU测定、甲状腺静态显像以及促甲状腺激素受体抗体(thyrotropin receptor antibody,TRAb)水平测定等在Graves甲亢与PT鉴别中的价值。
-
2010年8月至2013年8月,共有102例Graves甲亢患者(男性31例、女性71例,年龄16~65岁,平均年龄38.0岁)和37例PT患者(男性10例、女性27例,年龄21~61岁,平均年龄35.1岁)入组,上述Graves甲亢和PT患者的诊断标准均满足美国甲状腺协会和内分泌医师协会颁布的诊疗指南[1]。所有患者均签署知情同意书并记录患者年龄和性别。
-
使用德国Siemens公司ADVIA Centaur全自动化学发光免疫分析仪测定血清甲状腺激素水平,包括游离三碘甲状腺原氨酸(free triiodothyronine,FT3)(参考范围3.50~6.50 pmol/L),游离甲状腺素(free thyroxine,FT4)(参考范围11.50~23.50 pmol/L)和TSH(参考范围0.20~5.00 mIU/L)。使用德国Siemens公司IMMULITE 2000全自动化学发光免疫分析仪测定甲状腺球蛋白抗体(thyroid globulin antibody,TgAb)水平(参考范围0~40.00 IU/ml)和甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)水平(参考范围0~35.00 IU/ml)。使用深圳雷杜公司生产的RayTo-6000酶标分析仪,采用酶联免疫分析法测定TRAb水平(参考范围0~1.50 IU/L)。使用科大创新股份有限公司的MN-6300XT型核多功能仪测定甲状腺24 h RAIU。使用美国通用电气公司Discovery VH型SPECT仪(配备低能平行孔准直器)进行甲状腺静态显像。由两位高年资的核医学医师采用双盲法阅片并进行诊断,甲亢患者甲状腺可弥漫性增大,腺体内显像剂分布增浓且均匀,而甲状腺炎患者多表现为显像剂的局限性分布稀疏和缺损[4]。
-
使用美国通用电气公司Signa HDx型3.0T超导型核磁扫描仪(配备8通道头颈联合相控阵线圈)完成MRI检查。T1加权像参数:重复时间(repetition time,TR)780 ms,回波时间(echo time,TE)11 ms,回波链长度3,视野24 cm×24 cm,矩阵320×224,层厚5.0 mm,层间距1.0 mm。T2加权像参数:TR 5000 ms,TE 102 ms,回波链长度18,视野24 cm×24 cm,矩阵288×256,层厚5.0 mm,层间距1.0 mm。成像序列:TR 5000 ms,TE 75 ms,回波链长度20,视野24 cm×24 cm,矩阵128×128,层厚5.0 mm,层间距1.0 mm。b值选取0和1000 s/mm2。采用该核磁扫描仪软件工作站进行图像后处理,测量甲状腺ADC。首先将DWI图像与T1加权或T2加权图像进行自动匹配,然后用鼠标在图像上沿甲状腺实质边缘画出ROI,分别在甲状腺两侧叶的上极、中部和下极共6个部位进行测量,取6个部位ADC的平均值作为该甲状腺腺体的ADC。
-
对Graves甲亢患者给予抗甲状腺药物治疗、131I治疗或手术治疗;对PT患者以对症治疗为主,对于症状明显者给予糖皮质激素治疗。Graves甲亢患者的病理组织从接受手术的患者中获取,PT患者的病理组织从接受活检的患者中获取。对组织进行常规苏木精-伊红染色,得到病理图像。
-
采用SPSS 17.0软件进行统计学分析,数据结果用x±s表示。两组间的比较采用独立样本t检验,χ2检验用于明确性别是否影响阳性显像结果,Pearson χ2检验用于明确各指标间的相关性,采用受试者工作特征曲线(receiver operating characteristic curve,ROC)分析各项指标的诊断价值,确定各项指标的切分点值并判断各项指标的诊断灵敏度、特异度、准确率、阳性预测值和阴性预测值。P<0.05表示差异有统计学意义。
-
Graves甲亢患者与PT患者比较,前者的ADC、FT3、TRAb水平和RAIU显著高于后者(t=15.126、3.682、7.226和31.574,P均<0.01)(表 1)。ADC、TRAb水平和RAIU三者之间存在显著的正相关性,相关系数均在0.700以上(P<0.01)(表 2)。χ2检验显示不同性别对两种疾病的鉴别无显著影响(χ2=0.148,P>0.05)。
组别 例数 年龄 ADC FT3 FT4 TSH TRAb TgAb TPOAb RAIU FT3/FT4 Graves甲亢 102 37.971±13.856 2.212±0.209 15.555±6.507 68.868±31.608 0.007±0.008 9.378±6.877 317.001±718.324 444.047±389.482 66.358±11.799 0.237±0.045 无痛性甲状腺炎 37 35.054±12.326 1.508±0.318 11.336±4.111 54.598±22.049 0.008±0.016 1.123±1.472 415.379±630.150 464.341±337.990 3.678± 4.075 0.219±0.051 t值 1.128 15.126 3.682 2.529 -0.909 7.226 -0.736 -0.281 31.574 2.046 P值 >0.05 <0.01 <0.01 <0.05 >0.05 <0.01 >0.05 >0.05 <0.01 <0.05 注:表中,ADC:表观弥散系数;FT3:游离三碘甲状腺原氨酸;FT4:游离甲状腺素;TRAb:促甲状腺激素受体抗体;TgAb:甲状腺球蛋白抗体;TPOAb:甲状腺过氧化物酶抗体;RAIU:甲状腺摄131I率。 表 1 Graves甲状腺功能亢进症和无痛性甲状腺炎的各指标比较
(x±s) Table 1. Comparisons of differential parameters between Graves disease and painless thyroiditis
(x±s) 指标名称 ADC TRAb RAIU 年龄 0.009 -0.055 0.079 ADC - 0.777* 0.902* FT3 0.524* 0.730* 0.479* FT4 0.436* 0.652* 0.401* TSH -0.060 -0.055 -0.075 TRAb 0.777* - 0.731* TgAb -0.043 -0.037 -0.095 TpoAb 0.015 -0.252* -0.082 RAIU 0.902* 0.731* - FT3/FT4 0.031 -0.085 0.051 注:表中,ADC:表观弥散系数;FT3:游离三碘甲状腺原氨酸;FT4:游离甲状腺素;TRAb:促甲状腺激素受体抗体;TgAb:甲状腺球蛋白抗体;TPOAb:甲状腺过氧化物酶抗体;RAIU:甲状腺摄131I率;*表示P<0.01;“-”表示无此项数据。 表 2 各指标的Pearson相关性分析
Table 2. Pearson bivariate correlations among differential parameters
-
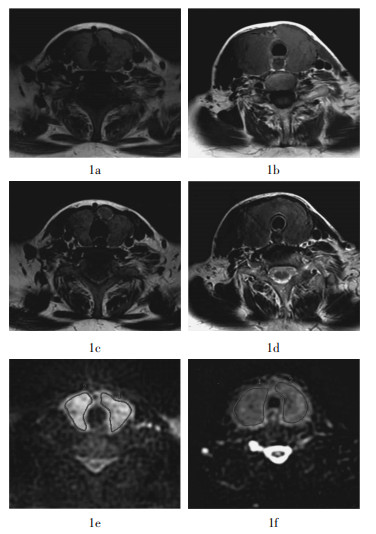
由放射科医师目测MRI显像结果,Graves甲亢和PT的T1加权图像(图 1a、1b)和T2加权图像(图 1c、1d)的信号强度没有明显的差异;但DWI图像显示,Graves甲亢的ADC信号强度显著高于PT的信号强度(图 1e、1f)。甲状腺静态显像结果显示,Graves甲亢患者甲状腺对核素的摄取能力明显增高,而PT患者甲状腺对核素的摄取能力明显降低(图 2)。
-
绘制各指标对鉴别诊断Graves甲亢和PT的ROC(图 3),可见各指标的曲线下面积由高到低的排序依次是:RAIU>ADC>TRAb(其值分别为1.000>0.980>0.925),且曲线下面积均高于0.900,说明这3个指标有很好的诊断价值。根据ROC获得切分点值、灵敏度、特异度、准确率、阳性预测值、阴性预测值(表 3),可见RAIU具有最好的诊断价值,当最佳切分点值确定为24.500%时,灵敏度、特异度、准确率、阳性预测值和阴性预测值均为100.00%;ADC比TRAb的诊断价值更高,当最佳切分点值分别确定为1.837×10-3 mm2/s和1.350 IU/ml时,前者的灵敏度、特异度、准确率、阳性预测值和阴性预测值均在89%~97%,而后者在70%~90%。

图 3 ADC、TRAb、RAIU鉴别Graves甲状腺功能亢进症和无痛性甲状腺炎的ROC曲线 图中,ADC:表观弥散系数;TRAb:促甲状腺激素受体抗体;RAIU:甲状腺摄131I率。
Figure 3. Receiver operating characteristic curves of ADC, TRAb and RAIU for differentiatial diagnosis between Graves disease and painless thyroiditis
指标名称 切分点值 灵敏度(%) 特异度(%) 准确率(%) 阳性预测值(%) 阴性预测值(%) ADC 1.837×10-3 mm2/s 96.078 91.892 95.000 97.059 89.474 TRAb 1.350 IU/ml 88.235 75.676 84.892 90.909 70.000 RAIU 24.500% 100 100 100 100 100 注:表中,ROC:受试者工作特征曲线;ADC:表观弥散系数;TRAb:促甲状腺激素受体抗体;RAIU:甲状腺摄131I率。 表 3 ROC分析各指标对Graves甲状腺功能亢进症和无痛性甲状腺炎的鉴别诊断价值
Table 3. Differentiation diagnostic values of differential parameters analyzed by receiver operating characteristic curves
-
在102例Graves甲亢患者中,有18例接受抗甲状腺药物治疗、78例进行了131I治疗、6例接受手术治疗,病理组织从6例接受手术治疗的患者中获得。在37例PT患者中,对2例多次复发的患者取组织活检。病理组织学结果(图 4):Graves甲亢的镜下表现为滤泡增生,滤泡上皮细胞增生,滤泡上皮细胞形成一些乳头状突起突入滤泡腔,间质血管扩张、充血,可见淋巴细胞浸润;PT的镜下表现为滤泡明显破坏,有大量的淋巴细胞浸润及淋巴滤泡形成。二者比较,PT的细胞密度远大于Graves甲亢。
-
具有突眼、胫前黏液水肿等特征性临床表现的典型Graves甲亢,其诊断简单、明确。有发热和上呼吸道感染病史,后出现甲状腺部位疼痛,结合甲状腺激素水平升高、RAIU降低和(或)甲状腺静态显像显示甲状腺摄取能力明显下降的患者,可以明确诊断为亚急性甲状腺炎。但对于PT,由于没有亚急性甲状腺炎的上呼吸道感染病史和甲状腺疼痛的体征,从临床指标角度与Graves甲亢的鉴别并不容易。
在临床实践中,鉴别Graves甲亢与PT的有价值的检查方法是RAIU测定和甲状腺静态显像。实际上,RAIU测定和甲状腺静态显像所反映出的是Graves甲亢和PT患者当时的甲状腺滤泡功能,即Graves甲亢患者甲状腺滤泡细胞对碘的摄取能力增高,而PT患者甲状腺滤泡细胞对碘的摄取能力降低[10-11]。本研究证实RAIU测定在炎症早期对于这两种疾病的鉴别诊断有着重要的临床意义。
从病理学的角度来看,Graves甲亢和PT的另一个明显的差异是淋巴细胞的浸润程度不同所导致的细胞密度的差异。Graves甲亢在镜下的主要表现为滤泡增生、滤泡上皮细胞增生以及血管扩张和充血,淋巴细胞浸润程度相对较低;而PT在镜下的主要表现为淋巴细胞浸润、淋巴滤泡形成以及滤泡的破坏。本研究发现,能够反映这种病生理变化的影像学检查方法是甲状腺静态显像或DWI。
DWI是活体检测水分子自由运动(又叫Brownian运动)的功能成像手段,通常以ADC来描述组织中水分子弥散的快慢,进而反映组织微观结构的特点及其变化。一般来讲,ADC低说明水分子弥散受限(提示组织细胞密度高),ADC高说明水分子弥散自由(提示组织细胞密度低)。DWI应用最早、最经典的是在脑神经系统研究方面,如急性脑中风[12],近些年在肿瘤领域的研究也获得了重大的突破,正是因为DWI在肿瘤学领域研究的成功,才促使我们将其用于鉴别Graves甲亢与PT的研究。
本研究发现,在Graves甲亢与PT的鉴别诊断中,ADC比酶联免疫分析方法测定的TRAb的诊断价值高,当最佳切分点值分别确定为1.837×10-3 mm2/s和1.350 IU/ml时,前者的灵敏度、特异度、准确率、阳性预测值和阴性预测值均在89%~97%、后者在70%~90%。PT在大量的淋巴细胞浸润及淋巴滤泡形成后,细胞密度远大于Graves甲亢细胞密度,ADC反映的就是这种病生理变化。Tezuka等[13]在应用ADC鉴别Graves甲亢(24例)与亚急性甲状腺炎(5例)以及桥本甲状腺炎(5例)的研究中发现,Graves甲亢患者的ADC比后两者明显增高,且差异有统计学意义。笔者认为,PT、亚急性甲状腺炎以及桥本甲状腺炎均是以明显的淋巴细胞浸润为主要特点,会导致细胞密度的增高、ADC降低,因此Tezuka等的发现与本研究的结果是一致的。此外,Tezuka等还提出Graves甲亢患者ADC增高可能还与Graves甲亢血供较甲状腺炎丰富有关。
总之,本研究证明在Graves甲亢与PT的鉴别诊断中,ADC、RAIU和TRAb均有价值,其中,RAIU最佳、ADC次之。ADC的显像原理是基于不同疾病细胞密度差异的病生理变化,而RAIU的测定原理是反映不同疾病对碘摄取能力差异的病生理变化。
MRI弥散加权成像、甲状腺摄碘率和血清指标测定鉴别Graves甲状腺功能亢进症和无痛性甲状腺炎的研究
Differentiation between Graves disease and painless thyroiditis by diffusion-weighted imaging, thyroid radioactive iodine uptake and serum parameters measurement
-
摘要:
目的 研究MRI弥散加权成像(DWI)的表观弥散系数(ADC)、甲状腺摄131I率(RAIU)和血清指标等在Graves甲状腺功能亢进症(简称甲亢)和无痛性甲状腺炎(PT)鉴别中的价值。 方法 选取102例Graves甲亢患者和37例PT患者入组。测定所有患者的血清游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、TSH、甲状腺球蛋白抗体(TgAb)、甲状腺过氧化物酶抗体(TPOAb)和促甲状腺激素受体抗体(TRAb)水平。采用3.0T超导型MRI仪完成MRI检查,并获得ADC。测定甲状腺24 h RAIU,并进行甲状腺静态显像。Graves甲亢患者的病理组织从接受手术的患者中获取(6例),PT患者的病理组织从接受活检的患者中获取(2例)。采用Pearson检验明确各指标间的相关性,用受试者工作特征曲线(ROC)分析各项指标的诊断价值,确定各项指标的切分点值,并判断各项指标的诊断灵敏度、特异度、准确率、阳性预测值和阴性预测值。 结果 与PT患者比较,Graves甲亢患者的ADC、TRAb和RAIU显著升高(t=15.126、7.226和31.574,P均<0.01)。ADC、TRAb和RAIU之间存在显著的正相关性。ROC显示,RAIU、ADC和TRAb的曲线下面积大于0.900。其中,RAIU具有最好的诊断价值,当最佳切分点值确定为24.500%时,灵敏度、特异度、准确率、阳性预测值和阴性预测值均为100%。ADC比TRAb的诊断价值更高,当最佳切分点值分别确定为1.837×10-3 mm2/s和1.350 IU/ml时,ADC的上述统计指标分别为96.078%、91.892%、95.000 %、97.059 %和89.474 %,TRAb的上述统计指标分别为88.235%、75.676%、84.892%、90.909%和70.000%。病理组织学结果显示:Graves甲亢以滤泡增生、滤泡上皮细胞增生以及血管扩张和充血为主要表现;PT以淋巴细胞浸润、淋巴滤泡形成以及滤泡破坏为主要表现。 结论 对于Graves甲亢和PT的鉴别,RAIU、ADC和TRAb均有价值,RAIU最佳、ADC次之。ADC的显像原理是基于不同疾病细胞密度差异的病生理变化,而RAIU的测定原理是反映不同疾病对碘摄取能力差异的病生理变化。 Abstract:Objective To assess the value of apparent diffusion coefficient(ADC) in diffusion-weighted imaging(DWI), thyroid radioactive iodine uptake(RAIU)and serum parameters in differential diagnosis between Graves disease(GD)and painless thyroiditis(PT). Methods One hundred and two patients with GD and 37 patients with PT were enrolled. Serum thyroid hormones and antibodies were measured, including free triiodothyronine(FT3), free thyroxine(FT4), TSH, thyroid globulin antibody(TgAb), thyroid peroxidase antibody(TPOAb) and thyrotropin receptor antibody(TRAb). DWI was obtained with a 3.0 T MR scanner, and ADC values were calculated. 24 h later RAIU and thyroid scintigraphy were conducted. Tissue samples were obtained in GD patients(6 cases) after thyroidectomy and in PT patients(2 cases) after biopsy. Pearson bivariate correlation was made. Receiver operating characteristic curves(ROC) were drawn and diagnostic efficacies were determined. Optimal cut-off values were selected, and then sensitivity, specificity, accuracy, positive predictive value and negative predictive value were assessed. Results ADC, TRAb and RAIU were significantly higher in GD than in PT(t=15.126, 7.226 and 31.574, with all P < 0.01). And they were closely and positively correlated. ROC showed areas under the curves for RAIU, ADC and TRAb were higher than 0.900. RAIU was the best method to differentiate GD from PT. When cutoff value of RAIU was determined as 24.500 %, sensitivity, specificity, accuracy, positive predictive value and negative predictive value were all 100%. The above statistical data were 96.078%, 91.892%, 95.000%, 97.059% and 89.474% for ADC, and 88.235%, 75.676%, 84.892%, 90.909% and 70.000% for TRAb, when the optimal thresholds of 1.837×10-3 mm2/s and 1.350 IU/ml were determined respectively. ADC was better than TRAb. Histopathology results showed that for GD, follicle hyperplasia, follicular epithelial cells hyperplasia, hyper-vascularity and congestive perfusion were characteristic features; while for PT, massive lymphocytic infiltration with hyperplastic germinal center formation and follicle disruption were characteristic features. Conclusions RAIU, DWI and TRAb were all of diagnostic values for differentiation between GD and PT, RAIU was the best method and DWI followed. DWI has great potential for thyroid pathophysiological imaging because it reflects tissue cellularity differences between GD and PT. The principle for RAIU is that it reflects the iodine uptake changes in different diseases. -
表 1 Graves甲状腺功能亢进症和无痛性甲状腺炎的各指标比较
(x±s) Table 1. Comparisons of differential parameters between Graves disease and painless thyroiditis
(x±s) 组别 例数 年龄 ADC FT3 FT4 TSH TRAb TgAb TPOAb RAIU FT3/FT4 Graves甲亢 102 37.971±13.856 2.212±0.209 15.555±6.507 68.868±31.608 0.007±0.008 9.378±6.877 317.001±718.324 444.047±389.482 66.358±11.799 0.237±0.045 无痛性甲状腺炎 37 35.054±12.326 1.508±0.318 11.336±4.111 54.598±22.049 0.008±0.016 1.123±1.472 415.379±630.150 464.341±337.990 3.678± 4.075 0.219±0.051 t值 1.128 15.126 3.682 2.529 -0.909 7.226 -0.736 -0.281 31.574 2.046 P值 >0.05 <0.01 <0.01 <0.05 >0.05 <0.01 >0.05 >0.05 <0.01 <0.05 注:表中,ADC:表观弥散系数;FT3:游离三碘甲状腺原氨酸;FT4:游离甲状腺素;TRAb:促甲状腺激素受体抗体;TgAb:甲状腺球蛋白抗体;TPOAb:甲状腺过氧化物酶抗体;RAIU:甲状腺摄131I率。 表 2 各指标的Pearson相关性分析
Table 2. Pearson bivariate correlations among differential parameters
指标名称 ADC TRAb RAIU 年龄 0.009 -0.055 0.079 ADC - 0.777* 0.902* FT3 0.524* 0.730* 0.479* FT4 0.436* 0.652* 0.401* TSH -0.060 -0.055 -0.075 TRAb 0.777* - 0.731* TgAb -0.043 -0.037 -0.095 TpoAb 0.015 -0.252* -0.082 RAIU 0.902* 0.731* - FT3/FT4 0.031 -0.085 0.051 注:表中,ADC:表观弥散系数;FT3:游离三碘甲状腺原氨酸;FT4:游离甲状腺素;TRAb:促甲状腺激素受体抗体;TgAb:甲状腺球蛋白抗体;TPOAb:甲状腺过氧化物酶抗体;RAIU:甲状腺摄131I率;*表示P<0.01;“-”表示无此项数据。 表 3 ROC分析各指标对Graves甲状腺功能亢进症和无痛性甲状腺炎的鉴别诊断价值
Table 3. Differentiation diagnostic values of differential parameters analyzed by receiver operating characteristic curves
指标名称 切分点值 灵敏度(%) 特异度(%) 准确率(%) 阳性预测值(%) 阴性预测值(%) ADC 1.837×10-3 mm2/s 96.078 91.892 95.000 97.059 89.474 TRAb 1.350 IU/ml 88.235 75.676 84.892 90.909 70.000 RAIU 24.500% 100 100 100 100 100 注:表中,ROC:受试者工作特征曲线;ADC:表观弥散系数;TRAb:促甲状腺激素受体抗体;RAIU:甲状腺摄131I率。 -
[1] Bahn RS, Burch HB, Cooper DS, et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists[J]. Endocr Pract, 2011, 17(3): 456-520, 593-646. doi: 10.4158/EP.17.3.456 [2] 蒋宁一, 林岩松, 关海霞, 等. 131I治疗格雷夫斯甲亢指南(2013版)[J].中华核医学与分子影像杂志, 2013, 33(2): 83-94. doi: 10.3760/cma.j.issn.2095-2848.2013.02.002
[3] 蒋宁一, 匡安仁, 谭建, 等. 131I治疗Graves甲亢专家共识(2010年)[J].中华核医学杂志, 2010, 30(5): 346-351. doi: 10.3760/cma.j.issn.0253-9780.2010.05.019
[4] 张永学, 黄钢.核医学[M]. 2版.北京:人民卫生出版社, 2010: 211-219.
[5] Kubota S, Tamai H, Ohye H, et al. Transient hyperthyroidism after withdrawal of antithyroid drugs in patients with Graves' disease[J]. Endocr J, 2004, 51(2): 213-217. doi: 10.1507/endocrj.51.213 [6] Ho SC, Eng PH, Fok AC, et al. Thyrotoxicosis due to the simultaneous occurrence of silent thyroiditis and Graves' disease[J]. Thyroid, 1999, 9(11): 1127-1132. doi: 10.1089/thy.1999.9.1127 [7] Padhani AR, Liu G, Koh DM, et al. Diffusion-weighted magnetic resonance imaging as a cancer biomarker: consensus and recommendations[J]. Neoplasia, 2009, 11(2): 102-125. doi: 10.1593/neo.81328 [8] Nakajo M, Nakajo M, Kajiya Y, et al. FDG PET/CT and diffusion-weighted imaging of head and neck squamous cell carcinoma: comparison of prognostic significance between primary tumor standardized uptake value and apparent diffusion coefficient[J]. Clin Nucl Med, 2012, 37(5): 475-480. doi: 10.1097/RLU.0b013e318248524a [9] Choi SH, Paeng JC, Sohn CH, et al. Correlation of 18F-FDG uptake with apparent diffusion coefficient ratio measured on standard and high b value diffusion MRI in head and neck cancer[J]. J Nucl Med, 2011, 52(7): 1056-1062. doi: 10.2967/jnumed.111.089334 [10] Hiraiwa T, Ito M, Imagawa A, et al. High diagnostic value of a radioiodine uptake test with and without iodine restriction in Graves' disease and silent thyroiditis[J]. Thyroid, 2004, 14(7): 531-515. doi: 10.1089/1050725041517011 [11] Osaki Y, Sakurai K, Arihara Z, et al. Prediction of late(24-hour) radioactive iodine uptake using early(3-hour) uptake values in Japanese patients with Graves' disease[J]. Endocr J, 2012, 59(2): 173-177. doi: 10.1507/endocrj.EJ11-0279 [12] Liu Z, Xiao X. The use of multi b values diffusion-weighted imaging in patients with acute stroke[J]. Neuroradiology, 2013, 55(3): 371-376. doi: 10.1007/s00234-012-1129-2 [13] Tezuka M, Murata Y, Ishida R, et al. MR imaging of the thyroid: correlation between apparent diffusion coefficient and thyroid gland scintigraphy[J]. J Magn Reson Imaging, 2003, 17(2): 163-169. -






 下载:
下载: