-
肿瘤新生血管是胶质瘤病理分级的重要基础,包括供血动脉生成和引流静脉形成,MRI基本扫描序列对于肿瘤供血动脉的显示效果不佳,而磁敏感加权成像(susceptibility weighted imaging,SWI)能清晰显示各级静脉。基于此,本研究回顾性分析39例胶质瘤患者的SWI资料,研究胶质瘤瘤内静脉表现,以期为胶质瘤分级提供新的思路。
-
收集本院2011年3月至2014年3月经手术病理证实的胶质瘤39例,其中,男性23例、女性16例,年龄24~72岁,中位年龄46岁。参照WHO 2007版中枢神经系统肿瘤分级标准,其中,低级别胶质瘤18例(WHO Ⅰ~Ⅱ级)、高级别胶质瘤21例(WHO Ⅲ~Ⅳ级)。
-
应用美国GE公司Signa Excite HD 3.0T MRI成像系统,对所有患者行MRI平扫,扫描序列包括快速自旋回波T2加权(重复时间5100 ms、回波时间117 ms),T2液体衰减反转恢复序列(重复时间9500 ms、回波时间132 ms)及T1加权(重复时间3000 ms、回波时间12 ms),层间距1 mm,层厚5 mm,视野24 cm×24 cm。采用三维GRASS序列(重复时间36 ms、回波时间20 ms)行SWI,翻转角15°,层厚2 mm,无间隔,矩阵448×384,覆盖全脑。SWI序列扫描结束后行T1加权序列(重复时间2386 ms、回波时间8 ms)的轴位、矢状位及冠状位增强扫描。
-
采用GE ADW 4.2工作站进行SWI图像后处理。SWI序列扫描结束后对原始数据幅度图行轴位最小密度投影重建获得SWI图。放大SWI图对瘤内静脉进行观察。瘤内静脉在SWI图上表现为细线状、长条状、弯曲走行的管状结构,或连续层面可追踪的低信号点。根据瘤内静脉数量,按0~2分共3级进行评分:0分,瘤内无静脉;1分,静脉稀疏分布;2分,静脉密集分布。瘤内静脉数量的判定参考Kim等[1]的分级标准,将静脉数<10条者划分为稀疏分布,≥10条者归为密集分布。上述工作均在两名高年资影像学医师的指导下完成,以目测方式对图像进行判读。
-
统计学分析采用SPSS17.0软件包。SWI图像上不同级别胶质瘤瘤内静脉检出率的比较采用χ2检验,不同级别胶质瘤瘤内静脉评分的比较采用Wilcoxon秩和检验。对等级资料相关性分析采用Spearman分析。以α=0.05为检验水准,P<0.05表示差异有统计学意义。
-
39例胶质瘤均为单发病灶。低级别胶质瘤表现为类圆形或椭圆形,信号较均匀,T2加权像呈高信号,T1加权像呈低信号,增强后15例肿瘤无强化,3例瘤内见小片絮状轻-中度强化,肿瘤无明显占位效应,瘤周均无明显水肿。高级别胶质瘤表现为不规则形,边界不清,信号不均匀,T2加权像以稍高信号为主,T1加权像以稍低信号为主,瘤周水肿和占位效应明显,增强扫描为花环状或不规则形强化。
-
在SWI图像上,18例低级别胶质瘤中有5例肿瘤内检出静脉结构(28%),而21例高级别胶质瘤肿瘤内均检出静脉结构(100%),不同级别胶质瘤瘤内静脉的检出率比较,差异有统计学意义(χ2=22.750,P<0.01)。在静脉评分比较上,低级别胶质瘤中0分13例,1分5例;高级别胶质瘤中1分4例,2分17例。低级别胶质瘤与高级别胶质瘤瘤内静脉评分比较差异有统计学意义,前者瘤内静脉评分明显低于后者(Z=-5.411,P<0.01)。Spearman相关性分析显示,瘤内静脉评分与病理级别呈正相关(r=0.878,P<0.01)。在形态上,低级别胶质瘤瘤内静脉表现为均匀细线条状,走行较为自然,未见吻合支;高级别胶质瘤瘤内静脉分布不规则,粗细不均且走行迂曲、紊乱,部分可见杂乱细小的吻合支及较为粗大引流静脉(图 1~图 4)。

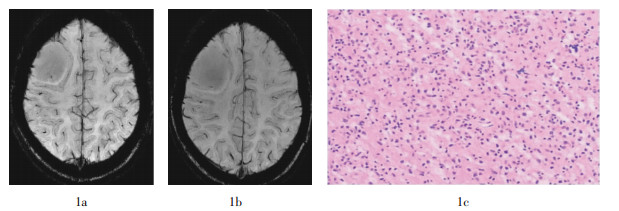
图 1 右侧额叶低级别胶质瘤磁敏感加权成像图和病理切片图。患者女性,25岁。图中,1a~1b:磁敏感加权成像肿瘤内未见静脉结构;1c:病理切片未见肿瘤血管(苏木精-伊红染色,×200)。
Figure 1. The susceptibility weighted imaging and pathology map of low grade glioma in the right frontal lobe

图 2 右侧顶叶胶质母细胞瘤磁敏感加权成像图和病理切片图。患者男性,56岁。图中,2a~2b:磁敏感加权成像肿瘤内见密集分布静脉结构,并见细小吻合支;2c:病理切片见丰富肿瘤血管(苏木精-伊红染色,×200)。
Figure 2. The susceptibility weighted imaging and pathology map of glioblastoma in the right parietal lobe
-
胶质瘤分级的病理学基础包括瘤细胞密度、细胞异型性、新生血管、有无坏死等。其中,肿瘤新生血管在胶质瘤分级中占最重要的位置。肿瘤新生血管形成包括供血动脉生成和引流静脉的形成。MRI基本扫描序列所得影像无法清晰显示这些血管。SWI是利用不同组织间磁敏感性的差异而成像的技术,其一次扫描可同时采集幅度像(magnitude images)和相位像(phase images)。然后通过对原始数据进行滤波、校正、算术运算和最小密度投影重建等后处理而获得SWI图像。SWI在技术上综合运用了磁矩图和相位图的信息,通过后处理,能够更加灵敏地显示顺磁性物质,如血液代谢产物中的脱氧血红蛋白等。由于静脉血含有脱氧血红蛋白,其在成为一种内源性对比剂的同时,也增加了血管与周围组织的相位差,在SWI图像上,即使小静脉也能够清晰地显示出来。可见,SWI技术使得通过MRI图像观察肿瘤内血管结构成为可能,尤其在显示小静脉方面有显著优势,可清晰显示各级静脉[2-4],从而有助于病变性质的判定。
有文献报道,SWI可用于胶质瘤分级,其观察指标主要为肿瘤内磁敏感信号(intratumoral susceptibility signals,ITSS)[5-7],ITSS是指肿瘤内聚集或不聚集的细条线状或点状结构,前者为肿瘤内静脉,后者为肿瘤内微出血灶。Park等[6]和Pinker等[8]利用SWI技术对胶质瘤进行研究发现,低级别胶质瘤内未见明确ITSS,而高级别胶质瘤内均可见ITSS,且随级别的增加,ITSS数量越多。但这些研究都笼统地将肿瘤内静脉和出血灶混合在一起进行研究。而SWI图像显示,肿瘤内静脉在形态上异于微出血灶,表现为轴位上边界清楚的长条状直线或弯曲走行的管线状结构低信号,或连续层面可观察到边界清楚的类圆形点状低信号。而肿瘤内微出血灶表现为肿瘤内不规则斑点状或簇状低信号影,与周围血管无延继性。研究表明,恶性肿瘤瘤体内有出血倾向[9]。本研究也发现高级别胶质瘤比低级别者微出血灶的出现率更高,且数量也更多。但由于本研究的观察对象为胶质瘤SWI图像上的瘤体内静脉结构而非ITSS,故未对肿瘤内出血灶作进一步统计学分析。
本研究中,21例高级别胶质瘤瘤内均出现静脉结构,18例低级别胶质瘤中有13例瘤内未见静脉结构,二者间差异有统计学意义;且高级别胶质瘤的静脉评分明显高于低级别胶质瘤,肿瘤静脉评分与病理级别呈正相关。这可能与病理学上肿瘤新生血管生成类型有关。肿瘤新生血管生成类型包括3种[10]:肿瘤诱导的血管改变、肿瘤相关血管的形成和血管的扩张。低级别胶质瘤的肿瘤新生血管主要是第一种类型,肿瘤新生血管并不丰富。而高级别胶质瘤的肿瘤新生血管则是3种类型的复杂结合,肿瘤新生血管较丰富。此外,病理学研究证实,肿瘤新生血管的结构随着恶性程度的增高,与正常血管的异型性也增大。低级别胶质瘤与正常血管的异型性较小,而高级别胶质瘤与正常血管有着本质的区别[11]。本研究发现,低级别胶质瘤静脉在SWI图像上主要表现为均匀细线条状,走行自然,未见吻合支;而高级别胶质瘤表现为粗细不均,走行迂曲紊乱,部分可见杂乱细小的吻合支及粗大引流静脉,与上述病理学研究结果类似。由此可能提示,利用SWI技术对胶质瘤瘤内静脉分布及形态上的观察分析,将有助于对胶质瘤级别的评价。
肿瘤内静脉、出血和钙化在SWI图像上都表现为低信号。虽然通过形态可以对三者进行判断,但有时目测仍难以区分,故可能影响SWI结果的准确性。此外,本研究对于肿瘤内静脉数量和形态的规定较为主观。在肿瘤静脉和出血较多的情况下,可能会导致相互干扰而影响肿瘤内静脉计数,尤其当肿瘤发生大面积出血时会影响对肿瘤内静脉的观察。本研究中2例胶质母细胞瘤因肿瘤内部发生大面积出血形成大片顺磁性效应,掩盖了肿瘤内静脉结构的观察而被剔除。其次,本研究病例数相对较少,各级别胶质瘤例数不均,未严格按WHO的Ⅰ-Ⅳ级进行分析,也有可能影响研究结果的准确性。
磁敏感加权成像显示肿瘤内静脉评价胶质瘤分级
Values of tumor vein detected by susceptibility weighted imaging in evaluation of gliomas grade
-
摘要:
目的 应用磁敏感加权成像(SWI)检测胶质瘤瘤内静脉,探讨SWI显示瘤内静脉对胶质瘤分级的价值。 方法 经手术病理证实的胶质瘤患者39例,包括低级别胶质瘤18例(WHOⅠ~Ⅱ级)、高级别胶质瘤21例(WHO Ⅲ~Ⅳ级)。所有患者均在GE 3.0T MRI成像系统下行基本和SWI序列扫描,图像在GE ADW 4.2工作站经最小密度投影重建获得SWI图像,逐层观察SWI图像上胶质瘤瘤内静脉的分布情况,并按静脉数量进行评分,分析其统计学差异,然后对瘤内静脉评分与肿瘤级别行相关性分析。 结果 在SWI图像上,低级别胶质瘤组静脉检出率为28%,高级别胶质瘤组静脉检出率为100%,二者差异有统计学意义(χ2=22.750,P<0.01);低级别胶质瘤组静脉评分:0分13例(72%)、1分5例(28%);高级别胶质瘤组静脉评分:1分4例(19%)、2分17例(81%),二者静脉评分差异有统计学意义(Z=-5.411,P<0.01);瘤内静脉评分与胶质瘤病理级别呈正相关(r=0.878,P<0.01)。 结论 SWI显示瘤内静脉对胶质瘤分级有辅助意义。 Abstract:Objective To study the value of tumor vein detected by susceptibility weighted imaging(SWI) in evaluation of glioma grade. Methods Thirty-nine cases of gliomas were confirmed pathologically, including 18 cases of low-grade gliomas(WHOⅠ-Ⅱgrade) and 21 cases of high-grade gliomas(WHO Ⅲ - Ⅳ grade). All cases were underwent routine MR series and SWI scanning, and SWI images were obtained with minimum intensity projection on GE ADW 4.2 work-station. SWI images were observed, and veins within glioma were scored to analyze its statistical difference, and the correlation between tumor vein scores and glioma grade was also analyzed. Results On SWI, tumor vein detection rate was 28% in low-grade gliomas group, and 100% in high-grade gliomas group, the difference was statistically significant(χ2=22.750, P < 0.01); Among the 18 cases of low-grade gliomas, the tumor vein score was 0 point in 13 cases(72%) and 1 point in 5 cases(28%), while it was 1 piont in 4 cases(19%) and 2 point in 17 cases(81%) among the 21 cases of high-grade gliomas. There was significant difference between two gliomas(Z=-5.411, P < 0.01); The tumor vein score was positively correlated with the pathological grade(r=0.878, P < 0.01). Conclusion SWI had remarkable auxiliary benefit in grading of glioma by observing intratumoral veins. -
Key words:
- Glioma /
- Magnetic resonance imaging /
- Susceptibility weighted imaging
-
-
[1] Kim HS, Jahng GH, Ryu CW, et al. Added value and diagnostic performance of intratumoral susceptibility signals in the differential diagnosis of solitary enhancing brain lesions: preliminary study[J]. AJNR Am J Neuroradiol, 2009, 30(8): 1574-1579. doi: 10.3174/ajnr.A1635 [2] Christoforidis GA, Kangarlu A, Abduljalil AM, et al. Susceptibility-based imaging of glioblastoma microvascularity at 8 T: correlation of Mr imaging and postmortem pathology[J]. AJNR Am J Neuroradiol, 2004, 25(5): 756-760. [3] Sehgal V, Delproposto Z, Haddar D, et al. Susceptibility-weighted imaging to visualize blood products and improve tumor contrast in the study of brain masses[J]. J Magn Reson Imaging, 2006, 24(1): 41-51. [4] Ong BC, Stuckey SL. Susceptibility weighted imaging: a pictorial review[J]. J Med Imaging Radiat Oncol, 2010, 54(5): 435-449. doi: 10.1111/j.1754-9485.2010.02208.x [5] 刘铁利, 张竞文, 谭艳梅, 等.磁敏感加权成像技术评估正常人群脑静脉血相位值[J].中国医学影像技术, 2013, 29(2): 197-201.
[6] Park MJ, Kim HS, Jahng GH, et al. Semiquantitative assessment of intratumoral susceptibility signals using non-contrast-enhanced high-field high-resolution susceptibility-weighted imaging in patients with gliomas: comparison with MR perfusion imaging[J]. AJNR Am J Neuroradiol, 2009, 30(7): 1402-1408. doi: 10.3174/ajnr.A1593 [7] Zhang W, Zhao J, Guo D, et al. Application of susceptibility weighted imaging in revealing intratumoral blood products and grading gliomas[J]. J Radiol, 2010, 91(4): 485-490. doi: 10.1016/S0221-0363(10)70063-9 [8] Pinker K, Noebauer-Huhmann IM, Stavrou I, et al. High-resolution contrast-enhanced, susceptibility-weighted MR imaging at 3T in patients with brain tumors: correlation with positron-emission tomography and histopathologic findings[J]. AJNR Am J Neuroradiol, 2007, 28(7): 1280-1286. doi: 10.3174/ajnr.A0540 [9] Prandoni P, Lensing AW, Piccioli A, et al. Recurrent venous thromboembolism and bleeding complications during anticoagulant treatment in patients with cancer and venous thrombosis[J]. Blood, 2002, 100(10): 3484-3488. doi: 10.1182/blood-2002-01-0108 [10] Delorme S, Knopp MV. Non-invasive vascular imaging: assessing tumour vascularity[J]. Eur Radiol, 1998, 8(4): 517-527. doi: 10.1007/s003300050428 [11] Verheul HM, Voest EE, Schlingemann RO. Are tumours angiogenesis-dependent?[J]. J Pathol, 2004, 202(1): 5-13. -





 下载:
下载: