-
分化型甲状腺癌(differentiated thyroid cancer,DTC)占甲状腺癌的90%左右,131I治疗是部分DTC患者术后的重要环节[1-2],但是131I的γ射线能量高,穿透力较强,甲状腺癌治疗剂量大,极易对周围产生外照射,是核医学治疗中辐射防护最受关注的一类核素[3],131I治疗患者体内残留活度已成为很多国家判定患者出院的一个标准。
本研究收集了35例DTC患者,通过对患者服用131I后入院期间的观察,以显像法评估患者131I治疗后体内残留的放射性活度,并且结合1 m处当量剂量率的测定评估不同时间点患者体内残留放射性活度对周围的辐射水平,以体内残留放射性活度400 MBq为节点估算患者住院隔离的时间和出院时对周围的辐射水平,为接受131I治疗的患者出院后体内残留的放射性活度对周围环境的影响提供参考。
-
选取2012年4月至2012年6月于我科服用131I治疗的DTC患者35例,其中男性6例、女性29例,年龄25~86岁,平均年龄(48.9±12.8)岁。纳入标准:均为甲状腺全切术或次全切术后患者。排除标准:有其他恶性肿瘤患者;妊娠期、哺乳期、计划短期(6个月)内妊娠者和无法依从辐射防护指导者。本研究中35例患者术后病理诊断均为甲状腺乳头状癌,需行131I“清甲”或“清灶”治疗,“清甲”是指用131I摧毁术后残留的甲状腺组织,“清灶”是指用131I治疗甲状腺床的残留甲状腺癌、甲状腺床复发灶和转移灶。20例“清甲”患者均为首次治疗,服131I剂量均为3.70 GBq;“清灶”治疗15例,服131I剂量为4.44~7.40 GBq,平均剂量(5.96±1.18)GBq(其中4.44 GBq者4例,5.55 GBq者4例,6.66 GBq者3例,7.40 GBq者4例)。服131I剂量标准:“清甲”治疗多采用固定剂量,即3.7 GBq[4];“清灶”的治疗剂量通过经验性固定活度法确定[4-5],经验剂量为3.70~7.40 GBq,即颈部淋巴结转移者给予3.70~5.55 GBq,肺转移者给予5.55~7.40 GBq,骨转移者给予7.40~9.25 GBq。
所有患者均于治疗前签署了知情同意书。
-
35例DTC患者分别于服131I后2、6、24、48、72 h进行131I全身显像,记录全身显像计数。根据欧洲核医学学会通过的标准化操作程序测定全身放射性计数[6],即通过全身前、后位平面定量显像[7],不同时间点显像计数为前、后位显像计数的平均值。仪器为GE公司Infinia SPECT系统,采用中高能平行孔准直器,进行全身显像,进床速度为20 cm/min。
-
35例DTC患者均于服131I前排空膀胱,嘱患者于服131I后2 h内禁食,所有患者服131I后2 h内均未排泄尿液和粪便。2 h时患者体内放射性活度即服131I总活度经时间衰变校正(2 h)后的放射性活度。以2 h时显像计数和活度作为总计数和总活度,根据各不同时间点的显像计数与2 h的显像计数比值,计算不同时间点体内残留百分比,估算患者体内残留放射性活度。
体内残留活度=各时间点体内残留百分比×服用131I的总剂量
体内残留百分比=(各时间点全身显像计数-体表污染计数)/2 h全身显像计数
其中,体表污染计数的估算是通过131I显像勾画污染区域并计算ROI内的污染计数得到的。
-
患者分别于服131I后2、6、24、48、72 h进行1 m处当量剂量率(μSv/h)的测定,采用美国Inspector ALERTTM Nuclear Radiation Monitor多功能辐射检测仪,测定时将监测仪探头置于患者前胸腹部水平远离1 m。
-
应用SPSS 16.0软件进行数据结果的统计分析,采用直线相关与回归分析,实验数据以均数±标准差(x±s)表示。正态分布资料采用Pearson相关分析,非正态分布资料采用Spearman相关分析。P<0.05表示差异有统计学意义。
-
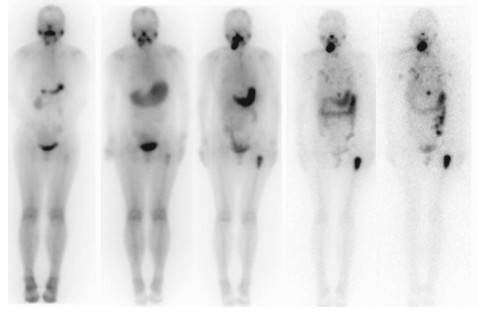
“清甲”和“清灶”治疗患者服131I后2、6、24、48、72 h体内残留131I活度占服131I总活度的百分比见表 1,由表 1可见,患者服131I后随时间变化体内残留放射性活度逐渐减少,6~24 h时下降幅度最大,24 h后体内残留放射性活度较之前明显减少,72 h以后较之前显著减少。其中1例“清甲”与1例“清灶”患者服131I后不同时间的全身显像变化见图 1、图 2。
组别 例数 体内131I放射性活度(MBq) 2 h 6 h 24 h 48 h 72 h 清甲组 20 3667±14
(99%±4%)3171±232
(86%±6%)1289±406
(35%±10%)432±292
(12%±8%)265±281
(7%±8%)清灶组 15 5890±1153
(99%±1%)5439±1284
(91%±7%)2901±1416
(47%±17%)731±701
(11%±9%)277±470
(4%±6%)表 1 显像法估算分化型甲状腺癌患者体内131I放射性活度变化
Table 1. The change of the residual activities of patients with differentiated thyroid cancer through 131I whole body imaging
-
35例DTC患者服131I前室内的辐射当量剂量率本底为0.2~0.4 μSv/h,“清甲”和“清灶”治疗患者服131I后2、6、24、48、72 h的1 m处当量剂量率见表 2,由表 2可见,1 m处当量剂量率在2 h时达到高峰,6 h时开始下降,24 h时下降幅度>50%,48 h时较之前明显下降,72 h时较之前显著降低。
组别 例数 1 m处当量剂量率(μSv/h) 2 h 6 h 24 h 48 h 72 h 清甲组 20 157±37 120±36 35±13 11±9 9±11 清灶组 15 234±43 186±51 49±20 12±11 4±6 表 2 分化型甲状腺癌患者服131I后不同时间1 m处当量剂量率变化
Table 2. The change of the equivalent dose rate at 1 meter point of patients with differentiated thyroid cancer at different time
-
根据显像法估算得出,患者体内残留的放射性活度与服131I后不同时间的1 m处当量剂量率呈线性相关,体内残留的放射性活度与1 m处当量剂量率呈正相关(r=0.87,P<0.001),即随着时间的延长,患者体内残留的放射性活度与1 m处当量剂量率均呈下降趋势。
根据显像法估算不同时间“清甲”与“清灶”患者体内残留放射性活度,显示两组患者服131I后体内残留放射性活度均随时间延长而降低,“清甲”及“清灶”患者服131I后48、72 h体内残留放射性活度分别为(432±292)、(265±281)MBq及(731±701)、(277±470)MBq,可见患者于服131I后48~72 h达到国家标准规定的400 MBq。显像法测定的体内残留放射性活度和1 m处当量剂量率的48 h和72 h回归方程分别为y=1.26x+0.45,y=0.87x+1.54,其中y为体内残留放射性活度,x为1 m处当量剂量率,当体内残留放射性活度达到国家标准规定的400 MBq时,对应的1 m处当量剂量率为8~11 μSv/h。
-
放射性131I应用于DTC的术后治疗后,服用131I的患者成为了一种特殊的“辐射源”,有可能对周围的人群和环境造成辐射污染。国际放射防护委员会认为患者服用131I后对医务人员、亲属和看护人员造成的辐射剂量最大[8]。按照我国最新的职业卫生标准[9],接受131I治疗后的患者,其体内的放射性活度降低至400 MBq后方可出院。
患者体内的131I活度是决定辐射隔离及患者出院时间的主要因素,其中131I在体内的代谢和清除受多种因素的影响,例如甲状腺组织的滞留、胃肠道的吸收、泌尿系统的排泄等,所以准确预测甲状腺癌患者体内残留的放射性活度十分重要。本研究中“清甲”患者由于甲状腺组织的残留及年龄的增长,患者体内的残留放射性活度百分比增加,影响了131I的排泄速度,所以对于残留甲状腺组织较多或年龄较大的患者应鼓励多饮水从而加速131I的排泄。
本研究显示DTC患者服131I后随时间变化体内残留放射性活度逐渐减少,其中“清甲”与“清灶”组6~24 h体内残留活度分别为(3171±232)、(1289±406)MBq及(5439±1284)、(2901±1416)MBq,该时段患者体内残留放射性活度下降幅度最快,72 h后两组患者体内残留放射性活度已显著降低,分别降为(265±281)、(277±470)MBq。同时131I全身显像还可以观察到,胃肠道内大量131I残留显影,可能与患者甲状腺切除术后体内甲状腺激素减少,从而影响胃肠道的蠕动功能有关,所以,患者服药后应该多饮水,必要时可以用促排便的药物和食物来加速胃肠道的蠕动,从而加速131I的排泄。
本研究结果中,DTC患者服131I后随时间变化1 m处当量剂量率逐渐下降,其中“清甲”与“清灶”组24 h 1 m处当量剂量率分别为(35±13)、(49±20)μSv/h,下降幅度>50%,72 h后两组患者1 m处当量剂量率已显著降低,分别降为(9±11)、(4±6)μSv/h。
1 m处当量剂量率可以直接提示DTC患者服用大剂量131I后对周围环境的影响,但是目前国家对于DTC患者服用大剂量131I后出院时的1 m处当量剂量率值没有明确的规定。本研究证实显像法估算患者体内残留的放射性活度与1 m处当量剂量率有很好的相关性,显像法因需要更换准直器,而且需要患者依从性好,在临床工作中相对较复杂。与显像同时测定的1 m处当量剂量率具有较大意义,而且操作简单方便,患者易于接受,适合在临床开展。本研究证实,当患者体内残留放射性活度达到国家标准规定的400 MBq时,根据显像法推荐1 m处当量剂量率在8~11 μSv/h时方可出院。
分化型甲状腺癌患者131I治疗后体内残留放射性活度的评估
Estimation of residual activities in patients with differentiated thyroid cancer after administration of 131I for therapy
-
摘要:
目的 评估分化型甲状腺癌(DTC)患者131I治疗后体内残留放射性活度。 方法 本研究共纳入了35例DTC患者,分为“清甲”(20例)与“清灶”(15例)组,分别于服131I后2、6、24、48、72 h进行131I全身显像及1 m处当量剂量率的测定,以2 h时显像计数和活度作为总计数和总活度。根据各时间点显像计数与2 h的显像计数比值间接估算体内残留放射性活度,并估算患者体内残留放射性活度达到400 MBq时的1 m处当量剂量率。统计学分析采用直线相关与回归分析。 结果 “清甲”组服131I后2、6、24、48、72 h体内残留131I活度占服131I总活度的百分比分别为99%±4%、86%±6%、35%±10%、12%±8%、7%±8%,“清灶”组分别为99%±1%、91%±7%、47%±17%、11%±9%、4%±6%。“清甲”组服131I后2、6、24、48、72 h的1 m处当量剂量率分别为(157±37)、(120±36)、(35±13)、(11±9)、(9±11)μSv/h,“清灶”组分别为(234±43)、(186±51)、(49±20)、(12±11)、(4±6)μSv/h。体内残留的放射性活度与1 m处当量剂量率呈正相关(r=0.87,P<0.001)。“清甲”与“清灶”组服131I后48、72 h体内残留放射性活度分别为(432±292)、(265±281)MBq及(731±701)、(277±470)MBq,对应的1 m处当量剂量率为8~11 μSv/h。 结论 DTC患者服131I后48~72 h体内残留放射性活度达到国家标准规定的400 MBq时,即DTC患者1 m处当量剂量率达到8~11 μSv/h时方可出院。 -
关键词:
- 甲状腺肿瘤 /
- 碘放射性同位素 /
- 体层摄影术,发射型计算机,单光子
Abstract:Objective To estimate the residual activities of patients with differentiated thyroid cancer(DTC) after administration of 131I for post-operative therapy. Methods Thirty-five DTC patients were divided into thyroid remnant 131I ablation therapy group(20 cases)and 131I treatment for metastatic lesions group(15 cases). 131I whole body scan and the determination of equivalent dose rate at 1 meter point were performed to estimate multi-temporal residual activities in each patient 2, 6, 24, 48, and 72 h after administration of therapeutic doses of 131I, respectively. The percentage of residual activities was indirectly estimated in vivo through ratio of multi-temporal calculation of radioactive counts on 131I whole body imaging versus that at 2 h(radioactive counts on 131I whole body imaging and 131I activity at 2 h were regarded as total counts and activities), and furthermore the equivalent dose rate at 1 meter point was indirectly estimated when the residual activities reach to 400 MBq. Correlation and regression analysis were used to evaluate the relationship between residual activities and the equivalent dose rate at 1 m. Statistical significance was accepted at P < 0.05. Results The percentage of residual activities were 99%±4%, 86%±6%, 35%±10%, 12%±8%, 7%±8% in thyroid remnant 131I ablation therapy group, and 99%±1%, 91%±7%, 47%±17%, 11%±9% and 4%±6% in 131I treatment for metastatic lesions group at 2, 6, 24, 48 and 72 h after administration of 131I, respectively. The equivalent dose rates at 1 m point were(157±37), (120±36), (35±13), (11±9) and (9±11) μSv/h in thyroid remnant 131I ablation therapy group and (234±43), (186±51), (49±20), (12±11) and (4±6) μSv/h in 131I treatment for metastatic lesions group at 2, 6, 24, 48 and 72 h after administration of 131I, respectively. There is a positive correlation between residual activities and equivalent dose rate at 1 m(r=0.87, P < 0.001). The residual activities were(432±292), (265±281) MBq 48 and 72 h after administration of 131I in thyroid remnant 131I ablation therapy group and (731±701), (277±470) MBq in 131I treatment for metastatic lesions group. At the same point of time, the corresponding range of equivalent dose rate at 1 m was from 8 to 11 μSv/h. Conclusion The in vivo residual activity reaches the national standard of 400 MBq in patients with differentiated thyroid cancer 48~72 h after serving 131I and the range of equivalent dose rate at 1 m was from 8 to 11 μSv/h. At this time, radiation isolation could be discharged. -
表 1 显像法估算分化型甲状腺癌患者体内131I放射性活度变化
Table 1. The change of the residual activities of patients with differentiated thyroid cancer through 131I whole body imaging
组别 例数 体内131I放射性活度(MBq) 2 h 6 h 24 h 48 h 72 h 清甲组 20 3667±14
(99%±4%)3171±232
(86%±6%)1289±406
(35%±10%)432±292
(12%±8%)265±281
(7%±8%)清灶组 15 5890±1153
(99%±1%)5439±1284
(91%±7%)2901±1416
(47%±17%)731±701
(11%±9%)277±470
(4%±6%)表 2 分化型甲状腺癌患者服131I后不同时间1 m处当量剂量率变化
Table 2. The change of the equivalent dose rate at 1 meter point of patients with differentiated thyroid cancer at different time
组别 例数 1 m处当量剂量率(μSv/h) 2 h 6 h 24 h 48 h 72 h 清甲组 20 157±37 120±36 35±13 11±9 9±11 清灶组 15 234±43 186±51 49±20 12±11 4±6 -
[1] American Thyroid Association(ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2009, 19(11): 1167-1214. doi: 10.1089/thy.2009.0110 [2] 张桂芝, 谭建, 刘雪辉, 等. 131I治疗分化型甲状腺癌术后患者疗效影响因素研究[J].中华核医学杂志, 2010, 30(4): 259-263. doi: 10.3760/cma.j.issn.0253-9780.2010.04.011
[3] 张洁, 石洪成.分化型甲状腺癌131I治疗的现状[J].国际放射医学核医学杂志, 2009, 33(3): 163-167. doi: 10.3760/cma.j.issn.1673-4114.2009.03.009
[4] 中华医学会内分泌学分会, 中华医学会外科学分会内分泌学组, 中国抗癌协会头颈肿瘤专业委员会, 等.甲状腺结节和分化型甲状腺癌诊治指南[J].中华核医学与分子影像杂志, 2013, 33(2): 96-115. doi: 10.3760/cma.j.issn.2095-2848.2013.02.003
[5] 匡安仁. 131I治疗分化型甲状腺癌[M]. 1版.北京:人民卫生出版社, 2013: 102-103.
[6] 刘斌, 王建涛, 牟达, 等. 131I治疗分化型甲状腺癌血液和骨髓的吸收剂量及剂量学导向治疗法[J].中华核医学杂志, 2010, 30(2): 142-144. doi: 10.3760/cma.j.issn.0253-9780.2010.02.024
[7] Lassmann M, Hänscheid H, Chiesa C, et al. EANM Dosimetry Committee series on standard operational procedures for pre-therapeutic dosimetry I: blood and bone marrow dosimetry in differentiated thyroid cancer therapy[J]. Eur J Nucl Med Mol Imaging, 2008, 35(7): 1405-1412. doi: 10.1007/s00259-008-0761-x [8] Sieqel JA. Revised Nuclear Regulatory Commission regulations for release of patients administered radioactive materials: outpatient iodine-131 anti-B1 therapy[J]. J Nucl Med, 1998, 39(8 Suppl): S28-33. [9] 中华人民共和国卫生部. GBZ120-2006临床核医学放射卫生防护标准[S].北京: 人民卫生出版社, 2006.
-






 下载:
下载: