-
大肠癌包括结肠癌和直肠癌,是威胁人类生命和健康的常见消化道恶性肿瘤,已成为我国发病率增长速度最快、发病年龄逐渐年轻化的肿瘤,目前已被列为我国恶性肿瘤死因的第4位[1]。手术、放疗、化疗和分子靶向治疗是目前恶性肿瘤的主要治疗方法。手术治疗是治疗大肠癌的有效方法,但由于多数患者确诊时已为中晚期,或已有淋巴转移,错过了治疗时机,预后不理想,因此,放疗联合化疗是治疗晚期大肠癌的主要手段。但由于放疗对肿瘤临近正常组织的损害降低了肿瘤的治疗疗效,所以有效增加大肠癌的放疗敏感性,以减少放疗剂量,从而提升大肠癌患者的放疗效果和治愈率显得尤为重要。本研究采用人视网膜母细胞瘤Rb94基因重组腺病毒(adenovirus vector containing retinoblastoma gene 94,Ad-Rb94)转染大肠癌HT29细胞,联合γ射线照射,观察Ad-Rb94联合照射对体外大肠癌细胞生长、细胞周期和细胞凋亡的变化的影响,探讨其联合抑瘤的作用机制。
-
人大肠癌细胞系HT29购自中国医学科学院基础医学研究所细胞中心,将其加入含10%胎牛血清、青霉素105 U/L、链霉素100 mg/L的DMEM/F12培养基中,放置于5%CO2、饱和湿度、37 ℃培养箱中培养。
-
Ad-Rb94由本实验室构建并保存[2],DMEM/F12培养基由美国Gibco公司生产,噻唑蓝由美国Amressco公司生产,Trizol试剂、RT-PCR试剂盒由美国Invitrogen公司生产,Annexin V-异硫氰酸荧光素由美国Beckman公司生产。137Cs γ射线照射源由加拿大Nurdion公司生产,实时定量PCR仪和酶标仪由美国Thermo公司生产,流式细胞仪由美国Beckman公司生产。
-
采用数字随机表法将培养细胞分为5组:①对照组(不作任何处理);②β-半乳糖苷酶基因重组腺病毒载体(adenovirus vector containing β-galactosidase gene,Ad-lacZ)组(含lacZ基因但不含Rb94基因的对照腺病毒);③Ad-Rb94组(含Rb94基因的重组腺病毒,病毒滴度为1.6×108 PFU/ml);④照射组(137Cs γ射线照射源4 Gy照射,剂量率为0.75 Gy/min);⑤Ad-Rb94联合照射组(简称联合照射组,Ad-Rb94转染12 h后进行γ射线4 Gy照射)。
-
转染前一日将5×105个HT29细胞接种于100 mm培养皿中,转染当日按对照组、Ad-lacZ组、Ad-Rb94组、照射组和Ad-Rb94联合照射组分组处理。转染24 h后用Trizol试剂提取总RNA,经RT-PCR试剂盒合成cDNA,以cDNA为模板,使用SYBR Green染料法进行PCR扩增。PCR反应总体积为25 μl,含100 ng的模板DNA,20 μmol/L三磷酸脱氧核苷(deoxy-ribonucleoside triphosphates,dNTPs),Taq DNA聚合酶0.5 μl,Rb94基因及内对照磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)上、下游引物各20 pmol。PCR扩增周期为94 ℃预变性5 min,按94 ℃ 30 s、50 ℃ 30 s条件循环30次。GAPDH上游引物:5′-AGCCACATCGCTCAGACAC-3′,下游引物:5′-GCCCAATACGACCAAATCC-3′。Rb94上游引物:5′-ATGTCGTTCACTTTACTGAGCTAC-3′,下游引物:5′-GGTTATCAGGACT-CCCACTCTA-3′。采用Primer 5软件设计测定基因的上、下游引物,引物合成由上海生工生物工程技术有限公司完成。
-
转染前一日取对数生长期的HT29细胞,以1×103个细胞/孔加入96孔板。转染当日按不同实验分组处理,每组做4个复孔,每孔分别加入20 μl Ad-Rb94(病毒滴度为1.6×108 PFU/ml),转染12 h后进行γ射线照射。分别于处理后第2、4、6、8日用噻唑蓝法测定每组在492 nm波长下各孔的吸光度值,并绘制生长曲线。
-
转染前一日将1×105个HT29细胞接种于6孔板中,转染当日按上述实验分组处理。转染24 h后采用胰酶消化法收集细胞,用PBS缓冲液洗涤细胞,1800×g速度离心5 min。将细胞用置于冰上预冷的70%乙醇固定1 h,于-20 ℃保存。检测前以PBS缓冲液洗涤细胞,离心后将细胞悬于500 μl含300 μg/ml RNase A和10 μg/ml蛋白酶K的10 μg/ml碘化丙啶(propidium iodide,PI)溶液中,置于冰上30 min,经尼龙滤网过滤,上流式细胞仪用FACS caliber及ModFit LTTM软件对10 000个细胞的周期分布进行分析和计算。
-
转染前一日将1×105个HT29细胞接种于6孔板中,转染当日按上述实验分组处理。转染24 h后收集细胞,用PBS缓冲液洗2次,加入100 μl binding buffer和FITC标记的10 μl Annexin-V(20 μg/ml),室温避光30 min。加入5 μl PI(50 μg/ml),避光反应5 min,加入400 μl binding buffer,立即上流式细胞仪用FACS caliber及ModFit LTTM软件对10 000个细胞的凋亡进行分析和计算,同时以不加Annexin V-FITC及PI的一个试剂管作为阴性对照。
-
采用SPSS16.0软件进行统计学分析,两组之间数据的比较采用双侧t检验,P<0.05表示差异有统计学意义。
-
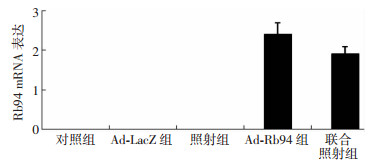
用实时定量PCR法比较大肠癌HT29细胞经Ad-Rb94和(或)照射处理后Rb94基因的表达,结果见图 1。由图可见,Ad-Rb94组和联合照射组有Rb94基因的表达,而对照组、Ad-lacZ组和照射组中未有Rb94基因的表达。本研究结果证明腺病毒介导的Rb94基因有效转染了HT29细胞。
-
大肠癌HT29细胞经Ad-Rb94和(或)照射处理后,细胞的生长抑制曲线见图 2。从图中可见,对照组和Ad-lacZ组细胞呈直线稳定地生长,照射组和联合照射组细胞从转染第4日开始生长缓慢;与Ad-Rb94组和照射组相比,联合照射组细胞的生长表现出更强的抑制效应(t=15.02、17.30,P<0.01)。研究结果提示,Ad-Rb94转染或照射都可抑制HT29细胞的生长,而Ad-Rb94与照射联合能更有效地抑制大肠癌细胞的生长,具有协同抑瘤效应。
-
大肠癌HT29细胞经Ad-Rb94和(或)照射处理后,从流式细胞术对细胞周期分析的结果可见(图 3),与对照组和Ad-lacZ组相比,Ad-Rb94组细胞没有发生细胞阻滞,而照射组大量细胞停留在G2期,与对照组、Ad-lacZ组和Ad-Rb94组相比差异有统计学意义(t=18.65、15.23、16.38,P<0.01)。联合照射组停留在G2期细胞较多,达到40%,与照射组相比,两者间差异有统计学意义(t=7.78,P<0.05)。研究表明,Ad-Rb94转染联合γ射线照射可使大肠癌细胞发生G2期阻滞。
-
大肠癌HT29细胞经Ad-Rb94和(或)照射处理后,从流式细胞术对细胞凋亡分析的结果可见(图 4),与对照组相比,Ad-Rb94组和照射组细胞凋亡率明显增加(t=16.19、10.72,P<0.01)。联合照射组细胞凋亡率最高,达到21%,与Ad-Rb94组和照射组相比,差异有统计学意义(t=6.17、9.25,P<0.05)。研究结果表明,Ad-Rb94转染或照射均可使HT29细胞的凋亡率增加,而Ad-Rb94联合照射能显著促进大肠癌细胞发生凋亡。
-
Rb基因是20世纪80年代中期最早克隆出来的人类抑癌基因,位于第13号染色体q14,mRNA为4.6 kb。该基因编码由928个氨基酸组成的磷酸蛋白,相对分子质量为110×103(PRb110),具有调控细胞周期、抑制肿瘤细胞增殖和促进肿瘤细胞分化的作用。研究表明,野生型Rb基因能抑制体外肿瘤细胞和体内肿瘤细胞的生长,但由于Rb蛋白不能快速被磷酸化而影响肿瘤的疗效[3]。有研究发现,N端缺失的Rb蛋白——PRb94(野生型全长PRb110的NH2末端缺失112个氨基酸残基)比野生型Rb110蛋白具有更强的抑瘤作用[4]。PRb94不仅在Rb表达阴性的肿瘤,而且在Rb表达阳性的前列腺癌、头颈部癌和膀胱癌中具有明显的肿瘤抑制效应[5-7]。本研究在对大肠癌细胞的生长观察中发现,Rb94对大肠癌也同样具有肿瘤抑制作用。
1992年美国学者Weichselbaum等[8]提出将放疗与基因治疗联合应用于肿瘤治疗的新模式,即肿瘤的基因-放射疗法。由于两者联合应用具有相互促进的作用,可显著提高肿瘤治疗的效果,因此成为肿瘤治疗领域新的研究方向之一[9]。本研究通过实时定量PCR法验证,成功地将构建好的腺病毒介导的Rb94基因转染到大肠癌细胞,结果表明,Ad-Rb94转染或照射都可抑制HT29细胞的生长,而Ad-Rb94与照射联合能更有效地抑制大肠癌细胞的生长。本研究在检测Ad-Rb94转染后对大肠癌细胞凋亡的变化中发现,Ad-Rb94转染或照射均可使HT29细胞的凋亡率增加,而联合照射组的细胞凋亡率显著高于Ad-Rb94组和照射组,上述结果均提示Ad-Rb94联合照射对大肠癌细胞的抑瘤作用具有协同效应。有研究表明,Rb94基因联合照射对食管癌、IL-21基因联合照射对乳腺癌细胞的生长均具有协同抑制效应[10-11]。本研究也验证了基因-放射疗法对肿瘤治疗具有相互促进作用这一结论。Ad-Rb94联合照射产生的抑瘤效应强于单纯照射,提示Ad-Rb94转染能提高肿瘤放疗的疗效,降低放疗的剂量,从而减轻放疗导致的不良反应。
Rb蛋白是细胞周期和细胞分化中重要的转录调节因子,在控制细胞进入细胞分裂周期及脱离细胞周期进入分化状态中起关键作用。DNA损伤导致细胞阻滞在细胞周期中的G1期和G2期,G1期阻滞是通过p53/p21Cip1调节通路的激活和PRb蛋白的功能而发生[12],Rb蛋白也在DNA损伤导致的G2期阻滞中发挥作用。Naderi等[13]研究发现,Rb蛋白介导的G2期阻滞是依赖于照射的剂量。为了阐明Ad-Rb94联合照射对大肠癌细胞生长的联合抑瘤作用机制,本研究通过流式细胞术分析了Ad-Rb94转染到大肠癌细胞后对细胞周期的影响,结果表明,Ad-Rb94组并没有发生明显的细胞阻滞,而联合照射组停留在G2期的细胞数量远高于照射组。Pawlik等[14]的研究表明,细胞阻滞在G2期时对放射敏感性最高,其次是G1期,S期是最不敏感的。本研究中Ad-Rb94联合照射使大量肿瘤细胞停留在G2期,因此可以较好地解释基因联合照射产生的协同抑瘤作用。但基因联合照射产生的协同抑瘤作用的机制很复杂,还需大量研究进一步阐明。
Ad-Rb94联合照射对体外人大肠癌细胞的抑瘤作用
The effect of Ad-Rb94 combined with radiation on inhibiting the growth of human colorectal cancer cells in vitro
-
摘要:
目的 探讨人视网膜母细胞瘤Rb94基因重组腺病毒载体(Ad-Rb94)联合γ射线照射对体外人大肠癌细胞生长的联合抑瘤作用及其机制。 方法 将Ad-Rb94于体外转染大肠癌HT29细胞,转染后12 h进行4 Gy 137Cs γ射线照射。实验分组为5组:对照组、β-半乳糖苷酶基因重组腺病毒载体组(Ad-lacZ组)、Ad-Rb94组、照射组和Ad-Rb94联合照射组。用噻唑蓝法检测HT29细胞的生长,用流式细胞术检测HT29细胞的细胞周期和细胞凋亡的变化。 结果 当Ad-Rb94有效转染HT29细胞后,从转染第4日开始,照射组和联合照射组细胞生长速率较对照组和Ad-lacZ组缓慢;与Ad-Rb94组和照射组相比,Ad-Rb94联合照射组细胞的生长表现出更强的抑制效应(t=15.02、17.30, P<0.01)。细胞周期结果表明,与对照组、Ad-lacZ组和Ad-Rb94组相比, 照射组大量细胞停留在G2期,各组间差异有统计学意义(t=18.65、15.23、16.38, P<0.01);但Ad-Rb94联合照射组停留在G2期细胞更多(约40%),远高于照射组(t=7.78,P<0.05)。细胞凋亡结果表明,与对照组相比,Ad-Rb94组和照射组细胞凋亡率明显增加(t=16.19、10.72,P<0.01);Ad-Rb94联合照射组细胞凋亡率最高(21%),与Ad-Rb94组和照射组相比,差异有统计学意义(t=6.17、9.25,P<0.05)。 结论 腺病毒介导的Rb94基因联合照射对大肠癌细胞的抑瘤作用具有协同效应,其机制可能是促进细胞G2期阻滞和凋亡。 -
关键词:
- 基因,视网膜母细胞瘤94 /
- 基因疗法 /
- 放射疗法 /
- 大肠肿瘤 /
- 腺病毒
Abstract:Objective To evaluate the mechanism of combined effects of recombinant adenovirus-mediated retinoblastoma gene 94(Ad-Rb94)with γ-ray radiation on inhibiting the growth of human colorectal cancer cells in vitro. Methods HT29 cells were transfected by Ad-Rb94 and irradiated by 4 Gy 137Cs γ-ray 12 h after transfection. The cohorts were divided into five groups:blank control, Ad-LacZ, Ad-Rb94, radiation and Ad-Rb94 combined with radiation. The cells growth curve of HT29 cells was detected by MTT assay. Changes of cell cycle and cell apoptosis in HT29 cells were detected by flow cytometry. Results The growth of cells treated with Ad-Rb94 or radiation alone was all inhibited when Ad-Rb94 was transfected effectively into HT29 cells. The growth of HT29 cells treated with radiation or combination of Ad-Rb94 and radiation was slower than that of blank control and Ad-lacZ at 4 d after transfection. The growth of HT29 cells treated with combination of Ad-Rb94 and radiation resulted in greater inhibition compared with that of Ad-Rb94 or radiation alone(t=15.02 and 17.30, P < 0.01). Cell cycle data showed that HT29 cells treated with radiation were arrested at G2 phase, and there were significant differences compared with that of blank control, Ad-lacZ and Ad-Rb94(t=18.65, 15.23 and 16.38, P < 0.01). Cells treated with combination of Ad-Rb94 and radiation arrested at G2 phases increasingly, reached 40%, significantly higher than that of radiation alone(t=7.78, P < 0.05). Cells apoptosis data showed that the apoptosis ratio of HT29 cells treated with Ad-Rb94 or radiation was markedly increased compared with that of blank control(t=16.19 and 10.72, P < 0.01). Cells apoptosis ratio of HT29 cells treated with combination of Ad-Rb94 and radiation was the highest, reached 21%, and there were significant differences compared with that of Ad-Rb94 or radiation alone(t=6.17 and 9.25, P < 0.05). Conclusion The recombinant Ad-Rb94 transfection combined with radiation shows synergism for the suppression of colorectal cancer cells growth. Retard the cell in G2 phase and promote cells apoptosis is may be the main mechanism. -
Key words:
- Gene, retinoblastoma 94 /
- Gene therapy /
- Radiotherapy /
- Colorectal neoplasms /
- Adenovirus
-
-
[1] Ganapathi S, Kumar D, Katsoulas N, et al. Colorectal cancer in the young: trends, charactistics and outcome[J]. Int J Colorectal, 2011, 26(7): 927-934. [2] 李进, 王芹, 宋力, 等.采用GatewayTM系统构建人Rb94基因重组腺病毒载体[J].肿瘤防治研究, 2010, 37(9): 1-5.
[3] Lamber EP, Beuron F, Morris EP, et al. Structural insights into the mechanism of phosphoregulation of the retinoblastoma protein[J/OL]. PLoS One, 2013, 8(3): e58463[2013-11-01]. http://www.ncbi.nlm.nih.gov/pubmed/23516486. [4] Zhang H, Li J, Wang YY, et al. Retinoblastoma 94 enhances radiation treatment esophageal squamous cell carcinoma in vitro and in vivo[J]. J Riat Res, 2012, 53(1): 117-124. [5] Araki K, Ahmad SM, Li G, et al. Retinoblastoma RB94 enhances radiation treatment of head and neck squamous cell carcinoma[J]. Clin Cancer Res, 2008, 14(11): 3514-3519. [6] Li D, Day KV, Yu S, et al. The role of adenovirus-mediated retinoblastoma 94 in the treatment of head and neck cancer[J]. Cancer Res, 2002, 62(16): 4637-4644. [7] Roig JM, Molina MA, Cascante A, et al. Adenovirus-mediated retinoblastoma 94 gene transfer induces human pancreatic tumor regression in a mouse xenograft model[J]. Clin Cancer Res, 2004, 10(4): 1454-1462. [8] Weichselbaum RR, Hallahan DE, Sukhatme VP, et al. Gene therapy targeted by ionizing radiation[J]. Int J Radiat Oncol Biol Phys, 1992, 24(3): 565-567. [9] 张耀文, 李进, 王芹, 等.基因治疗联合放射治疗恶性肿瘤的研究进展[J].国际放射医学核医学杂志, 2008, 32(4): 247-250.
[10] 陈凤华, 李进, 宋力, 等. Ad-Rb94基因联合γ射线对食管癌细胞生长的影响[J].国际放射医学核医学杂志, 2010, 34(2): 119-121.
[11] 王芹, 刘晓秋, 李进, 等.白细胞介素21基因联合不同剂量γ射线照射对乳腺癌细胞生长的影响[J].国际放射医学核医学杂志, 2012, 36(2): 94-96.
[12] Okamura K, Miki D, Nohara K. Inorganic arsenic exposure induces E2F-dependent G0/G1 arrest via an increase in retinoblastoma family protein p130 in B-cell lymphoma A20 cells[J]. Genes Cells, 2013, 18(10): 839-849. [13] Naderi S, Hunton IC, Wang JY. Radiation dose-dependent maintenance of G(2)arrest requires retinoblastoma protein[J]. Cell Cycle, 2002, 1(3): 193-200. [14] Pawlik TM, Keyomarsi K. Role of cell cycle in mediating sensitivity to radiotherapy[J]. Int J Radiat Oncol Biol Phys, 2004, 59(4): 928-942. -






 下载:
下载: