-
p16基因是一种抑癌基因,近年来发现它在细胞衰老过程中发挥重要作用。p16是细胞周期蛋白依赖性激酶(cyclin dependent protein kinase,CDK)4和CDK6的抑制物,p16通过与CDK4和CDK6结合,阻滞CDK4、CDK6与cyclinD结合,抑制cyclinD-CDK复合物的活性,阻断对Rb蛋白(一种核磷酸蛋白)的磷酸化,使细胞停滞在G0期,不能进入细胞周期循环而处于静息状态[1-2]。p16在许多细胞进入衰老时均过度表达,其持续表达导致了细胞衰老。目前,p16已成为细胞衰老研究的热门靶点之一。RNA干扰是转录后水平序列特异性的抑制基因表达的一种天然机制。在本研究中我们构建了RNA干扰载体,并将表达载体成功地转染至辐射诱导衰老的小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)中,观察其对p16的干扰效果,旨在为后续p16相关研究提供实验基础。
-
表达载体pcDNATM6.2-GW/EmGFPmiR、BLOCK-iTTM Pol Ⅱ miR RNAi Expression Vector Kit with EmGFP、脂质体LipofeetamineTM2000和Trizol购自美国Invitrogen公司; DH5α感受态细胞购自德国TIANGEN公司; T4 DNA连接酶购自美国Promega公司; 实时荧光定量PCR试剂盒和ABI Prism 7500 Sequence Detection System购自美国ABI公司; 质粒提取试剂盒购自德国QIAGEN公司; Turbo Script逆转录第一链cDNA合成试剂盒购自北京原平皓生物技术有限公司; Radio Immunoprecipitation Assay裂解液购自美国Pierce公司; bicinchoninic acid试剂盒购自上海碧云天生物技术有限公司; 兔抗小鼠p16、兔抗小鼠β-actin一抗和山羊抗兔二抗购自美国Santa Cruz Biotechnology公司; Senescence β-Galactosidase Staining Kit购自美国Cell Signaling technology公司。MEF细胞由本实验室保存。其他试剂均为国产或进口分析纯试剂。ChemiDocTM XRS+成像系统购自美国BIO-RAD公司; 137Cs γ射线照射源由加拿大原子能有限公司生产,型号为Autocell40,剂量率0.80 Gy/min; eclipse 90i荧光显微镜购自日本Nikon公司。
-
以小鼠p16基因(NM_009877)作为目的基因,应用Invitrogen公司提供的辅助设计软件(Block-iT RNAi Designer)设计siRNA。miRNA-155是目前剪切位点研究较为清楚的天然miRNA[3],本研究选择miRNA-155作为骨架,结合线性化pcDNATM6.2-GW/EmGFPmiR真核表达载体的特点,选择符合条件的靶位点,设计两段互补的寡核苷酸序列,每对寡核苷酸的核心序列反向互补,并将备选序列和相应的基因数据库进行Blast同源比对,排除与p16基因高度同源的序列。设计好的序列(表 1)由上海英骏生物技术有限公司合成。
引物名称 序列 mp16-1F 5'-TGCTGTTAGCTCTGCTCTTGGGATTGGTTTTGG-CCACTGACTGACCAATCCCAAGCAGAGCTAA-3' mp16-1R 5'-CCTGTTAGCTCTGCTTGGGATTGGTCAGTCAGT-GGCCAAAACCAATCCCAAGAGCAGAGCTAAC-3' mp16-2F 5'-TGCTGAGCTGAAGCTATGCCCGTCGGGTTTTGG-CCACTGACTGACCCGACGGGTAGCTTCAGCT-3' mp16-2R 5'-CCTGAGCTGAAGCTACCCGTCGGGTCAGTCAG-TGGCCAAAACCCGACGGGCATAGCTTCAGCTC-3' 表 1 siRNA寡核苷酸序列
Table 1. Sequences of siRNA template oligonucleotides
将2对合成好的oligo用灭菌双蒸水溶解成100 μmol/L双蒸水,互补单链各取5 μl两两混合,加入2 μmol/L 10×退火缓冲液和8 μl灭菌双蒸水,95 ℃加热5 min,然后放置室温自然冷却20 min,形成双链oligo。取1 μl退火产物,继续稀释成10 nmol/L浓度。在无菌离心管中,依次加入4 μl 5×连接缓冲液、9 μl灭菌双蒸水、2 μl pcDNA6.2-GW/EmGFPmiR质粒、4 μl 10 nmol/L ds oligo、1 μl 1U/μl T4 DNA连接酶,充分混匀后室温连接30 min。取2 μl上述重组体转化DH5α感受态细胞,在含50 μg/ml壮观霉素的Luria-Bertani琼脂板上培养16 h,挑选阳性克隆摇菌过夜。利用试剂盒提取质粒,送上海英骏公司测序,以验证重组克隆中插入片段序列是否与设计的oligo序列一致。
-
将生长状态良好的MEF细胞按照每孔1×105个细胞接种于六孔板中,H-DMEM培养液(含10%胎牛血清、100 U/ml青霉素和100 U/ml链霉素)在37 ℃、5% CO2培养箱内培养,待细胞生长融合至80%左右,用10.0 Gy 137Cs γ射线照射细胞[4]。照射后,采用脂质体LipofeetamineTM2000进行质粒转染细胞。具体转染操作根据脂质体转染说明书进行。每孔细胞分别加入2 μg质粒和5 μl脂质体,转染4 h更换含10%胎牛血清的无抗生素H-DMEM培养液,继续培养。
实验分组:对照组(不做任何处理)、照射组(接受10.0 Gy 137Cs γ射线照射)、照射+p16 siRNA-1组、照射+p16 siRNA-2组(接受10.0 Gy 137Cs γ射线照射后分别转染p16基因特异性siRNA-1和siRNA-2)、照射+空载组(接受10.0 Gy 137Cs γ射线照射后转染空载对照siRNA)。
-
细胞转染后24 h,收集细胞,用Trizol法提取细胞的总RNA。取少量用于RNA含量及纯度测定。总RNA按照Turbo Script逆转录第一链cDNA合成试剂盒进行cDNA第一链的合成。cDNA反转录反应体系为20 μl,反应条件为65 ℃ 5 min,42 ℃ 50 min,70 ℃15 min; 用实时荧光定量探针法检测样品中成熟mRNA分子的水平,实时荧光定量PCR反应体系为25 μl,反应条件为50 ℃2 min,95 ℃10 min,(95 ℃ 15 s,60 ℃ 1 s)×40循环。每个样本重复测量3次。以甘油醛-3-磷酸脱氢酶的表达量为参照标准,按照2-ΔΔt计算p16 mRNA相对表达量。
-
收集转染后24 h的细胞,用PBS洗涤2遍,细胞总蛋白抽提液提取总蛋白,并采用BCA法检测样品中蛋白的含量。取20 μg混合蛋白上样缓冲液,在100 ℃下加热10 min,采用15%的十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳分离,电泳后转至聚偏二氟乙烯膜。转膜结束后室温封闭1 h,加入兔抗小鼠p16抗体4 ℃过夜,洗膜后加入相对应的二抗室温孵育1 h,洗膜,最后加化学发光显色试剂,在ChemiDocTM XRS+成像系统中成像。另外,采用抗β-actin多克隆抗体检测β-actin蛋白表达作为样品内参以及转膜的效果。
-
细胞转染后5 d,将24孔板中的细胞用PBS洗涤2遍,在室温下用1×定影液固定细胞10~15 min,用PBS洗涤2遍,加入1 ml染色混合液,37 ℃下过夜,具体操作步骤按照SA-β-Gal检测试剂盒说明书进行。衰老细胞染成蓝色为阳性细胞,光镜下观察并拍照,同时计算每200个细胞中阳性细胞的百分率[5]。
-
实验结果以均数±标准差(x±s)表示,数据分析采用t检验,P<0.05为差异有统计学意义。
-
测序分析证明重组体中插入片段的碱基序列完整,没有碱基的突变以及丢失,表明已成功构建了针对鼠p16基因的p16 siRNA-1和p16 siRNA-2表达质粒。
-
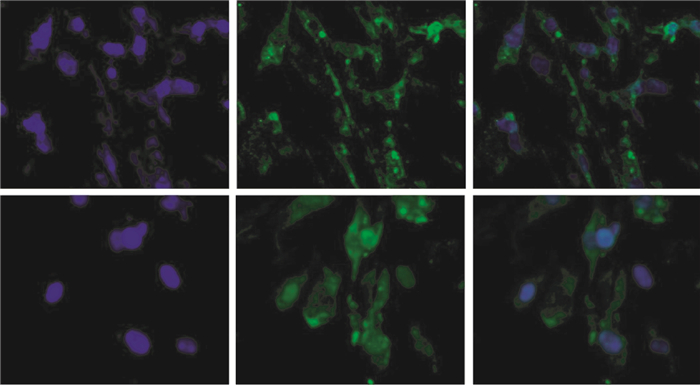
pcDNATM 6.2-GW/EmGFPmiR质粒带有绿色荧光蛋白基因,转染细胞24 h后,通过荧光显微镜观察绿色荧光,显示辐射诱导衰老MEF细胞在转染后有绿色荧光蛋白表达,说明转染成功(图 1)。
-
由图 2可见,经10 Gy137Cs γ射线照射后24 h,照射组小鼠胚胎成纤维细胞p16的mRNA相对表达水平较对照组升高,两者间的差异有统计学意义(t=87.60,P<0.05); 照射+空载组与对照组比较,p16的mRNA相对表达水平升高(t=85.32,P<0.05); 辐射诱导衰老的MEF细胞RNA干扰后24 h,与照射组比较,照射+p16 siRNA-1和照射+p16 siRNA-2组p16的mRNA水平显著降低(t=16.52、16.13,P均<0.05)。
-
与照射组比较,照射+p16 siRNA-1和照射+p16 siRNA-2组的p16蛋白表达水平有所降低,而照射+空载组的p16蛋白表达水平与照射组相比则无显著差别(图 3)。
-
SA-β-Gal染色后衰老细胞呈阳性,胞质内可见蓝色颗粒; 阴性细胞未着色。结果表明,照射组和照射+空载组的SA-β-Gal染色阳性细胞百分比显著高于对照组(t=72.91、72.73,P均<0.01); 照射+p16 siRNA-1和照射+p16 siRNA-2组SA-β-Gal染色阳性细胞百分比与对照组(t=35.19、34.92,P均<0.01)和照射组(t=37.72、38.09,P均<0.01)比较,差异均有统计学意义(图 4、表 2)。

图 4 各组小鼠胚胎成纤维细胞衰老相关β-半乳糖苷酶活性的变化图
Figure 4. Representative images of mouse embryonic fibroblast cells senescence associated-β-galactosidase activity in different group
组别 SA-β-Gal阳性细胞百分比(%) 对照组 1.83±0.76 照射组 68.83±1.26 照射+空载组 68.67±1.76 照射+p16 siRNA-1组 34.17±2.08 照射+p16 siRNA-2组 33.83±1.75 注:表中,SA-β-Gal:衰老相关β-半乳糖苷酶。 表 2 各组小鼠胚胎成纤维细胞衰老相关β-半乳糖苷酶染色阳性细胞百分比
Table 2. The percentage of mouse embryonic fibroblast cells senescence associated-β-galactosidase positive cells in different group
(n=3, x±s) -
本研究设计并构建了小鼠p16的RNA干扰载体,经测序证实了所构建表达载体的正确性,而后通过脂质体介导的质粒转染,通过观察到目的细胞MEF中绿色荧光蛋白的表达,说明所构建的重组体能够有效地转染到目的细胞。
已有大量研究证实,电离辐射可以引起DNA损伤,最终导致细胞衰老[6-7]。本研究采用我们前期建立的10.0 Gy 137Cs γ射线照射诱导的小鼠胚胎成纤维细胞衰老模型[4, 8],经实时荧光定量PCR和Western blot检测表明:2个RNA干扰载体都能使靶基因p16的mRNA和蛋白表达水平降低,而照射+空载组的p16 mRNA和蛋白表达水平与照射组比较则无显著差异,这提示2个siRNA干扰载体在转染目的细胞辐射诱导衰老的MEF细胞后都有干扰p16基因表达的作用。
Dimri等[5]1995年首次提出一种鉴定细胞衰老的标志酶SA-β-Gal,他们的研究发现,衰老成纤维细胞和角质形成细胞均表达此酶,而休眠细胞和终末分化细胞则缺乏。因此,目前将SA-β-Gal染色作为细胞衰老的生物学标志[2]。p16在许多细胞进入衰老时均过度表达,其持续表达导致了细胞衰老。在本研究中,通过脂质体介导的质粒转染组SA-β-Gal染色阳性细胞百分比较照射组明显降低,说明转染后p16表达降低,衰老在一定程度上被抑制。
本研究初步探讨了RNA干扰沉默p16基因表达可以抑制MEF细胞的衰老,为后续相关研究提供了实验基础。
RNA干扰沉默p16基因对小鼠胚胎成纤维细胞衰老的影响
Application of RNA interference vector targeting mouse p16 gene in γ-irradiation-induced mouse embryonic fibroblast
-
摘要:
目的 探讨RNA干扰沉默小鼠p16基因表达对137Cs γ射线诱导的小鼠胚胎成纤维细胞(MEF)衰老的影响。 方法 构建p16 RNA干扰载体,采用实时荧光定量PCR、Western blot和衰老相关β-半乳糖苷酶(SA-β-Gal)染色观察RNA干扰前后辐射诱导衰老的MEF细胞mRNA水平、蛋白水平和衰老细胞百分率等的变化。 结果 辐射诱导衰老的MEF细胞RNA干扰后24 h,照射+p16 siRNA-1和照射+p16 siRNA-2组p16 mRNA相对表达水平较照射组显著降低(t=16.52、16.13,P均<0.05),蛋白水平较照射组显著降低; 干扰后5 d,照射+p16 siRNA-1和照射+p16 siRNA-2组SA-β-Gal染色阳性细胞百分比[(34.17±2.08)%和(33.83±1.75)%]明显低于照射组[(68.83±1.26)%](t=37.72、38.09,P均<0.01)。 结论 RNA干扰沉默小鼠p16基因表达能够抑制MEF细胞的衰老,为其在细胞衰老相关研究中的应用奠定了基础。 Abstract:Objective To explore the effects of silencing p16 gene by RNA interference(RNAi) mediated on γ-irradiation-induced mouse embryonic fibroblast(MEF). Methods p16 RNAi vector was constructed by using pcDNATM6.2-GW/EmGFPmiR plasmid.p16 mRNA and protein levels of the irradiation-induced MEF before and after RNAi were detected by real-time PCR, Western blot and the percentage of aging cells was detected by senescence associated-β-galactosidase(SA-β-Gal) staining. Results 24 h after RNAi, p16 mRNA levels of the irradiation-induced MEF decreased significantly in the irradiation+p16 siRNA-1 and irradiation+p16 siRNA-2 group as compared with the irradiation group(t=16.52 and 16.13, both P < 0.05), protein levels of the irradiation+p16 siRNA-1 and irradiation+p16 siRNA-2 group also decreased as compared with the irradiation group.5 days after irradiation the percentages of SA-β-Gal positive cells in the irradiation+p16 siRNA-1 and irradiation+p16 siRNA-2 group were(34.17±2.08)% and(33.83±1.75)%, significantly lower than that of the irradiation group[(68.83±1.26)%](t=37.72 and 38.09, both P < 0.01). Conclusion MEF aging can be effectively controlled by RNAi which can shut down the expression of silencing p16 gene and lay the foundations for its application in the related studies on cells senescence. -
Key words:
- Genes, p16 /
- RNA interference /
- Gamma rays /
- Mouse embryonic fibroblast cell /
- Aging
-
表 1 siRNA寡核苷酸序列
Table 1. Sequences of siRNA template oligonucleotides
引物名称 序列 mp16-1F 5'-TGCTGTTAGCTCTGCTCTTGGGATTGGTTTTGG-CCACTGACTGACCAATCCCAAGCAGAGCTAA-3' mp16-1R 5'-CCTGTTAGCTCTGCTTGGGATTGGTCAGTCAGT-GGCCAAAACCAATCCCAAGAGCAGAGCTAAC-3' mp16-2F 5'-TGCTGAGCTGAAGCTATGCCCGTCGGGTTTTGG-CCACTGACTGACCCGACGGGTAGCTTCAGCT-3' mp16-2R 5'-CCTGAGCTGAAGCTACCCGTCGGGTCAGTCAG-TGGCCAAAACCCGACGGGCATAGCTTCAGCTC-3' 表 2 各组小鼠胚胎成纤维细胞衰老相关β-半乳糖苷酶染色阳性细胞百分比
Table 2. The percentage of mouse embryonic fibroblast cells senescence associated-β-galactosidase positive cells in different group
(n=3, x±s) 组别 SA-β-Gal阳性细胞百分比(%) 对照组 1.83±0.76 照射组 68.83±1.26 照射+空载组 68.67±1.76 照射+p16 siRNA-1组 34.17±2.08 照射+p16 siRNA-2组 33.83±1.75 注:表中,SA-β-Gal:衰老相关β-半乳糖苷酶。 -
[1] Alcorta DA, Xiong Y, Phelps D, et al.Involvement of the cyclin-dependent kinase inhibitor p16(INK4a) in replicative senescence of normal human fibroblasts[J].Proc Natl Acad Sci USA, 1996, 93(24): 13742-13747. [2] 邢文英, 金辉, 丁一.衰老相关-β-半乳糖苷酶和P16在老年大鼠脾内的表达及意义[J].解剖学杂志, 2008, 31(4): 486-488.
[3] Dang LT, Kondo H, Aoki T, et al.Engineered virus-encoded pre-microRNA(pre-miRNA) induces sequence-specific antiviral response in addition to nonspecific immunity in a fish cell line: convergence of RNAi-related pathways and IFN-related pathways in antiviral response[J].Antiviral Res, 2008, 80(3): 316-323. [4] 路璐, 黄颂, 李德冠, 等.137Cs γ-射线诱导小鼠胚胎成纤维细胞衰老模型的建立[J].细胞与分子免疫学杂志, 2014, 30(1): 87-89.
[5] Dimri GP, Lee X, Basile G, et al.A biomarker that identifies senescent human cells in culture and in aging skin in vivo[J].Proc Natl Acad Sci USA, 1995, 92(20): 9363-9367. [6] Ye C, Zhang X, Wan J, et al.Radiation-induced cellular senescence results from a slippage of long-term G2 arrested cells into G1 phase[J].Cell Cycle, 2013, 12(9): 1424-1432. [7] Zou Y, Zhang N, Ellerby LM, et al.Responses of human embryonic stem cells and their differentiated progeny to ionizing radiation[J].Biochem Biophys Res Commun, 2012, 426(1): 100-105. [8] 王月英, 吴红英, 李德冠, 等.不同剂量137Csγ射线照射对小鼠造血系统的影响[J].国际放射医学核医学杂志, 2013, 37(1): 1-4.
-






 下载:
下载: