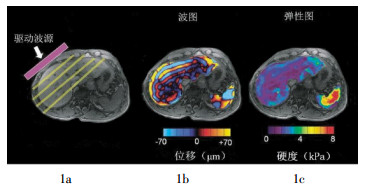
-
肝脏疾病,特别是肝纤维化、肝硬化和肝脏肿瘤严重危害人类健康,对于它们的诊断和治疗一直以来都是临床研究的热点和难点。近年来,随着医学影像技术的飞速发展,其在肝脏疾病的诊断及治疗评估中的作用越来越得到临床的重视,尤其是MRI技术在多种肝脏疾病诊断方面要明显优于CT和超声[1]。磁共振弹性成像(magnetic resonance elastography,MRE)作为一种基于MRI技术评估实质脏器组织弹性的功能成像技术,在肝脏疾病的无创诊断方面显示出良好的应用价值。
-
弹性是生物组织的重要特性,生物组织的这种机械属性在不同生理状态或病理状态下变化很大[2]。弹性成像的概念最早由Ophir等[3]于1991年提出,其基本原理是对生物组织施加一个内部或外部、动态或静态的压力或振动后,生物组织会对弹性力学、生物力学等物理作用产生响应,利用不同的成像模态(包括超声成像、MRI和光学成像)结合数字图像处理技术获知生物组织的响应程度,从而反映生物组织的弹性差异[4]。
MRE的基本原理是通过一种机械波改变生物组织的形态,然后通过MRI设备来检测生物组织在这种机械波作用下产生的位移,进一步通过换算得出组织的弹性图,从而反映其弹性特征,为临床提供辅助的信息。磁共振弹性图的产生过程主要包括3个步骤:第一步,应用一种机械波改变生物组织的形态,这种机械波可以是外源性的也可以是内源性的(如:心脏的搏动、血管的搏动);第二步,使用MRI仪采集生物组织基于这种机械波产生的位移,从而得出其波图;第三步,应用后期处理软件换算得出能够反映生物组织弹性属性的弹性图[2, 5]。图 1所示为肝脏MRE示意图[6]。
有文献报道,MRE检查能够在1.5 T、3.0 T的MRI设备上实现,已开发出的MRE技术包括静态、准静态、动态MRE技术,在临床中常用的是动态MRE技术,主要采用一种时间谐同(time-harmonic)的外源性振动波,并将这种振动波引入体内,目前临床应用的机械波频率多为40~120 Hz[7]。有学者研究了不同频率(分别为25、37.5、50、62.5 Hz)MRE在肝脏检查中的应用价值,认为MRE振动频率在50、62.5 Hz时具有最高的诊断准确率[8]。其余多数学者在肝脏检查中使用60 Hz的单频振动波[9-11]。同时使用梯度回波、自旋回波、平面回波或者平衡稳态自旋回波序列采集生物组织的位移,从而得到生物组织的波图,然后通过逆运算得到能够反映其机械属性的弹性图[5]。对MRE检查的安全性研究表明,MRE检查中应用的最大振动强度低于欧洲全身振动限制的标准,且患者可以很好地耐受这种振动[12],这说明MRE检查在人体中应用是一种安全可靠的方法。
MRE作为一种无创地评估组织机械属性的检查手段,可以应用于全身许多器官的检查中,如:肝脏、乳腺、大脑、心脏、骨骼肌等[5]。然而,MRE在肝脏疾病检查中的应用最为成熟[6]。
-
肝脏可由于直接或者间接的损伤而发展成为肝炎和肝纤维化,并最终发展成为肝硬化[5, 13-15]。肝纤维化有多种分类方法,临床常用的Metavir分级系统将慢性肝炎引起的肝纤维化过程分为5个阶段:无纤维化(F0)、肝门纤维性扩展(F1)、细纤维隔从汇管区发出(F2)、纤维隔桥接汇管区与中央静脉(F3)和肝硬化(F4)。肝纤维化和肝硬化都是肝癌的危险因素,与此同时越来越多的文献报道早期的肝纤维化是可以逆转的[16-17],甚至是晚期纤维化和肝硬化也存在一定的可逆转性[13, 15],因此对于肝维化和肝硬化的早期诊断具有重要的临床意义。
MRE作为一种能够无创评估肝脏硬度的手段已经受到了临床的重视。一些学者对比了目前无创诊断肝纤维化的方法(如:血清标志物、超声弹性成像、MRE以及CT等),认为MRE是目前诊断肝纤维化的最好的技术手段[6, 17-19]。同时,MRE可重复性强且不受患者年龄、性别、身体质量指数和肥胖等因素的影响,在不同评估者之间亦具有很高的可靠性[9, 20-22]。亦有学者使用MRE诊断慢性肝病儿童的肝纤维化也得到了相似的结论[23]。多数文献报道的正常肝脏实质的硬度低于3 kPa[18, 24, 25],当肝脏硬度大于这个数值时,MRE诊断肝纤维化具有很高的灵敏度和特异度。MRE在区分F0级或正常肝脏与大于等于F1级纤维化肝脏时,其灵敏度为80%~98%,特异度为90%~100%,准确率为0.89~0.99[26]。
-
MRE不仅能够准确诊断肝纤维化,在不同程度肝纤维化分级方面亦有重要价值[8, 18, 25]。多个研究表明,MRE测得的肝脏硬度与肝纤维化分级之间有很好的相关性[10, 24-25],其硬度测量值随着肝脏纤维化程度的增加而增加[6, 25],如Godfrey等[27]报道了77例临床怀疑肝纤维化的患者,均进行了MRE检查和肝组织穿刺活检,发现MRE评估肝脏硬度与肝纤维化分级呈正相关(P<0.001)。石喻等[28]亦得到了相同的结论。然而,不同学者报道同级别肝纤维化的肝脏硬度不尽相同,按照Metavir分级系统,有文献报道肝脏平均硬度分别为:正常肝脏或F0级(2.1~2.25 kPa)、F1级(2.2~2.74 kPa)、F2级(2.5~3.2 kPa)、F3级(3.1~4.4 kPa)和F4级(4.3~5.86 kPa)[8-9, 18-19, 29]。出现这种差异的可能原因有:①受试者入选标准不同;②受试者进食状态有差异(餐后内脏血流增加可影响肝脏硬度[20-21]);③ROI选取方法的差异(由于目前尚无统一标准的ROI选取方案,故不同研究选取ROI的方案不尽相同);④不同研究者使用的MRI设备及扫描参数存在一定的差异。
Yin等[25]对35名健康志愿者和50例慢性肝病患者进行MRE成像,结果如图 2所示,经过病理证实的肝纤维化患者48例(依据Metavir肝纤维化病理分级系统,其中F0级14例、F1级6例、F2级5例、F3级5例和F4级18例),肝脏平均硬度随着肝纤维化程度的增加而增加。
-
众所周知,严重的肝纤维化或肝硬化将导致门静脉压力增高,进而引起脾肿大、腹水和食管胃底静脉曲张等继发性改变。因此,有学者尝试使用MRE间接评估门静脉高压,Nedredal等[30]使用犬门静脉高压模型研究了门静脉压力与肝脏硬度、脾脏硬度之间的关系,结果发现,门静脉压力与肝脏硬度、脾脏硬度呈高度正相关,故MRE可以成为一种无创地诊断和筛查门静脉高压的方法。Yin等[31]使用家猪模型亦得到了相似的结论。在对人类样本的研究中,多数学者认为肝脏硬度与脾脏硬度显著相关,并且可以用来预测食管胃底静脉曲张的出现和严重程度[32-33]。然而Mannelli等[34]对16名健康志愿者进行研究后认为,脾脏硬度与肝脏硬度之间无明显相关性,这可能与该研究入组样本类型过于单一有关。
-
肝癌的演变过程目前已基本明确,即从再生结节到低度发育不良结节,再到高度发育不良结节,然后依次到高分化肝癌、中分化肝癌、低分化肝癌,也有部分肝癌不经过发育不良结节的过程直接从再生结节演变过来[1, 35],因此肝纤维化和肝硬化是肝癌的危险因素之一。Motosugi等[36]研究发现,在慢性肝病患者中用MRE测量肝脏硬度是肝癌的一个独立的危险因素。该研究共选择了301例之前没有肝癌病史的患者,通过常规MRI检查确诊66例肝癌患者,并在其余的没有肝癌的患者中通过年龄匹配作为对照组,经过多元化分析表明,肝癌患者肝脏硬度明显高于没有肝癌的患者肝脏硬度[5.0(2.3~9.3)kPa vs. 3.9(1.8~8.8)kPa,P=0.0025],同时得出结论,肝脏硬度可以作为一种比肿瘤标志物更好的肝癌指标。然而,Anaparthy等[37]的研究却得出了不同的结果,该研究对比了有复杂肝脏纤维化的30例肝细胞肝癌患者,用60例没有发现肿瘤的肝纤维化患者作为对照,测量肝癌患者非肿瘤区域的肝脏弹性值,并与非肿瘤患者的肝脏弹性值作比较,结果表明肝癌患者非瘤肝组织的硬度与非肝癌患者的肝组织硬度相近[(6.3±2.1)kPa vs.(6.1±2.3)kPa]。这些结果说明,能否单独依靠MRE评价肝脏硬度作为肝癌的独立危险因素目前尚未达成共识。笔者认为出现这种结论的原因可能与ROI选取标准不同,或者样本入选标准和对照组匹配方法不同有关。
在对肝脏肿瘤弹性成像的研究中,Venkatesh等[38]报道肝脏恶性肿瘤的硬度要显著高于良性肿瘤、肝硬化、正常肝组织,分别为:10.1 kPa vs. 2.7 kPa(P<0.001),10.1 kPa vs. 5.9 kPa(P<0.001),10.1 kPa vs. 2.3 kPa(P<0.001),并且可以用5 kPa作为恶性肿瘤与良性肿瘤的临界区分值(准确率100%)。在不同的肿瘤类型中,肝细胞肝癌的硬度要显著高于肝转移瘤,转移瘤的硬度与肝纤维化没有显著差异,但其硬度显著高于良性肿瘤和正常肝组织。Garteiser等[39]和Doblas等[40]的报道亦与上述结论一致。
-
对于MRE在肝脏疾病治疗监测中的应用鲜有文献报道,Chen等[41]研究了MRE在家猪动物模型动态激光消融中的作用,认为MRE能够测量消融术中组织硬度的改变。
-
综上所述,MRE作为一种能够提供组织弹性特征的检查手段,为临床提供了十分有价值的信息。目前达成的共识是MRE在肝纤维化及肝硬化的诊断和不同程度纤维化分级中具有很高的应用价值,并且能够在一定程度上取代肝穿刺活检[9, 24-25]。但对不同级别纤维化的硬度值目前并无统一标准,这需要临床进行多中心大样本量的进一步研究。在对肝脏硬度与脾脏硬度的相关性研究方面,多数学者认为,二者显著相关且可以用来预测食管胃底静脉曲张的出现和严重程度[32-33]。在肝脏肿瘤的应用中,由于不同肿瘤的弹性之间有一定的重叠区域[27],因此MRE并不能作为定性的诊断手段,但可以辅助鉴别诊断肝脏肿瘤。另外,MRE评估肝脏硬度能否作为肝癌的独立危险因素尚存在争议,由于现阶段对于该研究的病例数量并不充分,还需要临床进行更大样本量的研究。
肝脏MRE的影响因素:①MRE检查需要患者屏气配合,在一些不能很好屏气的患者中可能导致检查失败[6];②由于MRI的自身特点,在肝脏铁沉积的患者中,MRE检查可能由于信号强度过低而导致检查失败;③MRE作为一种功能成像,在肝脏肿瘤的应用研究中,目前文献报道的病灶普遍>10 mm,而对于更小病灶的检出几乎没有报道。可见,通过改进MRE技术,以期发现肝脏微小肿瘤病灶,在提高肝脏肿瘤早期诊断的灵敏度和准确率方面具有较大的潜力。
由于MRE在肝脏疾病治疗效果评估中的作用罕有报道,目前肝癌介入治疗已经成为中晚期肝癌的重要治疗手段,介入治疗术后肿瘤硬度及肝正常实质硬度的变化情况亦未见报道。另外,由于肝纤维化和肝硬化将导致肝功能的损伤,能否应用MRE评估肝纤维化与肝硬化的程度进而间接评估肝功能或许能够成为MRE的下一个研究方向。
肝脏磁共振弹性成像的应用现状与展望
The application and expectation of magnetic resonance elastography in liver
-
摘要: 磁共振弹性成像是一种能够无创地定量评估组织机械属性的检查手段,能够为临床提供有价值的诊断信息。近年来,磁共振弹性成像已逐步在临床中得到应用,现就磁共振弹性成像在肝脏检查中的应用价值及前景予以综述。Abstract: Magnetic resonance elastography(MRE) is a noninvasive technique for quantitatively evaluating tissue mechanical properties and it can provide useful diagnostic information. Recently, MRE has been gradually applied into clinical practice, the purpose of this review is to summarize the value and prospect of MRE application in liver examination.
-
-
[1] Robinson P. Hepatocellular carcinoma: Development and early detection[J]. Cancer imaging, 2008, 8(special issue A): S128-131. doi: 10.1102/1470-7330.2008.9019 [2] Mariappan YK, Glaser KJ, Ehman RL. Magnetic resonance elastography: A review[J]. Clin Anat, 2010, 23(5): 497-511. doi: 10.1002/ca.21006 [3] Ophir J, Cespedes I, Ponnekanti H, et al. Elastography: A quantitative method for imaging the elasticity of biological tissues[J]. Ultrason imaging, 1991, 13(2): 111-134. [4] 张丽娜, 刘爱连.腹部磁共振弹性成像研究进展[J].国际医学放射学杂志, 2011, 34(4): 342-344. doi: 10.3784/j.issn.1674-1897.2011.04.Z0407
[5] Glaser KJ, Manduca A, Ehman RL. Review of MR elastography applications and recent developments[J]. J Magn Reson Imaging, 2012, 36(4): 757-774. [6] Venkatesh SK, Yin M, Ehman RL. Magnetic resonance elastography of liver: Technique, analysis, and clinical applications[J]. J Magn Reson Imaging, 2013, 37(3): 544-555. [7] Talwalkar JA, Yin M, Fidler JL, et al. Magnetic resonance imaging of hepatic fibrosis: Emerging clinical applications[J]. Hepatology, 2008, 47(1): 332-342. [8] Asbach P, Klatt D, Schlosser B, et al. Viscoelasticity-based staging of hepatic fibrosis with multifrequency mr elastography1[J]. Radiology, 2010, 257(1): 80-86. doi: 10.1148/radiol.10092489 [9] Motosugi U, Ichikawa T, Sano K, et al. Magnetic resonance elasto-graphy of the liver: Preliminary results and estimation of inter-rater reliability[J]. Jpn J Radiol, 2010, 28(8): 623-627. doi: 10.1007/s11604-010-0478-1 [10] Rustogi R, Horowitz J, Harmath C, et al. Accuracy of mr elastography and anatomic mr imaging features in the diagnosis of severe hepatic fibrosis and cirrhosis[J]. J Magn Reson Imaging, 2012, 35(6): 1356-1364. doi: 10.1002/jmri.23585 [11] Kim BH, Lee JM, Lee YJ, et al. MR elastography for noninvasive assessment of hepatic fibrosis: Experience from a tertiary center in Asia[J]. J Magn Reson Imaging, 2011, 34(5): 1110-1116. [12] Ehman E, Rossman P, Kruse S, et al. Vibration safety limits for magnetic resonance elastography[J]. Phys Med Biol, 2008, 53(4): 925-935. [13] Bataller R, Brenner DA. Liver fibrosis[J]. J Clin Invest, 2005, 115(2): 209-218. doi: 10.1172/JCI24282 [14] Friedman SL, Bansal MB. Reversal of hepatic fibrosis—fact or fantasy?[J]. Hepatology, 2006, 43(Suppl 1): S82-88. [15] Fowell AJ, Iredale JP. Emerging therapies for liver fibrosis[J]. Dig Dis, 2006, 24(1-2): 174-183. doi: 10.1159/000090320 [16] Godfrey EM, Mannelli L, Griffin N, et al. Magnetic resonance elastography in the diagnosis of hepatic fibrosis[J]. Semin Ultrasound CT MR, 2013, 34(1): 81-88. doi: 10.1053/j.sult.2012.11.007 [17] Bonekamp S, Kamel I, Solga S, et al. Can imaging modalities diagnose and stage hepatic fibrosis and cirrhosis accurately?[J]. J Hepatol, 2009, 50(1): 17-35. [18] Huwart L, Sempoux C, Vicaut E, et al. Magnetic resonance elastography for the noninvasive staging of liver fibrosis[J]. Gastroentero-logy, 2008, 135(1): 32-40. doi: 10.1053/j.gastro.2008.03.076 [19] Venkatesh SK, Wang G, Lim SG, et al. Magnetic resonance elasto-graphy for the detection and staging of liver fibrosis in chronic he-patitis B[J]. Eur Radiol, 2014, 24(1): 70-78. [20] Hines CD, Bley TA, Lindstrom MJ, et al. Repeatability of magnetic resonance elastography for quantification of hepatic stiffness[J]. J Magn Reson Imaging, 2010, 31(3): 725-731. [21] Shire NJ, Yin M, Chen J, et al. Test-retest repeatability of MR elastography for noninvasive liver fibrosis assessment in hepatitis C[J]. J Magn Reson Imaging, 2011, 34(4): 947-955. [22] Venkatesh SK, Wang G, Teo LL, et al. Magnetic resonance elasto-graphy of liver in healthy asians: Normal liver stiffness quantification and reproducibility assessment[J]. J Magn Reson Imaging, 2014, 39(1): 1-8. [23] Xanthakos SA, Podberesky DJ, Serai SD, et al. Use of magnetic re-sonance elastography to assess hepatic fibrosis in children with chronic liver disease[J]. J Pediatr, 2014, 164(1): 186-188. doi: 10.1016/j.jpeds.2013.07.050 [24] Rouviere O, Yin M, Dresner MR, et al. MR elastography of the liver: preliminary results[J]. Radiology, 2006, 240(2): 440-448. doi: 10.1148/radiol.2402050606 [25] Yin M, Talwalkar JA, Glaser KJ, et al. Assessment of hepatic fibrosis with magnetic resonance elastography[J]. Clin Gastroenterol Hepatol, 2007, 5(10): 1207-1213. doi: 10.1016/j.cgh.2007.06.012 [26] Venkatesh SK, Yin M, Ehman RL. Magnetic resonance elastography of liver: Clinical applications[J]. J Comput Assist Tomogr, 2013, 37(6): 887-896. doi: 10.1097/RCT.0000000000000032 [27] Godfrey EM, Patterson AJ, Priest AN, et al. A comparison of MR elastography and 31p MR spectroscopy with histological staging of liver fibrosis[J]. Eur Radiol, 2012, 22(12): 2790-2797. doi: 10.1007/s00330-012-2527-x [28] 石喻, 郭启勇, 张兰, 等. 3.0 TMR弹性成像评价健康者及慢性肝病患者肝弹性值的初步研究[J].中华放射学杂志, 2013, 47(11): 1005-1008. doi: 10.3760/cma.j.issn.1005-1201.2013.11.012
[29] Huwart L, Sempoux C, Salameh N, et al. Liver fibrosis: Noninvasive assessment with MR elastography versus aspartate aminotransferase-to-platelet ratio index[J]. Radiology, 2007, 245(2): 458-466. doi: 10.1148/radiol.2452061673 [30] Nedredal GI, Yin M, McKenzie T, et al. Portal hypertension correlates with splenic stiffness as measured with MR elastography[J]. J Magn Reson Imaging, 2011, 34(1): 79-87. [31] Yin M, Kolipaka A, Woodrum DA, et al. Hepatic and splenic stiffness augmentation assessed with MR elastography in an in vivo porcine portal hypertension model[J]. J Magn Reson Imaging, 2013, 38(4): 809-815. [32] Talwalkar JA, Yin M, Venkatesh S, et al. Feasibility and significance of in vivo mean spleen stiffness measurement by magnetic resonance elastography for assessing portal hypertension[J]. AJR Am J Roentgenol, 2009, 193(1): 122-127. doi: 10.2214/AJR.07.3504 [33] Morisaka H, Motosugi U, Ichikawa S, et al. Association of splenic MR elastographic findings with gastroesophageal varices in patients with chronic liver disease[J/OL]. J Magn Reson Imaging, 2013[2014-01-10]. http://onlinelibrary.wiley.com/doi/10.1002/jmri.24505/pdf.[published online ahead of print Nov 14, 2013]. [34] Mannelli L, Godfrey E, Joubert I, et al. MR elastography: Spleen stiffness measurements in healthy volunteers—preliminary experience[J]. AJR Am J Roentgenol, 2010, 195(2): 387-392. doi: 10.2214/AJR.09.3390 [35] Sakamoto M, Hirohashi S, Shimosato Y. Early stages of multistep hepatocarcinogenesis: Adenomatous hyperplasia and early hepatocellular carcinoma[J]. Hum Pathol, 1991, 22(2): 172-178. doi: 10.1016/0046-8177(91)90039-R [36] Motosugi U, Ichikawa T, Koshiishi T, et al. Liver stiffness measured by magnetic resonance elastography as a risk factor for hepatocellular carcinoma: A preliminary case-control study[J]. Eur Radiology, 2013, 23(1): 156-162. [37] Anaparthy R, Talwalkar J, Yin M, et al. Liver stiffness measurement by magnetic resonance elastography is not associated with developing hepatocellular carcinoma in subjects with compensated cirrhosis[J]. Aliment Pharmacol Ther, 2011, 34(1): 83-91. doi: 10.1111/j.1365-2036.2011.04673.x [38] Venkatesh SK, Yin M, Glockner JF, et al. MR elastography of liver tumors: Preliminary results[J]. AM J Roentgenol, 2008, 190(6): 1534-1540. doi: 10.2214/AJR.07.3123 [39] Garteiser P, Doblas S, Daire JL, et al. MR elastography of liver tumours: Value of viscoelastic properties for tumour characterisation[J]. Eur Radiol, 2012, 22(10): 2169-2177. doi: 10.1007/s00330-012-2474-6 [40] Doblas S, Garteiser P, Haddad N, et al. Magnetic resonance elastography measurements of viscosity: A novel biomarker for human hepatic tumor malignancy?[J]. Proc Intl Soc Mag Reson Med, 2011, 19: 389. [41] Chen J, Woodrum DA, Glaser KJ, et al. Assessment of in vivo laser ablation using MR elastography with an inertial driver[J]. Magn Reson Med, 2014, 72(1): 59-67. doi: 10.1002/mrm.24891 -






 下载:
下载: