-
随着131I治疗分化型甲状腺癌(differentiated thyroid cancer,DTC)术后患者的增多,131I治疗后扫描的假阳性已经越来越引起临床核医学工作者的重视。其中,部分年轻DTC术后患者131I治疗后有纵隔摄取131I而最终被证实为胸腺生理性摄取的报道较多[1]。为了优化DTC术后患者进一步的131I治疗方案,对纵隔异常131I摄取的鉴别诊断就显得尤为重要。本研究回顾性地分析了DTC术后患者131I治疗后全身显像(whole body scans,WBS)显示纵隔浓聚131I,并最终被证实为胸腺生理性摄取131I的临床特点及WBS的影像学特征,现将初步研究结果报道如下。
-
选取2007年至2013年由我科收治的行甲状腺全切或近全切除术、并经病理证实的需行131I初治或复治的DTC患者1882例次,年龄7~83岁,其中,男性565例次、女性1317例次。所有患者于131I治疗前4~6周忌碘饮食,暂不服用左甲状腺素,使血清TSH水平升至30 mIU/L以上,并行甲状腺摄131I率检查及常规体检(包括肝肾功能、心电图、血常规、甲状腺功能检查等)。口服1.11~9.25 GBq 131I(其中,甲状腺残灶清除:1.11~3.70 GBq;局部复发或淋巴结转移:3.70~5.55 GBq;肺转移:5.55~7.40 GBq;骨转移:7.40~9.25 GBq)。所有患者或患者家属在131I治疗前均签署了知情同意书。
-
显像仪器为德国Siemens Medical Solutions Symbia T6型SPECT/CT仪。131I治疗后第3~5天行WBS,扫描速度为10 cm/min,必要时行131I SPECT/CT融合显像,先发射扫描随后透射扫描,SPECT显像矩阵为128×128,旋转360°,1帧/6°,30 s/帧,共采集64帧。透射扫描为低剂量诊断级CT扫描。使用Siemens Medical Solutions Syngo处理工作站配套软件进行图像重建,分别获得功能图像、解剖图像和融合图像。部分患者还进行了B超、CT及MRI增强扫描、18F-FDG PET/CT等检查以助明确诊断。
对WBS图像上纵隔有异常131I摄取,并根据甲状腺球蛋白(thyroglobulin,Tg)、甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)水平测定、其他影像学检查及临床随访结果最终被证实为胸腺生理性摄取131I的患者,总结其胸腺生理性摄取131I的临床特点及WBS的影像学特征。
-
WBS图像由2名熟知患者病情和其他相关检查结果的核医学科医师判读。131I SPECT/CT图像判读由上述核医学科医师中的1人和1名高年资放射科医师共同完成。①WBS判断标准:在排除体表或体外放射性污染和体内的生理显影部位(如鼻咽部、唾液腺、乳腺、汗腺、胃肠道、肝脏及生殖泌尿道)外,有放射性浓聚或增强灶高于体内本底水平者为阳性病灶;病灶部位以其所在的头部、颈部、胸部、腹盆部或上下肢大体部位判断。②131I SPECT/CT融合显像判断标准:体表或体外放射性浓聚或增强灶为放射性污染;排除体内生理显影部位(如鼻咽部、唾液腺、乳腺、汗腺、胃肠道、肝脏及生殖泌尿道)外,有放射性浓聚或增强灶高于体内本底水平者为阳性病灶;诊断CT显示异常占位,排除非DTC病变,显像无放射性摄取者为不摄碘病灶;病灶部位以诊断CT显示的部位判断。B超、CT及MRI增强扫描、18F-FDG PET/CT等由相应的专科医师完成判读。
-
所有数据均由SPSS20.0统计学软件进行处理。计量资料以均数±标准差(x±s)表示,组间均数比较采用t检验,计数资料比较采用χ2检验,P<0.05表示差异有统计学意义。
-
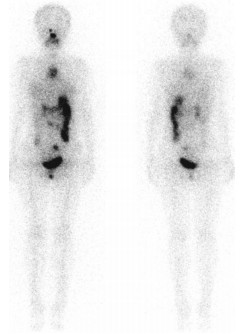
纵隔部位有异常131I摄取者87例,最终被证实为纵隔转移者41例(47.1%);胸腺生理性摄取131I者16例(18.4%),均为乳头状甲状腺癌,其中,男性7例、女性9例,年龄7~41岁,131I治疗次数为1~9次,其中有15例患者接受过至少2次及以上131I治疗,每次131I的剂量均达3.70~9.25 GBq,随访时间6~75个月,仅有1例患者在第1次接受131I治疗后的WBS上胸腺就开始显影。胸腺生理性摄取131I在WBS上主要有两种表现形式,其中,弥漫性放射性浓聚灶13例(81%,图 1)、哑铃状放射性浓聚灶3例(19%,图 2)。且胸腺对131I的摄取呈现一种趋势:随重复131I治疗次数的增加而越来越明显(图 3)。具体情况见表 1。纵隔转移者与胸腺生理性摄取者在年龄、第一次131I治疗后纵隔部位显影例数及Tg水平方面的比较见表 2。

图 1 分化型甲状腺癌术后患者胸腺“弥漫性”摄取131I的全身显像图患者女性,15岁。131I全身显像示纵隔部位“弥漫性”放射性131I浓聚灶(左为前位像,右为后位像)。
Figure 1. 131I whole body scans of diffuse thymic uptake of 131I in post-operative patient with differentiated thyroid cancer

图 2 分化型甲状腺癌术后患者胸腺“哑铃状”摄取131I的全身显像图患者男性,7岁。131I全身显像示纵隔部位“哑铃状”放射性131I浓聚灶(左为前位像,右为后位像)。
Figure 2. 131I whole body scans of dumbbell-like thymic uptake of 131I in post-operative patient with differentiated thyroid cancer

图 3 分化型甲状腺癌术后患者不同时期的131I全身显像前位颈胸截图患者男性,24岁,总共进行了8次131I治疗。从第3次治疗后胸腺开始显影(3a),第4次(3b)、第5次(3c)及第6次(3d)治疗后胸腺显影越来越清晰。
Figure 3. Anterior neck and thorax images of 131I whole body scans at different times in post-operative patient with differentiated thyroid cancer
编号 性别 年龄(岁) n/N 胸腺摄取图像表现 Tg(ng/ml) TgAb(IU/ml) 随访时间(月) 随访末期疾病状态 1 男 7 3/9 哑铃状 793.0 7.1 60 无瘤生存 2 女 10 2/3 哑铃状 14.8 8.1 61 无瘤生存 3 女 15 3/4 弥漫性 2.5 10.0 23 无瘤生存 4 女 16 2/2 弥漫性 27.1 10.0 11 无瘤生存 5 男 18 2/3 弥漫性 86.5 11.7 44 淋巴转移 6 女 21 2/5 弥漫性 552.0 10.6 37 无瘤生存 7 女 22 2/2 弥漫性 36.8 10.0 8 无瘤生存 8 男 23 2/2 弥漫性 29.6 11.3 7 少许残甲 9 男 24 3/8 弥漫性 121.0 9.2 75 无瘤生存 10 女 26 2/2 弥漫性 28.1 10.0 9 少许残甲 11 女 26 2/2 弥漫性 112.0 10.0 27 少许残甲 12 男 29 2/2 哑铃状 27.1 10.6 28 无瘤生存 13 男 29 1/1 弥漫性 77.4 10.0 6 少许残甲 14 女 30 2/3 弥漫性 138.0 11.3 38 无瘤生存 15 女 30 2/2 弥漫性 20.3 18.9 26 少许残甲 16 男 41 2/2 弥漫性 0.1 10.0 37 无瘤生存 注:表中,n/N:N指随访末期时131I治疗的总次数,n指胸腺首次显影时131I治疗的次数;Tg:甲状腺球蛋白;TgAb:甲状腺球蛋白抗体;残甲:残余甲状腺;Tg及TgAb是停用甲状腺激素4~6周后胸腺显影时的测定值,Tg及TgAb的正常值范围分别为1.4~78.0 ng/ml和0~115.0 IU/ml。 表 1 16例分化型甲状腺癌术后胸腺生理性摄取131I患者的临床资料
Table 1. Clinical data of physiological thymic uptake of 131I in 16 cases of post-operative patients with differentiated thyroid cancer
组别 例数 ≤45岁者例数(%) 首次131I治疗后纵隔部位显影者例数(%) 甲状腺球蛋白
(x±s,ng/ml)胸腺生理性摄取者 16 16(100%) 1(6.3%) 129.14±220.84 纵隔转移者 41 29(70.7%) 30(73.2%) 594.70±1242.42 χ2值或t值 4.30a 20.78a 2.308b P值 <0.05 <0.05 <0.05 注:表中,a为χ2值;b为t值。 表 2 纵隔转移者与胸腺生理性摄取者在年龄、首次131I治疗后纵隔部位显影者例数及Tg水平方面的比较
Table 2. Comparison of age, the cases of mediastinal uptake after the first 131I treatment and thyroglobulin levels between mediastinal metastasis and physiological thymic uptake patients
-
目前国际上公认的DTC综合治疗措施为“甲状腺全切或近全切除术+术后131I内照射+甲状腺激素抑制治疗”,术后131I内照射治疗对于减少甲状腺癌复发、转移或治疗残存及转移灶具有十分重要的作用[2]。笔者对DTC术后患者采用的治疗及随访方案也是:以末次131I治疗后WBS及Tg水平测量结果(停用甲状腺激素4~6周,TSH≥30 mIU/L的状态下)作为主要的参考指标协助诊断,并为后续治疗提供依据,直到治疗后扫描结果阴性或131I摄取量极少[3]。但近年来陆续有年轻DTC患者131I治疗后有纵隔摄取131I而最终被活检证实为正常胸腺摄取的报道,这关系到患者的后续治疗,因此131I治疗后3~5 d WBS图像上纵隔摄取131I的鉴别诊断显得尤为重要[4]。纵隔部位摄取131I可见于多种原因[5],B超、CT及MRI增强扫描、131I SPECT/CT、18F-FDG PET/CT等影像学检查方法常常作为鉴别诊断的主要手段,尤其是治疗后的131I SPECT/CT,对纵隔病灶的定性及定位诊断起着重要作用,能够很好地区分纵隔131I浓聚病灶的良恶性[6-8]。有多篇文献报道了DTC患者131I治疗后胸腺摄取131I,发生率为3.4%~26.3%[9],本研究中胸腺生理性摄取131I的发生率为18.4%,绝大多数是通过治疗后的131I SPECT/CT进行诊断,少部分则通过其他影像学检查方法排除了残余甲状腺(简称残甲)、纵隔甲状腺癌转移灶或污染而得以诊断,未发现甲状腺癌转移到胸腺的病例。
Vermiglio等[10]、Meller和Becker[11]证实了胸腺能够摄取131I,并且通常发生在给予131I治疗剂量的年轻患者中。本研究仅有1例为41岁,其余15例均在30岁及以下,比以往报道的年龄偏低[3-4],而且绝大多数胸腺摄取131I的患者发生在2次或2次以上131I治疗后,且随着131I治疗次数的增加,胸腺摄取131I越明显。本研究中有15例患者至少接受过2次及以上131I治疗,只有1例首次131I治疗后胸腺显影。尽管也有文献报道首次131I治疗后胸腺摄取131I,但多是残甲极少或无残甲,或者胸腺本身存在问题(如胸腺囊肿、转移等)[7],本研究中病例13就属于前一种情况。Ramanna等[12]发现胸腺摄取131I也可发生于低剂量131I的诊断性扫描时,但这类患者往往是多次131I治疗后的,可能与残甲或甲状腺癌转移灶随着治疗次数的增加逐渐消失,导致胸腺竞争性摄131I能力增强有关。本研究中的病例均未进行低剂量131I的诊断性扫描。成人患者出现胸腺摄取131I,往往提示胸腺组织增生。有文献报道机体在遭受疾病或化疗等应急状态下,胸腺可以发生反应性增生,表现为弥漫性增大,并且有多种放射性药物可以被胸腺摄取,如67Ga、18F-FDG、111In-奥曲肽和放射性碘(131I、125I、123I)等[3],但目前尚无确切的资料证实131I治疗后可以诱发胸腺的反应性增生。本研究131I治疗后胸腺摄取131I也无充分的证据证明是胸腺组织的增生,综合分析后认为均是胸腺的生理性摄取,与胸腺囊肿、甲状腺癌胸腺转移及其他纵隔转移摄取131I(点状、团块状异常摄取)不同[7],WBS图像上胸腺生理性浓聚131I大多表现为“弥漫性”浓聚灶,少部分则为“哑铃状”浓聚灶。
作为DTC患者术后131I后续治疗及随访依据的除了末次131I治疗后的WBS结果,还有一个重要的指标,即Tg水平。DTC患者手术后经131I去除残甲或转移灶治疗有效后,理论上血中Tg水平应测量不出或极低,若血中又出现相当量的Tg,在排除TgAb干扰的情况下,则应考虑来自复发的甲状腺癌组织或有功能的转移病灶[12]。有资料显示,Tg在胸腺组织中也有表达,并且可能是良性Tg分泌的一个来源[13]。因此对于WBS图像上仅有胸腺摄取131I的患者,即使Tg水平升高,再次行131I治疗时也要慎重,以避免过度的131I治疗。本研究中所有患者的TgAb全部为阴性,排除了自身抗体干扰,能够确切反映机体内的Tg状况。Tg水平升高者14例,除去4例明确转移需要多次131I治疗外,另10例在131I治疗后的WBS图像上胸腺摄取131I时,已无其他异常摄取病灶,或仅有少许甲状腺残留,权衡利弊后,大多没有行重复的131I治疗,以后的随访治疗效果也令人满意。对于本研究中Tg水平未升高的病例3,由于早期治疗时缺乏经验,把正常的胸腺摄131I灶当做了病灶,后续的131I治疗方案有些欠妥。后期随着经验的积累,Tg水平未升高的病例16就避免了131I的过度治疗。
尽管有学者[14]提出131I治疗DTC后胸腺良性摄131I的诊断标准为:①患者年龄较小;②需要超出常规诊断剂量131I才能使其显影;③胸腺对131I的摄取随重复131I治疗次数的增加而愈加明显;④CT显示胸腺增大;⑤TSH≥30 mIU/L状态下,Tg水平较低。但随着DTC发病率的不断升高、医疗经济条件的不断改善以及131I治疗DTC研究的深入开展和规范化工作的进一步落实,国内应用131I治疗术后DTC患者呈现普及的趋势[15],但过度的131I治疗也会导致潜在的一些不良反应,如骨髓抑制等。因此,通过本研究并结合一些文献报道笔者认为,胸腺生理性摄取131I是45岁以下DTC术后患者多次131I治疗后WBS假阳性的重要原因之一。当131I治疗后的WBS仅显示有纵隔摄取时,尤其可能需要重复131I治疗的患者,即使Tg水平升高,也应充分结合B超、CT及MRI增强扫描、131I SPECT/CT、18F-FDG PET/CT等影像学检查结果明确诊断其是否为正常胸腺,从而避免不必要的131I重复治疗。
分化型甲状腺癌术后131I治疗患者胸腺生理性摄取131I的临床研究
Clinical research on physiological thymic uptake of 131I in post-operative patients with differentiated thyroid cancer
-
摘要:
目的 探讨分化型甲状腺癌(DTC)术后131I治疗患者胸腺生理性摄取131I的临床特点及131I全身显像(WBS)的影像学特征。 方法 收集2007年至2013年收治的1882例次DTC术后131I治疗后第3~5天行WBS的患者,分析WBS上纵隔部位有131I摄取,并根据甲状腺球蛋白、甲状腺球蛋白抗体测定、其他影像学检查及临床随访结果最终被证实为胸腺生理性摄取131I的患者资料。 结果 胸腺生理性摄取131I者共16例,年龄均<45岁,其中有15例患者至少接受过2次131I治疗,仅有1例第1次131I治疗后胸腺显影; WBS上胸腺生理性摄取131I主要表现为“弥漫性”或“哑铃状”浓聚灶;且胸腺对131I的生理性摄取随重复131I治疗次数的增加而越来越明显。 结论 胸腺生理性摄取131I是45岁以下DTC术后患者多次131I治疗后WBS假阳性的重要原因之一,充分认识到这一现象并予以鉴别,对于患者下一步的恰当诊治是十分必要的。 Abstract:Objective To explore the clinical features and 131I whole body scans(WBS) characteristics of physiological thymic uptake of 131I in post-operative patients with differentiated thyroid cancer(DTC). Methods One thousand eight hundred and eighty-two WBS were performed on the 3-5 day after 131I therapy in post-operative patients with DTC between 2007 and 2013. On the basis of thyroglobulin and thyroglobulin antibody measurement, other imaging and clinical follow-up, the mediastinal activity was attributed to physiological thymic uptake of 131I. For such patients, their data were reviewed retrospectively. Results Physiological thymic uptake of 131I were confirmed in 16 patients. All of them were under the age of 45. Fifteen patients received at least two therapeutic doses of 131I, and there was only one patient to be found physiological thymic uptake of 131I on the first treatment. The pattern of physiological thymic uptake of 131I was classified as "diffuse" or "dumbbell". Thymic uptake of 131I became more prominent with repeated treatments. Conclusions For the next appropriate treatment, it is essential to acknowledge that physiological thymic uptake of 131I in patients with DTC under the age of 45 is an important cause of false-positive WBS. -
Key words:
- Thyroid neoplasms /
- Thymus gland /
- Iodine radioisotopes /
- Brachytherapy
-
表 1 16例分化型甲状腺癌术后胸腺生理性摄取131I患者的临床资料
Table 1. Clinical data of physiological thymic uptake of 131I in 16 cases of post-operative patients with differentiated thyroid cancer
编号 性别 年龄(岁) n/N 胸腺摄取图像表现 Tg(ng/ml) TgAb(IU/ml) 随访时间(月) 随访末期疾病状态 1 男 7 3/9 哑铃状 793.0 7.1 60 无瘤生存 2 女 10 2/3 哑铃状 14.8 8.1 61 无瘤生存 3 女 15 3/4 弥漫性 2.5 10.0 23 无瘤生存 4 女 16 2/2 弥漫性 27.1 10.0 11 无瘤生存 5 男 18 2/3 弥漫性 86.5 11.7 44 淋巴转移 6 女 21 2/5 弥漫性 552.0 10.6 37 无瘤生存 7 女 22 2/2 弥漫性 36.8 10.0 8 无瘤生存 8 男 23 2/2 弥漫性 29.6 11.3 7 少许残甲 9 男 24 3/8 弥漫性 121.0 9.2 75 无瘤生存 10 女 26 2/2 弥漫性 28.1 10.0 9 少许残甲 11 女 26 2/2 弥漫性 112.0 10.0 27 少许残甲 12 男 29 2/2 哑铃状 27.1 10.6 28 无瘤生存 13 男 29 1/1 弥漫性 77.4 10.0 6 少许残甲 14 女 30 2/3 弥漫性 138.0 11.3 38 无瘤生存 15 女 30 2/2 弥漫性 20.3 18.9 26 少许残甲 16 男 41 2/2 弥漫性 0.1 10.0 37 无瘤生存 注:表中,n/N:N指随访末期时131I治疗的总次数,n指胸腺首次显影时131I治疗的次数;Tg:甲状腺球蛋白;TgAb:甲状腺球蛋白抗体;残甲:残余甲状腺;Tg及TgAb是停用甲状腺激素4~6周后胸腺显影时的测定值,Tg及TgAb的正常值范围分别为1.4~78.0 ng/ml和0~115.0 IU/ml。 表 2 纵隔转移者与胸腺生理性摄取者在年龄、首次131I治疗后纵隔部位显影者例数及Tg水平方面的比较
Table 2. Comparison of age, the cases of mediastinal uptake after the first 131I treatment and thyroglobulin levels between mediastinal metastasis and physiological thymic uptake patients
组别 例数 ≤45岁者例数(%) 首次131I治疗后纵隔部位显影者例数(%) 甲状腺球蛋白
(x±s,ng/ml)胸腺生理性摄取者 16 16(100%) 1(6.3%) 129.14±220.84 纵隔转移者 41 29(70.7%) 30(73.2%) 594.70±1242.42 χ2值或t值 4.30a 20.78a 2.308b P值 <0.05 <0.05 <0.05 注:表中,a为χ2值;b为t值。 -
[1] Mitchell G, Pratt BE, Vini L, et al. False positive 131I whole body scans in thyroid cancer[J]. Br J Radiol, 2000, 73(870): 627-635. doi: 10.1259/bjr.73.870.10911786 [2] American Thyroid Association(ATA)Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, Cooper DS, Doherty GM, et al. Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2009, 19(11): 1167-1214. doi: 10.1089/thy.2009.0110 [3] 陈立波, 罗全勇, 余永利, 等.甲状腺癌术后患者纵隔浓聚131I的临床分析[J].中华核医学杂志, 2008, 28(2): 105-107. doi: 10.3760/cma.j.issn.2095-2848.2008.02.010
[4] Wilson LM, Barrington SF, Morrison ID, et al. Therapeutic implications of thymic uptake of radioiodine in thyroid carcinoma[J]. Eur J Nucl Med, 1998, 25(6): 622-628. doi: 10.1007/s002590050264 [5] Sutter CW, Masilungan BG, Stadalnik RC. False-positive results of 131I whole-body scans in patients with thyroid cancer[J]. Semin Nucl Med, 1995, 25(3): 279-282. [6] Wong KK, Avram AM. Posttherapy I-131 thymic uptake demonstrated with SPECT/CT in a young girl with papillary thyroid carcinoma[J]. Thyroid, 2008, 18(8): 919-920. doi: 10.1089/thy.2007.0394 [7] Kayano D, Michigishi T, Ichiyanagi K, et al. 131I uptake in a thymic cyst[J]. Clin Nucl Med, 2010, 35(6): 438-439. doi: 10.1097/RLU.0b013e3181db4d21 [8] Inaoka T, Takahashi K, Mineta M, et al. Thymic hyperplasia and thymus gland tumors: differentiation with chemical shift MR imaging[J]. Radiology, 2007, 243(3): 869-876. doi: 10.1148/radiol.2433060797 [9] Haveman JW, Phan HT, Links TP, et al. Implications of mediastinal uptake of 131I with Regard to surgery in patients with differentiated thyroid carcinoma[J]. Cancer, 2005, 103(1): 59-67. [10] Vermiglio F, Baudin E, Travagli JP, et al. Iodine concentration by the thymus in thyroid carcinoma[J]. J Nucl Med, 1996, 37(11): 1830-1831. [11] Meller J, Becker W. The human sodium-iodine symporter(NIS) as a key for specific thymic iodine-131 uptake[J]. Eur J Nucl Med, 2000, 27(5): 473-474. doi: 10.1007/s002590050530 [12] Ramanna L, Waxman AD, Brachman MB, et al. Correlation of thyroglobulin measurements and radioiodine scans in the follow-up of patients with differentiated thyroid cancer[J]. Cancer, 1985, 55(7): 1525-1529. doi: 10.1002/1097-0142(19850401)55:7<1525::AID-CNCR2820550719>3.0.CO;2-S [13] 韩兴, 朱本章.低恶度甲状腺癌患者术后131I治疗[J].国外医学医学地理分册, 2007, 28(4): 174-176.
[14] Salvatori M, Saletnich I, Rufini V, et al. Unusual false-positive radioiodine whole-body scans in patients with differentiated thyroid carcinoma[J]. Clin Nucl Med, 1997, 22(6): 380-384. [15] 陆汉魁.分化型甲状腺癌的131I治疗:需要新思维和新方法[J].中华核医学杂志, 2009, 29(3): 145-146. doi: 10.3760/cma.j.issn.0253-9780.2009.03.001
-





 下载:
下载: