-
金纳米颗粒(Au nanoparticles,AuNPs)具有良好的生物相容性和光学特性[1-3],在临床肿瘤放射治疗和光热治疗方面具有独特的作用[4-5]。到目前为止,已有研究报道,AuNPs在前列腺癌、黑色素瘤和乳腺癌等肿瘤中具有放射增敏作用[6-8]。肿瘤细胞对AuNPs的摄取影响肿瘤放疗效果,而AuNPs的大小和表面化学性质决定肿瘤细胞的摄取量[9-10]。对AuNPs表面进行修饰,可以提高其在水溶液中的稳定性,这是提高细胞摄取的有效方法。
本研究使用巯基-聚乙二醇(sulfhydryl-polyethylene glycol,SH-PEG)对AuNPs表面进行修饰,分析PEG-AuNPs的大小、被肝癌细胞的摄取量以及对肝癌细胞存活率的影响和对肝癌细胞的辐射增敏作用。
-
SH-PEG购自美国Sigma公司,氯金酸(HAuCl4,分析纯)、柠檬酸钠试剂均购于国药集团上海化学试剂有限公司,胎牛血清购于中国杭州四季青公司,RPMI-1640培养基购于美国HyClone公司,UV-1750型紫外分光光度计购自岛津仪器(苏州)有限公司,Infinite 200多功能酶标仪购自瑞士Tecan公司,噻唑蓝、PBS购自北京索莱宝科技有限公司,肝癌细胞HepG2和H22由我所提供。
-
按照常规方法[11]制备AuNPs。将10 mg氯金酸溶于100 ml蒸馏水中,煮沸,分别加入1.3 ml和5 ml 1%的柠檬酸钠溶液作为还原剂,再煮沸30 min,即可制得AuNPs溶液。将制得的AuNPs溶液置于4 ℃冰箱保存备用。AuNPs与带有负电荷的柠檬酸结合后,会导致其表面带有负电荷。为了减少AuNPs的负电荷,使用SH-PEG进行包裹。将1 mg SH-PEG加入到AuNPs的溶液中,搅拌1 h,以离心半径为6.5 cm、16 000 r/min离心30 min,蒸馏水洗2次,即可得到PEG-AuNPs。制备的PEG-AuNPs保存于4 ℃冰箱中,使用前经0.22 μm的滤膜过滤。
使用透射电子显微镜(Hitachi HF-2000,Japan)观测PEG-AuNPs的形态、结构和大小。
-
本研究采用鼠源肝癌细胞系HepG2和人源肝癌细胞系H22。在37 ℃、饱和湿度和5% CO2培养箱中,将两种细胞在含有10%胎牛血清的RPMI-1640培养基中进行培养。培养液每2天更换一次。
-
将生长期的肝癌细胞HepG2和H22的浓度调整为2×104个/ml,分别接种1ml于6孔培养板的孔中,将6孔培养板置于37℃、5% CO2培养箱中培养12 h。将含有PEG-AuNPs的上述培养基同体积加入6孔培养板的孔中,使PEG-AuNPs的终浓度为25 μg/ml。培养24 h后,取出6孔培养板,用胰酶消化贴壁的肝癌细胞,使用PBS洗3次,将收集的样品细胞放入专用铜质网架上,使用透射电子显微镜观察细胞形态。
-
采用Cell Titer-Glo发光法分析存活细胞内ATP的新陈代谢,ATP与存活细胞数量成正比,以此来评价PEG-AuNPs对肝癌细胞HepG2和H22存活率的影响。按照Cell Titer-Glo发光法分析试剂盒(北京普洛麦格生物技术公司)说明书进行操作。细胞以每孔100 μl培养液含有0.3×104个的浓度接种于96孔板中,置于37 ℃、5% CO2培养箱中过夜。第2天用PBS洗2遍,然后加入终浓度分别为0、12.5、25.0、50.0、100.0、和200.0 μg/ml的PEG-AuNPs溶液,每个浓度设置3个平行孔,培养24 h,用20 μl Cell Titer-Glo的活力发光试剂替换孔中的原有培养基,避光10 min,使用多功能酶标仪测定。
-
采用细胞克隆形成实验分析PEG-AuNPs对肝癌细胞HepG2和H22的放射增敏作用。在培养基中,将14.4和30.5 nm PEG-AuNPs的浓度调整为25 μg/ml。将处于生长期的HepG2和H22细胞加入准备好的含有PEG-AuNPs的培养基中,置于37 ℃、5% CO2培养箱中孵育24 h,用137Cs γ射线进行0、1、2和4 Gy剂量照射,照射完成后更换新鲜的培养基。将正常对照组(用不含有PEG-AuNPs的培养基作用于细胞)和实验组(细胞与25 μg/ml的PEG-AuNPs溶液作用)的HepG2和H22细胞悬液浓度调整为0.3×104个/ml,在6孔板中每孔加入2 ml细胞悬液,置于37 ℃、5% CO2培养箱中培养7 d。取出6孔板,弃去上清液,用PBS小心浸洗2次,每孔用固定液(醋酸:甲醇=1:3)固定15 min,然后弃去固定液,加适量的吉姆萨染液染色3~5 min,然后用流水缓慢洗去染色液,放置空气中干燥。然后计数细胞克隆数。
-
用PASW18.0统计软件对数据进行方差分析和t检验,P < 0.05表示差异有统计学意义。
-
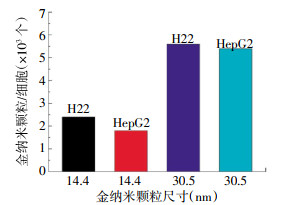
制备的两种尺寸的PEG-AuNPs分别为14.4 nm和30.5 nm。AuNPs经过表面修饰后会影响细胞的内吞途径,HepG2和H22细胞膜形成小的突起来捕获周围的PEG-AuNPs。HepG2和H22细胞摄取两种尺寸的PEG-AuNPs的量见图 1。如图中所示,30.5 nm比14.4 nmPEG-AuNPs更容易被HepG2和H22细胞摄取。这与最近报道的30 nm的PEG-AuNPs有很高的细胞摄取量的结果一致[12-14]。
-
图 2为14.4 nm和30.5 nm PEG-AuNPs对H22(图 2a)和HepG2(图 2b)细胞存活率的影响。当PEG-AuNPs浓度为12.5~50.0 μg/ml时,30.5 nm PEG-AuNPs抑制HepG2细胞存活率的作用大于14.4 nm PEG-AuNPs;当浓度为50.0 μg/ml时,两者间的差异有统计学意义(t=9.08,P < 0.05)。本研究结果表明,PEG-AuNPs浓度的增加抑制了HepG2和H22细胞的存活率,且表现出细胞毒性作用。当浓度为12.5~50.0 μg/ml时,30.5 nm PEG-AuNPs对HepG2细胞的存活率具有更强的抑制作用,这与之前报道的结果一致[15]。
-
采用克隆形成实验分析PEG-AuNPs对H22和HepG2细胞的放射增敏作用结果见图 3。图中所示,在辐射剂量为0~4 Gy时,随剂量的增加,正常对照组的H22和HepG2细胞的存活分数明显降低,14.4 nm和30.5 nm PEG-AuNPs处理的H22和HepG2细胞存活分数低于相应的正常对照组,30.5 nm PEG-AuNPs对HepG2细胞存活分数的抑制比14.4 nm PEG-AuNPs的作用明显。当辐射剂量为1 Gy和2 Gy时,14.4 nm和30.5 nm PEG-AuNPs对H22细胞的辐射增敏作用与相应的正常对照组相比,差异有统计学意义差异(当辐射剂量为1 Gy时,14.4 nm:t=4.88,30.5 nm:t=10.01,P均 < 0.05;当辐射剂量为2 Gy时,14.4 nm:t=4.88,30.5 nm:t=0.85,P均 < 0.05)(图 3a)。辐射剂量为1 Gy和4 Gy时,30.5 nm PEG-AuNPs对HepG2细胞的辐射增敏作用与相应的正常对照组相比,差异有统计学意义(当辐射剂量为1 Gy时,t=6.01,P < 0.05;当辐射剂量为4 Gy时,t=0.74,P < 0.05)(图 3b)。
-
AuNPs对肿瘤细胞的毒性作用和辐射增敏作用与其被肿瘤细胞的摄取密切相关,肿瘤细胞摄取AuNPs的数量是由颗粒尺寸和表面化学性质决定的[9-10]。AuNPs的大小通过加入柠檬酸钠的量来控制。柠檬酸钠量的增加会减小合成的AuNPs的尺寸。柠檬酸钠是强碱弱酸盐,其水溶液的pH值约为8,加入的柠檬酸钠增多,溶液的pH值越大,OH-就越多,溶液中OH-结合成络合物的氯金酸就越多。所以与AuNPs形成初期表面上包裹的柠檬酸钠的OH-的氯金酸就会减少,使得反应过程中颗粒的聚集减少,制备的PEG-AuNPs的尺寸就越小。反之,加入的柠檬酸钠越少,氯金酸被还原的就越不充分,制得的PEG-AuNPs的尺寸就越大[16-17]。所以当分别加入1.3 ml和5 ml的柠檬酸钠时,制得的AuNPs的尺寸分别为30.5 nm和14.4 nm。
PEG-AuNPs更稳定,其可以通过内吞被肿瘤细胞摄取[18-20],SH-PEG包含有巯基端,通过Au-S共价键与AuNPs结合。SH-PEG的末端具有很强的亲水性,从而提高了AuNPs的亲水性。当PEG-SH与AuNPs结合的浓度比较低时,SH-PEG链间的距离比较大,两者之间不能够有效地相互作用,SH-PEG链将弯曲、绕圈形成类似“蘑菇”的聚集体;当浓度变高时,SH-PEG链将变得更紧,并且在水溶液中完全延伸形成类似“刷子”的结构[18]。本研究中使用的浓度接近于饱和浓度,颗粒表面上的结合物有所提高,形成类似“刷子”的聚集体,增加了颗粒的分散性和生物相容性。
本研究结果证实,30.5 nm比14.4 nm PEG-AuNPs更容易被HepG2和H22细胞摄取。修饰后的PEG-AuNPs的浓度增加明显抑制了HepG2和H22细胞的存活率,表现出细胞毒性作用。在浓度为12.5~50.0 μg/ml时,30.5 nm PEG-AuNPs对HepG2细胞存活率具有更强的抑制作用。在辐射剂量为0~4 Gy时,随剂量的增加,正常对照组的H22和HepG2细胞的存活率明显降低。14.4 nm和30.5 nm PEG-AuNPs处理的H22和HepG2细胞存活率低于相应的正常对照组,30.5 nm PEG-AuNPs对HepG2细胞存活率的抑制作用比14.4 nm PEG-AuNPs明显。这表明使用SH-PEG对AuNPs表面进行修饰得到14.4 nm和30.5 nm两种不同的PEG-AuNPs,其中30.5 nm PEG-AuNPs更容易被肝癌细胞摄取,从而抑制肝癌细胞生长的作用。同样,通过辐射两种肝癌细胞克隆形成实验表明,两种不同大小的PEG-AuNPs能提高辐射抑制肝癌细胞克隆生长作用,表明其具有辐射增敏作用,这种辐射增敏作用与AuNPs的大小有关。本研究对PEG-AuNPs进行实验所得的结果与文献报道的其大小和表面化学性质决定摄取量的结果相一致[9-10]。
综上所述,AuNPs经过PEG-SH修饰后,制得了大小比较均匀的14.4 nm和30.5 nm PEG-AuNPs。30 nm PEG-AuNPs更容易被肝癌细胞经过胞饮作用所吞噬,对肝癌细胞的抑制作用更明显,能增加辐射对肝癌细胞的杀伤作用。
金纳米颗粒修饰及其对肝癌细胞生长和辐射损伤的影响
Effect of Au nanoparticles modified with sulfhydryl-polyethylene glycol on liver cancer cell proliferation and radiation damage
-
摘要:
目的 用巯基-聚乙二醇(SH-PEG)对金纳米颗粒(AuNPs)进行化学修饰(PEG-AuNPs)并分析其对肝癌细胞存活率和辐射对肝癌细胞作用的影响。 方法 制备的AuNPs用SH-PEG进行化学修饰,用透射电子显微镜观测PEG-AuNPs的大小及肝癌细胞对其的摄取,应用Cell Titer-Glo发光法和克隆形成实验分别分析PEG-AuNPs对肝癌细胞的生长抑制作用和辐射对肝癌细胞作用的影响。 结果 制备的PEG-AuNPs的尺寸分别为14.4 nm和30.5 nm。30.5 nm PEG-AuNPs更容易被肝癌细胞摄取,表现出明显地抑制肝癌细胞生长的作用和提高辐射对肝癌细胞的杀伤作用。 结论 AuNPs经过SH-PEG化学修饰,30.5 nm PEG-AuNPs对肝癌细胞的生长抑制作用和提高辐射杀伤肝癌细胞的作用强于14.4 nm PEG-AuNPs。 Abstract:Objective Au nanoparticles(AuNPs)was chemically modified with sulfhydryl-polyethylene glycol(SH-PEG) and its effects on liver cancer cell survival and radiation damage were assessed. Methods PEG-AuNPs were chemically fabricated with SH-PEG and AuNPs. The size of PEG-AuNPs and uptake by liver cancer cell were observed by field-emission transmission electron microscopy(TEM). The Cell Titer-Glo luminescent cell viability assay and cell colonies were used to examine effect of PEG-AuNPs on liver cancer cells′ survival and radiation damage. Results 14.4 nm and 30.5 nm PEG-AuNPs were obtained by above fabrication. 30.5 nm PEG-AuNPs were presented more absorption, inhibition the survival and enhance radiation effect to liver cancer cell. Conclusions After modification with SH-PEG, larger PEG-AuNPs with 30.5 nm showed stronger inhibition in liver cancer cellular survival and promoted liver cancer cells sensitive to radiation. -
Key words:
- Polyethylene glycols /
- Au nanoparticles /
- Radiosensitive /
- Liver cancer cell
-
-
[1] Rosi NL, Giljohann DA, Thaxton CS, et al. Oligonucleotide-modified gold nanoparticles for intracellular gene regulation[J]. Science, 2006, 312(5776): 1027-1030. doi: 10.1126/science.1125559 [2] Sokolov K, Follen M, Aaron J, et al. Real-time vital optical imaging of precancer using anti-epidermal growth factor receptor antibodies conjugated to gold nanoparticles[J]. Cancer Res, 2003, 63(9): 1999-2004. [3] Wu D, Zhang XD, Liu PX, et al. Gold Nanostructure: fabrication, surface modification, targeting imaging, and enhanced radiotherapy[J]. Curr Nanoscience, 2011, 7(1): 110-118. [4] Chithrani DB, Jelveh S, Jalali F, et al. Gold nanoparticles as radiation sensitizers in cancer therapy[J]. Radiat Res, 2010, 173(6): 719-728. doi: 10.1667/RR1984.1 [5] Hainfeld JF, Dilmanian FA, Zhong Z, et al. Gold nanoparticles enhance the radiation therapy of a murine squamous cell carcinoma[J]. Phy Medi Biol, 2010, 55(11): 3045-3059. doi: 10.1088/0031-9155/55/11/004 [6] Jain S, Hirst DG, O′sullivan JM. Gold nanoparticles as novel agents for cancer therapy[J]. Br J Radiol, 2012, 85(1010): 101-113. doi: 10.1259/bjr/59448833 [7] Butterworth K, Coulter J, Jain S, et al. Evaluation of cytotoxicity and radiation enhancement using 1.9 nm gold particles: potential application for cancer therapy[J/OL]. Nanotechnology, 2010, 21(29): 295101[2013-12-24]. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3016629/. [8] Jain S, Coulter JA, Hounsell AR, et al. Cell-specific radiosensitization by gold nanoparticles at megavoltage radiation energies[J]. Int J Radiat Oncol Biol Phy, 2011, 79(2): 531-539. doi: 10.1016/j.ijrobp.2010.08.044 [9] Chithrani BD, Chan WC. Elucidating the mechanism of cellular uptake and removal of protein-coated gold nanoparticles of different sizes and shapes[J]. Nano Lett, 2007, 7(6): 1542-1550. doi: 10.1021/nl070363y [10] Chithrani BD, Ghazani AA, Chan WC. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells[J]. Nano Lett, 2006, 6(4): 662-668. [11] Turkevich J, Stevenson PC, Hillier J. A study of the nucleation and growth processes in the synthesis of colloidal gold[J]. Discuss Faraday Soc, 1951, 11: 55-75. doi: 10.1039/df9511100055 [12] Brandenberger C, Mühlfeld C, Ali Z, et al. Quantitative evaluation of cellular uptake and trafficking of plain and polyethylene glycol-coated gold nanoparticles[J]. Small, 2010, 6(15): 1669-1678. doi: 10.1002/smll.201000528 [13] Zhang G, Yang Z, Lu W, et al. Influence of anchoring ligands and particle size on the colloidal stability and in vivo biodistribution of polyethylene glycol-coated gold nanoparticles in tumor-xenografted mice[J]. Biomaterials, 2009, 30(10): 1928-1936. doi: 10.1016/j.biomaterials.2008.12.038 [14] Verma A, Stellacci F. Effect of surface properties on nanoparticle-cell interactions[J]. Small, 2010, 6(1): 12-21. doi: 10.1002/smll.200901158 [15] Lewinski N, Colvin V, Drezek R. Cytotoxicity of nanoparticles[J]. Small, 2008, 4(1): 26-49. doi: 10.1002/smll.200700595 [16] 张晓东, 宋莎莎, 陈婕, 等. 15 nm聚乙二醇保护的Au纳米颗粒对HepG23细胞的放射增敏作用[J].国际放射医学核医学杂志, 2014, 38(1): 5-9.
[17] 陈婕, 张晓东, 吴迪, 等.疏基-聚乙二醇修饰的不同尺寸金纳米颗粒的制备和光学特性[J].国际放射医学核医学杂志, 2013, 37(1): 16-19. doi: 10.3760/cma.j.issn.1673-4114.2013.01.005
[18] Zhang XD, Wu D, Shen X, et al. Size-dependent radiosensitization of PEG-coated gold nanoparticles for cancer radiation therapy[J]. Biomaterials, 2012, 33(27): 6408-6419. doi: 10.1016/j.biomaterials.2012.05.047 [19] Giljohann DA, Seferos DS, Patel PC, et al. Oligonucleotide loading determines cellular uptake of DNA-modified gold nanoparticles[J]. Nano Lett, 2007, 7(12): 3818-3821. doi: 10.1021/nl072471q [20] Nativo P, Prior IA, Brust M. Uptake and intracellular fate of surface-modified gold nanoparticles[J]. ACS Nano, 2008, 2(8): 1639-1644. doi: 10.1021/nn800330a -






 下载:
下载: