-
缺血性脑血管病(ischemic cerebrovascular disease,ICVD)是临床最常见的脑部疾病,其发病率和病死率均很高。本研究对33例脑血管重度狭窄的ICVD患者进行18F-FDG和13N-Ammonia PET联合显像,初步探讨在血管狭窄程度相似情况下,脑葡萄糖代谢与脑血流灌注的受损特点和相互关系。
-
收集2013年1月至2013年10月来我院神经外科和神经内科就诊的患者33例,其中,男性22例、女性11例,年龄35~82岁,平均年龄(57±12.5)岁。依据《中国急性缺血性脑卒中诊疗指南2010》[1]和《中国脑血管病防治指南》[2],将19例患者临床诊断为短暂性脑缺血发作(transient ischemic attack,TIA),14例患者诊断为陈旧性脑梗死合并TIA。所有患者通过行经颅多普勒、CT血管成像、磁共振血管造影或数字减影血管造影中的1~2项检查,证实存在脑血管重度狭窄或闭塞。33例患者中,单侧病变9例,其中颈内动脉狭窄或闭塞3例、大脑中动脉5例、颈内动脉合并大脑中动脉1例;双侧病变24例,其中双侧大脑中动脉病变3例、双侧颈内动脉狭窄合并左侧椎动脉狭窄1例、双侧大脑中动脉闭塞合并左侧椎动脉狭窄1例,其余19例为3支以上病变。
根据北美症状性颈动脉内膜切除术试验(North American Symptomatic Carotid Endarterectomy Trial,NASCET)分级法[3-4]判断患者的血管狭窄程度,重度狭窄:血管内径缩小70%~99%;完全闭塞:闭塞前状态NASCET测量狭窄度>99%。本研究中以颈内动脉病变为主者15例,其中重度狭窄9例、闭塞6例;以大脑中动脉病变为主者18例,其中重度狭窄者7例、闭塞11例。
33例患者中,共有24例进行了常规影像学检查,其中头颅MRI检查14例、CT检查6例、CT和MRI联合检查4例,有14例可见脑梗死灶。
-
我科取得了第四类《放射性药品使用许可证》,参照文献[5]和我科放射性药物实验室生产规范[6],自行制备了18F-FDG和13N-Ammonia,这两种显像剂均通过医院伦理委员会论证审批,并在北京市食品药品监督管理局备案。
-
32例患者于同一日进行13N-Ammonia和18F-FDG PET显像,参照我科检查规程[6-7],先静脉注射13N-Ammonia 444~555 MBq进行脑血流灌注显像,然后静脉注射18F-FDG 185 MBq进行脑代谢显像,经计算机图像重建,得到横断层、冠状断层和矢状断层影像。另1例患者先行13N-Ammonia PET显像,隔日行18F-FDG PET显像。
所有患者或患者家属在检查前均签署了知情同意书。
-
采用目视分析法,由2名有经验的核医学科医师进行读片,重点观察额叶、顶叶、颞叶、枕叶、基底节和丘脑的放射性分布与摄取程度。以健侧相应部位的放射性摄取为标准,将连续2个方位和2个以上层面出现的放射性摄取减低(或增高)视为异常。
-
采用ROI计数,首先获得两小脑中部层面单位面积平均放射性计数(若出现交叉性小脑失联络情况,则使用放射性分布正常的一侧)并将其作为标准,然后将额叶、顶叶、颞叶、枕叶、基底节和丘脑的单位面积平均放射性计数与小脑计数比较,获得以上区域的脑区/小脑比值。对18F-FDG PET影像进行处理,将18F-FDG获得的脑区/小脑比值作为脑代谢值;对13N-Ammonia PET影像进行处理,将13N-Ammonia获得的脑区/小脑比值作为脑血流值。
-
按照以下公式计算脑代谢减低率和脑血流减低率:
$ 脑代谢减低率 = \left[ {1 - \left( {患侧脑代谢值/健侧脑代谢值} \right)} \right]{\rm{ \times }}100\% $ $ 脑血流减低率 = \left[ {1 - \left( {患侧脑血流值/健侧脑血流值} \right)} \right]{\rm{ \times }}100\% $ -
将ICVD患者病变部位的代谢值与血流值进行比较,获得病灶的脑代谢/脑血流比值。
-
在前期研究的基础上[6],将脑代谢/脑血流比值作为区分匹配类型的指标,并根据本研究结果提出评价标准。
-
依据我科研究资料,在对ICVD患者脑代谢、脑血流损害程度前期研究的基础上,将脑代谢减低率和脑血流减低率作为评价损害程度的指标,并提出以下标准(表 1)。
损害程度 脑代谢减低率(%) 脑血流减低率(%) 轻度受损 10~14 8~12 中度受损 15~24 13~20 重度受损 ≥25 ≥21 表 1 评价不同程度脑代谢、脑血流损害的参考标准
Table 1. Reference standards about evaluating different degrees of damaged cerebral glucose metabolism and cerebral blood flow
-
使用SPSS17.0统计学软件计算不匹配型病灶中脑代谢/脑血流比值增高组和减低组的脑代谢/脑血流比值及95%CI,采用独立样本t检验比较两者差异有无统计学意义;并对匹配型轻度、中度及重度受损的3组病灶的代谢值、血流值、代谢减低率和血流减低率进行非参数检验(Kruskal-Wallis检验),比较各组之间代谢值、血流值、代谢减低率和血流减低率的差异是否有统计学意义。P < 0.05表示差异有统计学意义。
-
① 33例患者共发现病灶121个,其中,额叶病灶19个、顶叶病灶31个、颞叶病灶20个、枕叶病灶17个、基底节病灶14个、丘脑病灶14个、小脑病灶6个。②33例患者中,发现单侧病变者20例,病灶69个,其中单侧单灶者3例、单侧多灶者17例(共66个病灶);双侧病变者13例,病灶52个,双侧病变者的病灶位置并不在同一对称的脑区。③121个病灶中,18F-FDG摄取异常111个,占91.7%,病灶均表现为不同程度的放射性摄取减低,未见放射性摄取增高的病灶。④121个病灶中,13N-Ammonia摄取异常95个,占78.5%,其中93个病灶表现为放射性摄取减低,2个病灶为放射性摄取增加。
-
从匹配关系看,首先以目视分析法作为基本方法,对PET影像进行分类。33例患者中,9例可见脑代谢-脑血流匹配性受损病灶,表现为18F-FDG摄取减低程度与13N-Ammonia摄取减低程度基本一致,此类病灶可称为脑代谢-脑血流匹配型受损;5例可见脑代谢-脑血流不匹配性病灶,表现为18F-FDG摄取减低程度与13N-Ammonia摄取减低程度不一致,此类病灶可称为脑代谢-脑血流不匹配型受损;另外19例同时存在着匹配型与不匹配型病灶。
121个病灶中,共有66个病灶属于匹配型受损(称为Ⅰ型,典型影像见图 1),占54.5%,其中轻度减低灶27个、中度减低灶15个、重度减低灶24个;55个病灶属于不匹配型受损,占45.5%,又可分为4种类型:Ⅱ型(典型影像见图 2):26个病灶18F-FDG摄取不同程度减低(其中轻度减低灶17个、中度7个、重度2个);而13N-Ammonia摄取正常。Ⅲ型:10个病灶13N-Ammonia摄取轻度减低;而18F-FDG摄取正常。Ⅳ型:17个病灶18F-FDG摄取中重度减低(其中中度减低灶10个、重度7个);而13N-Ammonia摄取仅轻度减低。Ⅴ型:2个病灶18F-FDG摄取轻度减低;而13N-Ammonia摄取轻中度增高。

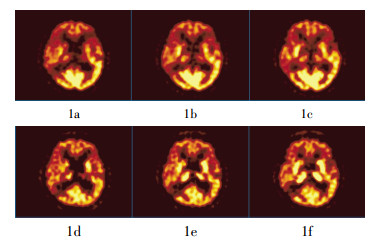
图 1 左大脑中动脉闭塞的缺血性脑血管病患者的18F-FDG和13N-Ammonia PET联合显像图。患者男性,56岁,言语不利4年。数字减影血管造影示左大脑中动脉闭塞;颈超示双侧颈内动脉内膜增厚,右锁骨下动脉单发斑块;MRI示右额顶交界区、右颞枕交界区脑梗死,左颞叶、双侧放射冠区多发陈旧梗死灶;PET示双侧额叶局部呈放射性摄取明显减低区,以左侧为著,左侧颞叶前部及右枕叶放射性摄取重度减低,代谢减低率分别为48%、40%、35%(1a~1c);血流减低率分别为42%、37%、35%(1d~1f)。脑代谢-脑血流呈匹配型影像(玉型)。
Figure 1. 18F-FDG and 13N-Ammonia brain PET of ischemic cerebrovascular disease patient with left middle cerebral artery occlusion
-
将目视分析法划分的66个匹配型病灶与55个不匹配型病灶进行统计学处理:匹配型病灶的脑代谢/脑血流比值为1.10±0.13,95%CI为1.08~1.18;不匹配型病灶的脑代谢/脑血流比值分为两种情况:脑代谢/脑血流比值增高组(10个病灶)为1.29±0.19,95%CI为1.28~1.56;脑代谢/脑血流比值减低组(45个病灶)为1.02±0.13,95%CI为0.95~1.08。采用独立样本t检验进行两组比较,两组间差异具有统计学意义(t=-6.842,P < 0.01)。若将95%CI的参数作为考虑的依据,结合前期研究,提出匹配型病灶的脑代谢/脑血流比值范围为1.1~1.3,高于或低于此范围均属于不匹配型病灶。
-
对匹配型轻度、中度和重度脑代谢-脑血流受损的3组病灶的脑代谢值、脑血流值、脑代谢减低率和脑血流减低率进行方差齐性检验,方差不齐(P<0.05),故选择非参数检验(Kruskal-Wallis检验),结果见表 2。
受损程度 病灶数 脑代谢值 脑血流值 脑代谢减低率(%) 脑血流减低率(%) 轻度受损 27 0.98±0.07 0.88±0.08 9.78±2.56 8.89±2.31 中度受损 15 0.96±0.12 0.83±0.07 17.07±2.09 16.00±2.17 重度受损 24 0.64±0.19 0.62±0.20 42.00±14.61 39.21±16.03 χ2值 38.192 28.170 56.854 56.800 P值 <0.01 <0.01 <0.01 <0.01 表 2 轻度、中度和重度脑代谢-脑血流减低灶各项指标的比较(x±s)
Table 2. Comparison of each index in mild, moderate and severe cerebral glucose metabolism and cerebral blood flow decrease foci(x±s)
各组之间进行两个独立样本检验(Mann-Whitney检验),轻度受损组与中度受损组的脑代谢值(Z=-1.210,P > 0.05)、脑血流值(Z=-1.631,P > 0.05)差异无统计学意义,脑代谢减低率(Z=-5.340,P < 0.01)、脑血流减低率(Z=-5.302,P < 0.01)差异有统计学意义;轻度受损组与重度受损组的脑代谢值、脑血流值、脑代谢减低率和脑血流减低率差异均有统计学意义(Z=-5.987、-4.394、-5.217和-5.201,P均 < 0.01);中度受损组与重度受损组的脑代谢值、脑血流值、脑代谢减低率和脑血流减低率差异均有统计学意义(Z=-4.973、-3.107、-6.129和-6.131,P均 < 0.01)。
-
① 33例患者全部为脑动脉重度狭窄或闭塞,血管狭窄程度均≥70%,其中8例为单支血管病变,25例为多支血管病变。②在脑代谢-脑血流匹配型受损的66个病灶中,27个表现为代谢、血流轻度减低,占40.9%(图 3);24个为重度减低,占36.4%;其余15个为中度减低,占22.7%。③在脑代谢-脑血流不匹配型受损的55个病灶中,34个表现为代谢减低,其中轻度减低17个、重度减低17个,部分病灶合并不同程度的血流减低(图 4);29个病灶表现为血流异常,其中血流轻度减低27个、血流反向增高2个,部分病灶合并血流减低。
-
本研究中有4例单侧脑内病变的患者对侧小脑可见放射性摄取减低,病灶位置涉及额叶、顶叶、颞叶、枕叶、基底节和丘脑,其中3例为大面积脑代谢、脑血流减低。
-
ICVD是因脑的主要供血动脉发生狭窄或闭塞,引起脑血流量降低[8],从而导致相应部位的脑组织缺血、坏死的一类疾病,主要包括TIA、脑血栓和脑梗死等,多由动脉粥样硬化引起,其形成机制尚未完全阐明,目前大动脉狭窄和闭塞被认为是主要病因[9]。作为一类最常见的脑血管疾病,ICVD的发病率、病死率和致残率均很高[10-11],其在我国的发病率呈逐年上升趋势,所造成的社会经济负担每年高达200亿元[12]。因此,准确诊断和及时治疗ICVD具有十分重要的意义。
-
在本研究中,以18F-FDG PET显像作为评价脑代谢的方法,其显像阳性率为91.7%(111/121);以13N-Ammonia PET显像作为评价脑血流的方法,其显像阳性率为78.5%(95/121)。此结果提示,无论18F-FDG显像还是13N-Ammonia显像,单用任何一种显像方法都不能显示全部病灶。为了提高脑缺血灶的显像阳性率,进行脑代谢-脑血流联合显像是十分必要的。另一方面,从ICVD病变的基本特点可以看出,进行联合显像更重要的临床意义在于全面、准确地评价ICVD患者脑组织的受损情况。
-
由于脑代谢受损与脑血流受损存在着多种情况,对两者的匹配关系进行评价具有非常重要的临床意义。从诊断来说,基于正常脑组织存在着脑代谢-脑血流高度匹配的基本特点,任何脑代谢、脑血流匹配关系的变化都可提示脑功能受损;从治疗来说,当病变部位的脑代谢-脑血流恢复到正常匹配关系时,可以提示病情的好转。
本研究使用脑代谢/脑血流比值作为评价两者匹配关系的半定量指标。前期研究显示,正常人的脑代谢/脑血流比值在不同脑区有所不同,并且其变化范围是比较狭窄的[6]。如果直接使用正常人的参数作为划分ICVD患者的标准,可能会有比较多的患者被划分为脑代谢-脑血流不匹配的类型,与目视分析法的判断结果形成较大不同。因此,本研究以目视分析法为基础,首先对在脑代谢、脑血流两种影像的读片上认为属于匹配型的病例进行分析,获得其脑代谢/脑血流比值。经与不匹配类型进行比较,显示两者差异具有统计学意义,可以作为评价指标在临床中使用。此参数的提出,可为目视分析法的应用提供比较有力的定量数据支撑。
-
本研究提出了针对ICVD患者脑代谢、脑血流受损程度的评价标准。通过对脑代谢值、脑血流值、脑代谢减低率和脑血流减低率4项指标的细致分析,确定以脑代谢减低率和脑血流减低率作为评价脑组织功能受损程度的指标。
由于方差不齐,本研究使用Kruskal-Wallis检验(非参数检验)对匹配型受损中轻度、中度和重度3组患者的脑代谢值、脑血流值、脑代谢减低率和脑血流减低率进行分析,结果显示差异均有统计学意义,说明这3组病灶的总体特点是不相同的。
但是,当采用Mann-Whitney检验进行两组之间的分析时,在轻度受损组与中度受损组的比较中,脑代谢值和脑血流值两项指标差异无统计学意义;而脑代谢减低率和脑血流减低率两项指标无论在哪种情况下(轻度与中度、轻度与重度、中度与重度的比较)均可见显著性差异。因此,从更加准确的角度考虑,选择脑代谢减低率和脑血流减低率作为划分不同程度的脑组织损害的指标更有意义。从计算公式可以看出,脑代谢减低率和脑血流减低率是在将病变部位脑代谢值、脑血流值与对称部位正常脑区相应数值进行比较后才获得的,因此比直接使用病变部位的参数值更加准确。
-
ICVD病灶大多呈多灶性和不对称性分布的特点。本研究33例患者的121个病灶中发现单侧单灶者仅3例(3个病灶),其余30例(118个病灶)均为2个以上病灶,其中单侧多灶者17例,共66个病灶,占54.5%(66/121);双侧多灶者13例,共52个病灶,占43.0%(52/121)。由于双侧病变者的病灶位置并不在同一对称的脑区,因此,仍然可以采用对侧放射性分布正常的脑区作为参照,用以评价病变部位的受损程度。
-
4例单侧脑内病变的患者对侧小脑出现脑代谢和脑血流减低的现象,称为交叉性小脑失联络,原因可能是脑缺血导致皮质桥小脑束受损,使对侧小脑失去神经支配[13],其发生机制尚有待进一步研究。这种现象最常见于脑梗死患者,梗死面积大者发生率较高[14]。
-
正常脑组织的脑血流量与脑代谢水平是紧密匹配的,代谢增高的脑区其局部脑血流量也明显增高,反之,处于生理性代谢减低的脑区,其脑血流量也减低,因此,正常脑代谢-脑血流是一种完全匹配的关系[15]。在ICVD患者中,可以观察到脑代谢与脑血流受损的两大类情况,即脑代谢-脑血流匹配型受损和不匹配型受损,后者又包括几种类型。以往对ICVD患者脑代谢-脑血流匹配关系的研究曾提出异常影像的5种类型[6]。在本研究中,同样可以见到这5种类型:Ⅰ型(脑代谢-脑血流匹配性减少,减低程度基本相同)占54.5%(66/121);Ⅱ型(脑代谢不同程度减低,脑血流保持正常)占21.5%(26/121);Ⅲ型(脑血流不同程度减低,脑代谢保持正常)占8.3%(10/121);Ⅳ型(脑代谢中重度减低,脑血流轻度减低)占14.1%(17/121);Ⅴ型(脑代谢不同程度减低,脑血流反向增高)占1.7%(2/121)。
-
本研究中33例患者的脑血管狭窄程度均≥70%,属于重度狭窄,但脑代谢、脑血流减低程度却不相同。在脑代谢-脑血流匹配型受损的66个病灶中,仅有36.4%(24/66)的病灶表现为脑代谢-脑血流重度减低,还有40.9%(27/66)的病灶仅表现为轻度减低,其余的病灶是中度受损。由此可以看出,虽然脑血管已经是严重狭窄,但脑代谢与脑血流的损害程度却有轻度、中度和重度的差异。在脑代谢-脑血流不匹配型受损的病灶中,同样可以发现不同程度脑代谢、脑血流受损的情况。以上结果提示,脑血管的狭窄程度不能代表脑代谢、脑血流的受损程度;在经过脑血管检查后,非常需要进一步进行脑代谢-脑血流联合检查,了解脑功能状态,为实施正确治疗提供依据。
-
ICVD患者脑代谢-脑血流之所以会出现不同的匹配类型,可能与病变在不同阶段的病理生理状态不同有关。以急性脑梗死为例,梗死灶首先出现局部脑血流量明显下降,但脑葡萄糖代谢仅轻度下降,即灌注减低后存在着脑代谢代偿性改变,称为“misery perfusion(贫乏灌注)”。1周后梗死灶倾向于脑血流量增加而代谢仍处于较低水平,这种现象称为“luxury perfusion(过度灌注)”,这也许是脑血流代偿性改变的表现。1个月后的慢性脑梗死,脑血流、脑代谢均呈现明显匹配性减低,形成在解剖影像上边界清晰的病灶[15]。上述演变过程可以在本研究所发现的5种匹配类型中找到,贫乏灌注类似于Ⅲ型病灶,过度灌注类似于Ⅴ型病灶,慢性脑梗死类似于Ⅰ型病灶。对于脑缺血患者,由于其处于脑梗死之前的阶段,因此,在表现类型上会出现更多的类型,如Ⅱ型和Ⅳ型病灶。
-
按照一般的认识,脑血管的狭窄程度与脑代谢、脑血流的受损程度密切相关,即脑血管重度狭窄者,脑代谢、脑血流也会重度受损。然而本研究发现,虽然所有患者均为脑血管重度狭窄,但在66个匹配型受损病灶中,仅有36.4%的病灶表现为脑代谢-脑血流重度减低,更多的病灶(40.9%)仅表现为轻度减低,因此仅凭血管狭窄程度并不能准确评价脑功能情况。分析可能原因是脑代谢、脑血流的受损程度不仅与血管狭窄程度相关,还取决于脑组织的代偿能力[16]。有研究发现,在代偿期积极治疗的患者预后良好[17];而对于代偿能力差的脑功能重度受损患者,即使解除狭窄,脑功能的恢复也需要很长时间。至于脑血管轻度狭窄患者的脑代谢、脑血流受损情况,还需要进一步研究。
本研究显示,利用脑代谢-脑血流PET联合显像获得的脑血管重度狭窄患者的脑代谢与脑血流损害特点,对于ICVD的准确诊断和疗效的提高具有十分重要的意义和应用价值。
脑血管重度狭窄患者脑代谢与脑血流损害特点初步研究
Initial research on the damaged characteristics of cerebral glucose metabolism and cerebral blood flow in patients with severe cerebral artery stenosis
-
摘要:
目的 探讨脑血管重度狭窄或闭塞患者脑葡萄糖代谢与脑血流灌注的受损特点。 方法 采用18F-FDG和13N-Ammonia PET联合脑显像,对33例缺血性脑血管病(ICVD)患者进行检查,获得同期脑葡萄糖代谢和脑血流灌注影像。经半定量分析,得到脑代谢减低率、脑血流减低率和脑代谢/脑血流比值。 结果 ① 共发现病灶121个,18F-FDG显像阳性率为91.7%,13N-Ammonia显像阳性率为78.5%。②ICVD病灶呈多灶性和不对称性分布。③根据两种影像的匹配性,将病灶分为两大类(5种类型):匹配型(Ⅰ型)病灶66个,占54.5%;不匹配型(Ⅱ型~Ⅴ型)病灶55个,占45.5%。④以脑代谢/脑血流比值为指标,匹配型病灶的比值为1.10±0.13;不匹配型病灶比值增高组的95%CI为1.28~1.56,比值减低组的95%CI为0.95~1.08。将脑代谢/脑血流比值1.1~1.3作为区分匹配型与不匹配型的标准。⑤以脑代谢减低率和脑血流减低率为指标,将66个匹配型病灶分为轻度、中度、重度受损3组,各组之间的脑代谢、脑血流减低率差异均有统计学意义(χ2=56.854和56.800,P均<0.01)。其中,轻度受损病灶27个,占40.9%;中度受损病灶15个病灶,占22.7%;重度受损病灶24个,占36.4%。⑥4例单侧脑内病变者可见交叉性小脑失联络。 结论 脑血管重度狭窄患者脑代谢与脑血流的匹配关系明显受损,但其中存在着不同程度的脑代谢与脑血流损害;脑代谢-脑血流联合PET显像在脑血管重度狭窄患者脑损伤程度的评估中具有重要意义和应用价值。 -
关键词:
- 正电子发射断层显像术 /
- 脑葡萄糖代谢 /
- 脑血流灌注 /
- 缺血性脑血管病
Abstract:Objective To investigate the damaged characteristics of cerebral glucose metabolism(CGM)and cerebral blood flow(CBF)in ischemic cerebrovascular disease(ICVD)patients with severe cerebral artery stenosis or occlusion. Methods Thirty-three cases of ICVD patients were examined by 18F- FDG PET and 13N-Ammonia PET, obtaining the same stages of cerebral blood perfusion and glucose metabolism image. According to the semi-quantitative analysis, the rate of reductions in CGM and CBF, and the ratio of CGM/CBF were figured out. Results ① There were 121 foci in total, positive rate of 18F-FDG imaging was 91.7%, and 13N-Ammonia imaging was 78.5%. ②ICVD foci were mostly characterized with multifocal and asymmetric distribution. ③Based on visual analysis to the relationship of FDG images and Ammonia images, 121 foci were divided into two types: matched damage in 66 foci(54.5%, type Ⅰ)and mismatched damage in 55 foci(45.5%, type Ⅱ-type Ⅴ). ④Based on semi-quantitative study to matched and mismatched group, the ratio of CGM/ CBF with 1.1-1.3 may be considered as the parameter in evaluation. ⑤Based on the rate of reductions in CGM and CBF, 66 matched foci were divided into mild(27 foci, 40.9%), moderate(15 foci, 22.7%)and severe(24 foci, 36.4%) damage group. ⑥4 cases with unilateral foci appeared crossed cerebellar diaschisis. Conclusions The matched relationship of CGM and CBF was markedly damaged in IVCD patients with sever cerebral artery stenosis but different degrees of injury on metabolism and blood flow were also found. The application of combined imaging with 18F-FDG and 13N-Ammonia brain PET is able to greatly improve ICVD diagnosis and management. -
图 1 左大脑中动脉闭塞的缺血性脑血管病患者的18F-FDG和13N-Ammonia PET联合显像图。患者男性,56岁,言语不利4年。数字减影血管造影示左大脑中动脉闭塞;颈超示双侧颈内动脉内膜增厚,右锁骨下动脉单发斑块;MRI示右额顶交界区、右颞枕交界区脑梗死,左颞叶、双侧放射冠区多发陈旧梗死灶;PET示双侧额叶局部呈放射性摄取明显减低区,以左侧为著,左侧颞叶前部及右枕叶放射性摄取重度减低,代谢减低率分别为48%、40%、35%(1a~1c);血流减低率分别为42%、37%、35%(1d~1f)。脑代谢-脑血流呈匹配型影像(玉型)。
Figure 1. 18F-FDG and 13N-Ammonia brain PET of ischemic cerebrovascular disease patient with left middle cerebral artery occlusion
表 1 评价不同程度脑代谢、脑血流损害的参考标准
Table 1. Reference standards about evaluating different degrees of damaged cerebral glucose metabolism and cerebral blood flow
损害程度 脑代谢减低率(%) 脑血流减低率(%) 轻度受损 10~14 8~12 中度受损 15~24 13~20 重度受损 ≥25 ≥21 表 2 轻度、中度和重度脑代谢-脑血流减低灶各项指标的比较(x±s)
Table 2. Comparison of each index in mild, moderate and severe cerebral glucose metabolism and cerebral blood flow decrease foci(x±s)
受损程度 病灶数 脑代谢值 脑血流值 脑代谢减低率(%) 脑血流减低率(%) 轻度受损 27 0.98±0.07 0.88±0.08 9.78±2.56 8.89±2.31 中度受损 15 0.96±0.12 0.83±0.07 17.07±2.09 16.00±2.17 重度受损 24 0.64±0.19 0.62±0.20 42.00±14.61 39.21±16.03 χ2值 38.192 28.170 56.854 56.800 P值 <0.01 <0.01 <0.01 <0.01 -
[1] 中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010[J].中国全科医学, 2011, 14(35): 4013-4017. doi: 10.3969/j.issn.1007-9572.2011.35.004
[2] 饶明俐. 《中国脑血管病防治指南》摘要(三)[J].中风与神经疾病杂志, 2006, 23(1): 4-8. doi: 10.3969/j.issn.1003-2754.2006.01.001
[3] North American Symptomatic Carotid Endarterectomy Trial(NASCET) Steering Committee. North American Symptomatic Carotid Endarterectomy Trial. Methods, patient characteristics, and progress[J]. Stroke, 1991, 22(6): 711-720. [4] Ferguson GG, Eliasziw M, Barr HW, et al. The North American Symptomatic Carotid Endarterectomy Trial: surgical results in 1415 patients[J]. Stroke, 1999, 30(9): 1751-1758. doi: 10.1161/01.STR.30.9.1751 [5] 唐刚华.短半衰期正电子发射放射性药物合成方法学及进展[J].核技术, 2003, 26(7): 551-555. doi: 10.3321/j.issn:0253-3219.2003.07.014
[6] 王曼, 马云川, 吉训明, 等.脑代谢-脑血流同期显像在缺血性脑血管病的影像特征与类型[J].首都医科大学学报, 2013, 34(1): 43-48. doi: 10.3969/j.issn.1006-7795.2013.01.008
[7] 王红艳, 马云川, 李德鹏, 等. 18F-FDG PET显像在胰腺癌诊断中的应用[J].首都医科大学学报, 2008, 29(1): 42-44. doi: 10.3969/j.issn.1006-7795.2008.01.012
[8] Dirnagl U, Iadecola C, Moskowitz MA. Pathobiology of ischaemic stroke: an integrated view[J]. Trends Neurosci, 1999, 22(9): 391-397. doi: 10.1016/S0166-2236(99)01401-0 [9] Kim JJ, Fischbein NJ, Lu Y, et al. Regional angiographic grading system for collateral flow: correlation with cerebral infarction in patients with middle cerebral artery occlusion[J]. Stroke, 2004, 35(6): 1340-1344. [10] 方向华, 王淳秀, 梅利平, 等.脑卒中流行病学研究进展[J].中华流行病学杂志, 2011, 32(9): 847-853. doi: 10.3760/cma.j.issn.0254-6450.2011.09.001
[11] Feigin VL, Lawes CM, Bennett DA, et al. Worldwide stroke incidence and early case fatality reported in 56 population-based studies: a systematic review[J]. Lancet Neurol, 2009, 8(4): 355-369. doi: 10.1016/S1474-4422(09)70025-0 [12] 李坤成.缺血性脑卒中的影像学研究[J].中国医学影像技术, 2009, 25(2): 322-325. doi: 10.3321/j.issn:1003-3289.2009.02.046
[13] You DL, Shieh FY, Tzen KY, et al. Cerebral perfusion SPECT in transient ischemic attack[J]. Eur J Radiol, 2000, 34(1): 48-51. [14] 孙波, 王忠诚.交叉性小脑功能联系障碍SPECT研究[J].中华神经外科杂志, 1994, 10(5): 275-277. doi: 10.3760/j.issn:1001-2346.1994.05.008
[15] 赵军, 林祥通. PET在神经系统疾病中的应用[J].中国临床神经科学, 2001, 9(3): 304-309. doi: 10.3969/j.issn.1008-0678.2001.03.037
[16] Ogasawara K, Ogawa A, Yoshimoto T. Cerebrovascular reactivity to acetazolamide and outcome in patients with symptomatic internal carotid or middle cerebral artery occlusion: a xenon-133 single-photon emission computed tomography study[J]. Stroke, 2002, 33(7): 1857-1862. doi: 10.1161/01.STR.0000019511.81583.A8 [17] Klijn CJ, Kappelle LJ, van Huffelen AC, et al. Recurrent ischemia in symptomatic carotid occlusion: prognostic value of hemodynamic factors[J]. Neurology, 2000, 55(12): 1806-1812. doi: 10.1212/WNL.55.12.1806 -





 下载:
下载: