-
肺癌是临床最常见的恶性肿瘤,患者发病后常伴发多种精神情感障碍症状,如恐惧、焦虑、抑郁等[1]。应用PET研究恶性肿瘤患者脑代谢的改变规律有助于揭示恶性肿瘤患者精神异常的发生特点和产生机制。早期的部分研究已显示,恶性肿瘤患者存在广泛的脑代谢异常[2],少数分类研究也已显示了不同类型肿瘤患者脑代谢改变的差异性[3-4],但对肺部恶性肿瘤脑代谢改变特点尤其是组织学分型相关性研究国内外尚未见报道。本研究通过对100例原发性肺癌患者大脑静息18F-FDG PET代谢显像资料的回顾性分析,初步探讨肺癌患者脑代谢改变特点及其与组织学类型的关系,揭示肺癌患者精神情感障碍的产生基础,并为临床诊治提供客观的分子学依据和可能的评价指标。
-
收集2012年2月至2013年4月在我院行全身PET/CT检查且已明确组织学分型的原发性肺癌患者。纳入标准:①经穿刺活检或手术病理证实为原发性肺癌且未经治疗;②患者无脑转移瘤和其他脑部疾患影像学表现;③患者无脑血管意外、癫痫、脑外伤及脑部手术史,无甲亢、糖尿病等代谢性疾病史,患者及家属无精神疾病史。最终有100例患者满足上述所有标准被纳入本组研究对象。PET检查前空腹血糖低于6.1 mmol/L。根据组织学检查结果,将100例患者分为3组:腺癌组42例[男性30例、女性12例,平均年龄(54.9±12.2)岁]、鳞癌组37例[男性27例、女性10例,平均年龄(55.2±11.4)岁]、小细胞肺癌组21例[男性15例、女性6例,平均年龄(55.2±13.1)岁]。选取50名在本院行全身PET/CT健康体检无阳性发现且无上述疾病病史者作为对照组,其中男性37例、女性13例,平均年龄(55.0±12.4)岁,患者组和对照组的性别构成及年龄分布差异均无统计学意义。
所有患者在检查前均签署了知情同意书。
-
显像设备为美国GE DiscoveryTM VCT PET/CT仪,18F-FDG由医用回旋加速器GE Minitrace和FDG(由北京派特公司提供)自动合成装置合成,放化纯度>95%。
检查前,受试者禁食6 h以上,指尖采血验血糖;静脉注射18F-FDG,剂量为5.55 MBq/kg。在安静环境下闭目休息40~50 min后进行显像;显像时将头部固定于相同位置,采用先发射、后透射方式进行采集;首先进行体部二维采集,体部采集完成后再进行头部三维采集。采集时间共30 min,其中头颅采集10 min。脑部PET/CT扫描参数:电压120 kV,电流240 mA,层厚5 mm。采集计数用迭代法重建,分别获得横断面、矢状面和冠状面图像。
-
在Matalab 7.2平台上应用统计参数地形图(statistical parametric mapping,SPM8)[5]先将PET图像转换为Analyze7图像数据格式,然后对图像进行位置校正及归一化处理,使之与Talairach脑图谱的空间坐标对应,使用2倍于图像空间分辨率的卷积核(8 mm×8 mm×8 mm)对图像进行高斯平滑处理,得到矩阵128×128、体素大小为2 mm×2 mm×2 mm的目标图像。最后进行图像的统计学处理,分别将腺癌组、鳞癌组、小细胞肺癌组患者脑18F-FDG PET图像与对照组图像进行体素对体素的两样本t检验,选取P < 0.05[5],得到各自的脑代谢差异分布图。借助SPM8中的插件xjview8对存在统计学差异的脑区进行立体定位分析和体素数定量分析,计算代谢降低或升高的相关脑区各自所占的体素数(体素是数位资料于三维空间分割上的最小单位,1个体素数等于2 mm×2 mm×2 mm体积,可用于评估所研究区域的大小),应用SPSS17.0统计分析软件对3组患者所涉及的代谢异常脑区的体素数进行两样本t检验,以分析结果的差异性。
-
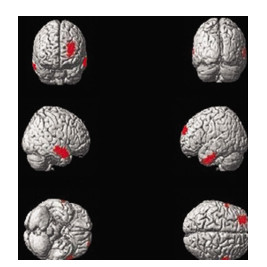
腺癌组、鳞癌组和小细胞肺癌组患者脑18F-FDG PET图像与对照组比较,静息状态下肺癌患者脑葡萄糖代谢改变均以降低为主。腺癌患者脑代谢降低区域共计1436个体素数,主要涉及双侧颞叶和左侧额叶,详细分布区见表 1和图 1;鳞癌患者脑代谢降低区域共计1397个体素数,详细分布区见表 2和图 2;小细胞肺癌患者脑代谢降低区域共计3848个体素数,除额颞叶外还可见右侧顶下小叶及右侧海马区周围代谢降低,详细分布区见表 3和图 3。统计学对比显示,小细胞肺癌组低代谢脑区面积(体素数3848)分别大于腺癌组(体素数1436)(t=14.33,P < 0.05)和鳞癌组(体素数1397)(t=10.07,P < 0.05),腺癌组和鳞癌组低代谢脑区体素数差异无统计学意义(t=0.764,P>0.05)。
脑功能区 Brodmann区 Talairach坐标 体素数 t值 P值 X Y Z 左侧颞中下回 20,21 -52 -31 -18 391 5.23 < 0.05 右侧颞上中回 21,22,42 58 -46 -16 532 6.41 < 0.05 左侧额上中回 6,8,9 -42 28 38 513 6.41 < 0.05 注:表中,Brodmann区表示相应的激活区在全脑的Brodmann分区上所处的区域。 表 1 腺癌组患者相对于正常对照组脑内代谢减低的区域分布
Table 1. Positions of the reduced glucose metabolism cerebral regions in patients with adenocarcinoma
脑功能区 Brodmann区 Talairach坐标 体素数 t值 P值 X Y Z 左侧颞中下回 20,21 -46 -26 -8 406 5.62 < 0.05 右侧颞上中回 21,22,42 39 -42 -126 482 6.33 < 0.05 左侧额上中回 6,8,9 -48 32 22 509 6.85 < 0.05 注:表中,Brodmann区表示相应的激活区在全脑的Brodmann分区上所处的区域。 表 2 鳞癌组患者相对于正常对照组脑内代谢减低的区域分布
Table 2. Positions of the reduced glucose metabolism cerebral regions in patients with squamous cell carcinoma
脑功能区 Brodmann区 Talairach坐标 体素数 t值 P值 X Y Z 左侧颞上、中、下回 20,21,22 -46 -32 -8 1014 5.52 < 0.05 右侧颞上中回、顶下小叶 21,22,39 48 -20 -12 1324 5.34 < 0.05 左侧额上中回 6,8,9 -42 30 36 1257 5.88 < 0.05 海马、尾状核(右) 30 37 -20 -15 253 6.75 < 0.05 注:表中,Brodmann区表示相应的激活区在全脑的Brodmann分区上所处的区域。 表 3 小细胞肺癌组患者相对于正常对照组脑内代谢减低的区域分布
Table 3. Positions of the reduced glucose metabolism cerebral regions in patients with small-cell lung carcinoma

图 1 腺癌组患者相对于正常对照组脑内代谢减低区图(红色区域)
Figure 1. Compared with the control group, the cerebral regions of reduced brain glucose metabolism(red areas) in the patient with lung adenocarcinoma
-
世界卫生组织已将肿瘤明确划分为一种社会心理性疾病。抑郁症患者易发生恶性肿瘤,恶性肿瘤患者易合并抑郁症[1]。Kumano等[6]研究认为,控制了几种已知的外界环境和生物危险因素后,抑郁症状是使各种肿瘤患者生存时间缩短的一致性心理预测因素。故及时发现、评估和治疗恶性肿瘤患者精神情感障碍具有重要的临床意义,这或将成为肿瘤综合治疗体系中不可或缺的重要组成部分。对于恶性肿瘤患者抑郁的产生机制和分子学基础目前了解尚少,也是近些年医学界的研究热点。Tashiro等[2]最早使用PET研究无脑部疾患的体部恶性肿瘤患者的脑血流和脑代谢改变,发现肿瘤患者存在局部脑血流量下降及边缘系统和边缘旁结构的代谢降低。此后国内外学者[7-10]相继开始应用PET研究恶性肿瘤患者的脑葡萄糖代谢改变,也均显示了脑岛、前额叶、颞叶及扣带回等多个涉及精神情感脑区的代谢降低。恶性肿瘤患者脑部代谢虽存在共性,但不同种类肿瘤对于患者精神状态的影响并不相同,其脑部代谢也应存在差异,分类研究不同组织学类型肿瘤患者脑代谢改变的特点将更有利于患者精神情感障碍发作特点的解释及对患者采取个性化预防和治疗,也可为肿瘤患者抑郁症发病机制的研究奠定基础。
本研究对鳞癌、腺癌和小细胞肺癌3组肺癌患者的研究结果显示,3组患者均以区域性脑代谢降低为主要改变,未见代谢升高脑区,代谢降低区主要分布在左侧额叶上中回、左侧颞叶上、中、下回及右侧颞叶上中回。但3组结果在脑代谢降低程度和范围方面存在一定差异。这些与以往其他体部肿瘤的脑代谢显像研究结果相似但又不完全相同。总结本研究肺癌患者脑静息态葡萄糖代谢改变特点,主要有以下两方面:①所有患者受累脑区均主要集中在右侧额叶和双侧颞叶,除在小细胞肺癌组检测到右侧顶下小叶及海马区代谢降低外,未观察到以往文献[2, 4, 7-9]中报道的脑岛、扣带回、基底节、杏仁核等区域的代谢异常。分析其原因,笔者认为,肿瘤患者脑代谢改变可能与肿瘤类型、病程、分期、治疗以及检查所用设备等多种因素有关。本组研究对象均为尚未接受治疗的初诊肺癌患者,病程相对较短,分期也相对较早,故代谢异常程度可能较轻,累及部位相对也较局限。此外以往各研究对以上因素的控制不完全相同,因此肿瘤患者脑代谢改变既存在共性也存在差异性。②肺癌患者脑代谢改变的分布范围及代谢异常程度与其组织学类型存在一定相关性。小细胞肺癌组患者脑代谢降低累及范围均较腺癌组和鳞癌组广泛,且受累脑区代谢降低程度也明显大于腺癌和鳞癌。造成小细胞肺癌以上脑代谢特点的原因同样可能是多方面的[11-12],这其中可能包括肿瘤生物学特性、病程、分期、治疗经过及社会学和心理学因素等,本研究已对病程和治疗等进行了控制,但暂未控制社会学和心理学等因素,现笔者谨从肿瘤的生物学特性方面对小细胞肺癌患者脑代谢改变特点作一分析:①可能与小细胞肺癌恶性程度和生长方式相关。小细胞肺癌恶性程度通常较鳞癌和腺癌更高,相比于鳞癌和腺癌,其发现早期即易侵犯淋巴管和血管而发生肺门、纵隔淋巴结转移和肺外转移。以往已有研究显示,肿瘤分期越晚,相应脑区功能损害也越严重,这也与临床上肿瘤的恶性程度、患者负性情绪严重程度呈正相关相一致[13]。②可能与小细胞肺癌的神经内分泌功能相关。丘脑-垂体-肾上腺轴功能亢进是人们认识较早的抑郁症的生物学特性,主要为下丘脑促肾上腺皮质激素释放素分泌增多,导致垂体促肾上腺皮质激素分泌增多,进而刺激肾上腺皮质醇分泌增多,使血浆和尿游离皮质醇浓度增高,血浆皮质醇增高可导致中枢5-羟色胺和去甲肾上腺素合成和分泌减少[14]。目前已知5-羟色胺和去甲肾上腺素降低与抑郁症发病密切相关。小细胞肺癌正是异位分泌促肾上腺皮质激素的神经内分泌肿瘤中最主要的一种,推理其可通过丘脑-垂体-肾上腺轴的调节机制加重对脑功能的损伤,这也与具有内分泌功能的胰腺癌代谢异常较其他体部肿瘤更加广泛的研究结果相似[4]。本研究中,海马区在小细胞肺癌患者中更易受累可能也与该机制相关,海马区内有大量的糖皮质激素受体,皮质醇水平的升高可导致海马神经元死亡。海马区与机体的高级精神活动有关,其与脑部近30%脑区存在功能联络[15]。许多神经影像学研究也证实,肿瘤患者和抑郁症患者均存在海马体积萎缩和功能减退[16],但其代谢改变尚未见报道。
本研究初步揭示了不同组织学分型肺癌患者脑静息葡萄糖代谢的特点及存在差异。3组不同组织学类型肺癌患者脑代谢显像均显示涉及精神情感功能区的脑代谢降低,说明任何类型肺癌患者均有发生抑郁或精神情感障碍的风险;而不同类型肺癌脑代谢降低程度和范围的差异,则说明肺癌对脑功能的损伤程度可能与其组织学类型具有一定相关性。由此可见,PET脑代谢显像可反映肺癌患者脑损伤的改变特点及复杂精神心理状况,有助于临床及时发现患者的神经心理异常,为患者提供必要的心理干预和治疗,提高患者生存质量、改善肿瘤治疗效果。PET更可为临床肺癌患者出现的精神情感障碍症状提供客观的分子影像学依据和可能的评价指标,为肺癌患者产生脑代谢改变的真正生理机制研究奠定一定基础。今后的研究尚需进一步扩大样本量、通过控制不同的影响因素限定更加严格的分组入选标准,以对肺癌患者脑代谢规律进行更加科学而系统的研究,并与患者临床症状相结合,设计一些应用精神量表评分及相关激素水平测定的前瞻性研究,从而对肺癌患者脑代谢改变特点及其分子生物学机制进行更加深入的探讨。
不同组织学类型肺癌患者大脑静息葡萄糖代谢改变研究
The preliminary study of brain glucose metabolism changes in patients with lung cancer of different histological types
-
摘要:
目的 探讨不同组织学类型肺癌患者大脑静息葡萄糖代谢改变特点。 方法 回顾性分析100例未经治疗的原发性肺癌患者全身18F-FDG PET/CT检查资料。肺癌组织学类型均经穿刺或手术病理明确,根据不同组织学类型将患者分为腺癌(42例)、鳞癌(37例)、小细胞肺癌(21例)3组。将50名健康体检者作为对照,采用统计参数地形图分析软件分析每组患者PET脑代谢显像资料,采用两样本t检验比较3组患者脑代谢改变的差异。 结果 3组患者脑PET显像均表现为区域性大脑静息葡萄糖代谢降低,主要分布在左侧额叶上中回及双侧颞叶上、中、下回,小细胞肺癌组还可见右侧顶下小叶及海马区受累。小细胞肺癌组低代谢脑区面积(体素数3848)大于腺癌组(体素数1436)(t=14.33,P < 0.05)和鳞癌组(体素数1397)(t=10.07,P < 0.05),腺癌组与鳞癌组之间差异无统计学意义(t=0.764,P>0.05)。 结论 肺癌患者大脑静息葡萄糖代谢改变与其组织学类型有一定相关性。脑代谢降低区多涉及精神情感功能区,PET脑显像有望为肺癌患者出现的精神情感障碍症状提供客观的分子影像学依据和可能的评价指标。 -
关键词:
- 肺肿瘤 /
- 脑葡萄糖代谢 /
- 正电子发射断层显像术 /
- 体层摄影术,X线计算机 /
- 氟脱氧葡萄糖F18
Abstract:Objective To investigate the changes of resting brain glucose metabolism in patients with lung cancer of different histological types. Methods One hundred patients with primary untreated lung cancer were divided into three groups[adenocarcinoma group(42 cases), squamous cell carcinoma group(37 cases)and small-cell carcinoma group(21 cases)] based on histological types confirmed by biopsy or surgical pathology. Their whole body 18F-FDG PET/CT were retrospectively studied. The brain PET data of three groups were analyzed individually using statistical parametric mapping, with 50 healthy controls as comparison. Results The brain PET imaging in all of three lung cancer groups showed relative reduction in the regional cerebral resting glucose metabolism, and mainly distributed in left superior and middle frontal gyrus and the inferior, middle and superior frontal gyrus bilateral frontal lobe. Besides, the hypometabolic brain areas were also detected in the right inferior parietal lobule and hippocampal in the small cell carcinoma group. The total hypometabolic brain area in the small cell lung cancer group(voxel values 3848)was greater than those in the adenocarcinoma(voxel values 1436)(t=14.33, P < 0.05)and the squamous cell carcinoma groups(voxel values 1397)(t=10.07, P < 0.05) respectively, and there was no statistical difference with respect to the areas between the later two groups(t=0.764, P>0.05). Conclusions The resting brain glucose metabolic changes in lung cancer patients may be correlated to their histological types of lung cancer. The reduced metabolic regions in lung cancer patients involved in some functional regions related to the mood disorders. The brain metabolic changes hopefully provide molecular imaging basis and evaluation indicator for lung cancer patients with affective disorders. -
表 1 腺癌组患者相对于正常对照组脑内代谢减低的区域分布
Table 1. Positions of the reduced glucose metabolism cerebral regions in patients with adenocarcinoma
脑功能区 Brodmann区 Talairach坐标 体素数 t值 P值 X Y Z 左侧颞中下回 20,21 -52 -31 -18 391 5.23 < 0.05 右侧颞上中回 21,22,42 58 -46 -16 532 6.41 < 0.05 左侧额上中回 6,8,9 -42 28 38 513 6.41 < 0.05 注:表中,Brodmann区表示相应的激活区在全脑的Brodmann分区上所处的区域。 表 2 鳞癌组患者相对于正常对照组脑内代谢减低的区域分布
Table 2. Positions of the reduced glucose metabolism cerebral regions in patients with squamous cell carcinoma
脑功能区 Brodmann区 Talairach坐标 体素数 t值 P值 X Y Z 左侧颞中下回 20,21 -46 -26 -8 406 5.62 < 0.05 右侧颞上中回 21,22,42 39 -42 -126 482 6.33 < 0.05 左侧额上中回 6,8,9 -48 32 22 509 6.85 < 0.05 注:表中,Brodmann区表示相应的激活区在全脑的Brodmann分区上所处的区域。 表 3 小细胞肺癌组患者相对于正常对照组脑内代谢减低的区域分布
Table 3. Positions of the reduced glucose metabolism cerebral regions in patients with small-cell lung carcinoma
脑功能区 Brodmann区 Talairach坐标 体素数 t值 P值 X Y Z 左侧颞上、中、下回 20,21,22 -46 -32 -8 1014 5.52 < 0.05 右侧颞上中回、顶下小叶 21,22,39 48 -20 -12 1324 5.34 < 0.05 左侧额上中回 6,8,9 -42 30 36 1257 5.88 < 0.05 海马、尾状核(右) 30 37 -20 -15 253 6.75 < 0.05 注:表中,Brodmann区表示相应的激活区在全脑的Brodmann分区上所处的区域。 -
[1] Pirl WF, Traeger L, Greer JA, et al. Depression, survival, and epidermal growth factor receptor genotypes in patients with metastatic non-small cell lung cancer[J]. Palliat Support Care, 2013, 11(3): 223-229. doi: 10.1017/S1478951512001071 [2] Tashiro M, Kubota K, Itoh M, et al. Regional cerebral glucose metabolism of patients with malignant diseases in different clinical phases[J]. Med Sci Monit, 2001, 7(2): 226-232. [3] Hsieh TC, Wu YC, Yen KY. Early changes in brain FDG metabolism during anticancer therapy in patients with pharyngeal cancer[J]. J Neuroimaging, 2013, 23(1): 156-173. [4] 倪建明, 张追阳, 黄钢.体部恶性肿瘤静息脑葡萄糖代谢改变与肿瘤类型的关系[J].临床放射学杂志, 2012, 31(5): 627-631.
[5] 黄钢, 左传涛.客观认识统计参数地形图评价脑功能影响的作用[J].中华核医学杂志, 2008, 28(1): 1-2.
[6] Kumano H, Ida I, Oshima A, et al. Brain metabolic changes associated with predispotion to onset of major depressive disorder and adjustment disorder in cancer patients_a preliminary PET study[J]. J Psychiatric Res, 2007, 41(7): 591-599. doi: 10.1016/j.jpsychires.2006.03.006 [7] 苏亮, 左传涛, 管一晖, 等. 18F-FDG PET脑显像用于恶性肿瘤患者抑郁分析[J].中华核医学杂志, 2005, 25(3): 159-161.
[8] Kim LS, Hwang HS, Jon DI, et al. Dysfunction of the neural network associated with sustained attention in cancer patients with clinically significant depressive symptoms[J]. Neurosci Lett, 2008, 447(1): 1-6. [9] Fujimoto T, Takeuchi K, Matsumoto T, et al. Metabolic changes in the brain of patients with late-onset major depression[J]. Psychiatry Res, 2008, 164(1): 48-57. [10] 于璟, 唐一源. SPECT在抑郁症研究中的应用[J].国际放射医学核医学杂志, 2007, 31(1): 13-16.
[11] Vos MS, Putter H, van Houwelingen HC, et al. Denial and social and emotional outcomes in lung cancer patients: the protective effect of denial[J]. Lung Cancer, 2011, 72(1): 119-124. [12] Shimizu K, Nakaya N, Saito-Nakaya K, et al. Clinical biopsychosocial risk factors for depression in lung cancer patients: a comprehensive analysis using data from the Lung Cancer Database Project[J]. Ann Oncol, 2012, 23(8): 1973-1979. doi: 10.1093/annonc/mds061 [13] 林盟菲, 黄钢, 孙晓光, 等.肺癌患者的脑代谢改变与分期的关系[J].中国临床医学, 2009, 16(4): 516-518.
[14] O′Keane V, Frodl T, Dinan TG. A review of Atypical depression in relation to the course of depression and changes in HPA axis organization[J]. Psychoneuroendocrinology, 2013, 37(10): 1589-1599. [15] 张剑戈, 张方, 黄喆憨, 等.海马区脑功能连接网络随年龄变化的研究[J].中华核医学杂志, 2009, 29(6): 391-394.
[16] Kratzer S, Mattusch C, Metzger MW. Activation of CRH receptor type 1 expressed on glutamatergic neurons increases excitability of CA1 pyramidal neurons by the modulation of voltage-gated ion channels[J]. Front Cell Neurosci, 2013, 91(7): 10-33. -





 下载:
下载: