-
B细胞易位基因2(B-cell translocation gene 2,BTG2)是细胞增殖抑制蛋白TOB/BTG家族的成员之一,在细胞分化、发育、凋亡等细胞生物学功能的调节中发挥着重要的作用[1]。包括苏州大学医学部放射医学与防护学院肿瘤放射生物学实验室在内的国内外多项研究发现,BTG2的表达水平改变也会影响到肿瘤细胞的生长、凋亡、转移和放射敏感性[2-10]。在癌症患者的治疗过程中,约70%的患者需要接受放射治疗,放射治疗是恶性肿瘤患者不可缺少的重要治疗手段。肿瘤的放射治疗效果与肿瘤的敏感性有着密切的关系。本研究旨在了解电离辐射对肿瘤细胞中BTG2的表达水平以及蛋白稳定性的影响,从而确定BTG2作为一种新的辐射损伤诱导基因,为其作为一种临床肿瘤放射治疗疗效预测和预后评价新指标提供实验基础和理论依据。
-
人乳腺癌细胞系MCF-7、MDA-MB-231,以及人宫颈癌细胞系C33A、HeLa购自美国细胞收藏中心,由本实验室培养和保存。乳腺癌和宫颈癌细胞采用含10%胎牛血清的D-MEM(Dulbecco′s modified eagle medium)培养液(美国Gibco公司)常规培养。所有细胞都培养于37 ℃、5% CO2培养箱内。
-
收集指数期生长的细胞,采用137Cs γ射线照射(照射源由美国Georgetown大学辐照中心提供),吸收剂量率为0.8 Gy/min,源靶距为73.5 cm,照射视野为30 cm×30 cm。
-
将收集的细胞样品加裂解液于冰上裂解,离心10 min(10 000 r/min,离心半径为8.3 cm),取上清液,采用二喹啉甲酸法蛋白定量试剂盒(美国Invitrogen公司)调整蛋白至相同浓度。样品加入等体积2×十二烷基硫酸钠凝胶加样缓冲液,沸水中煮5 min,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转膜;封闭液封闭2 h;加用封闭液稀释的BTG2(sc-30342,1:250稀释)和抗β-Actin(sc-32252,1:2000稀释)抗体(美国Santa Cruz生物技术公司),4 ℃孵育过夜;用tris-buffered saline and tween 20缓冲液(TBST缓冲液)冲洗3次,每次15 min;加封闭液稀释相应的山羊抗鼠(sc-2060,1:2000稀释)或山羊抗兔(sc-2004,1:2000稀释)的二抗(美国Santa Cruz生物技术公司),室温孵育1 h,TBST缓冲液冲洗3次,每次15 min;用增强化学发光法检测蛋白表达水平。
-
乳腺癌细胞中BTG2 mRNA水平的检测方法如下:各取1×106的不同乳腺癌细胞,按照Trizol RNA提取试剂盒(美国Invitrogen公司)说明提取细胞总RNA。取6 μg总RNA与0.5 μg oligo(dT)15混合,逆转录获得cDNA。以其作为模板,PCR扩增BTG2中一长度为530 bp的片段。所用的BTG2上游引物为5′-GAA TTC ATG AGC CAC GGG AAG GGA-3′,下游引物为5′-GAT ATC GAT CGA CCT CTG ACG GTA GT-3′。具体反应步骤为:94 ℃灭活及预变性2 min;再经94 ℃ 90 s,57 ℃ 60 s,72 ℃ 90 s,反应34个循环;72 ℃延伸10 min。以人β-Actin作为内对照,其上游引物为5′-CTG GAA CGG TGA AGG TGA CA-3′,下游引物为5′-AAG GGA CTT CCT GTA ACA ATG CA-3′,长度为420 bp。将扩增产物进行1.5 g/L琼脂糖凝胶电泳,以各自β-Actin作为内对照调整上样量,电泳图像经美国Bio-rad公司Fluors MultiImager凝胶成像扫描仪分析,比较乳腺癌细胞中BTG2 mRNA的相对表达量。
-
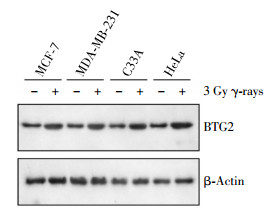
采用Western blot方法检测了人类乳腺癌细胞系MCF-7和MDA-MB-231以及人类宫颈癌细胞系C33A和HeLa受到3 Gy γ射线单次剂量照射后24 h BTG2蛋白表达水平的改变。如图 1所示,虽然在诱导的程度上有所差异,但是3 Gy单次剂量照射明显地提高了所有检测的肿瘤细胞中的BTG2蛋白水平。实验结果表明,BTG2可能是一种辐射损伤可诱导的蛋白。

图 1 3 Gy γ射线单次剂量照射对4种人肿瘤细胞的BTG2蛋白表达水平的影响图中,BTG2为B细胞易位基因2。
Figure 1. BTG2 expression in four different human cancer cells by once 3 Gy γ-ray irradiation
给予MCF-7和MDA-MB-231两种乳腺癌细胞0~5 Gy不同剂量照射,照射后24 h收样,并检测细胞中BTG2蛋白表达水平的改变。如图 2所示,辐射诱导的BTG2蛋白表达水平随着照射剂量的增加而升高,而且1 Gy剂量照射就可以导致BTG2蛋白表达量的增加。与3 Gy照射后BTG2蛋白增加的量相比,4和5 Gy照射诱导的量并没有更显著地增加。这些结果表明辐射诱导的BTG2蛋白增加量为剂量依赖性的,且可能有一饱和平台,这也就是说,BTG2蛋白表达量并不能随着辐射剂量的增加而无限量地增加。

图 2 不同剂量γ射线照射对人乳腺癌细胞中BTG2蛋白表达水平的剂量依赖性的影响图中,BTG2为B细胞易位基因2。
Figure 2. Dose dependent influence of BTG2 expression level in human breast cancer cells irradiated by different dose of γ-rays
为了论证BTG2基因的改变,本实验在检测BTG2蛋白的同时,也采用RT-PCR方法检测了不同剂量照射后24 h,MCF-7和MDA-MB-231细胞中BTG2 mRNA表达的改变。如图 3所示,辐射除了增加BTG2蛋白表达量外,也可以导致BTG2 mRNA水平的明显升高。而且,这种辐照导致的BTG2 mRNA水平的提高也是随着照射剂量的增加而增加。另外,与3 Gy照射后BTG2 mRNA增加的量相比,4和5 Gy照射诱导的mRNA水平并没有更显著地提高,这些结果表明,与蛋白表达情况一致,辐射诱导的BTG2 mRNA增加量的改变表现为剂量依赖性的,但BTG2 mRNA也并不能随着辐射剂量的增加而无限量地增加。

图 3 不同剂量γ射线照射对人乳腺癌细胞中BTG2 mRNA水平的剂量依赖性的影响图中,BTG2为B细胞易位基因2。
Figure 3. Dose dependent influence of BTG2 mRNA level in human breast cancer cells irradiated by different dose of γ-rays
采用3 Gy剂量单次照射细胞后在不同时间内采样,测定了BTG2 mRNA和蛋白水平随着照射后时间的改变而变化的情况。如图 4所示,3 Gy剂量单次照射后2 h,人乳腺癌MCF-7和MDA-MB-231细胞中的BTG2的蛋白水平发生了明显的改变,而且随着时间的延长表达量也不断地增加,其中,MCF-7细胞中BTG2蛋白水平在16 h时达到饱和量,而MDA-MB-231细胞中BTG2蛋白水平在4 h时已显著升高。与16 h时BTG2蛋白表达量相比,24 h时BTG2表达量并没有更进一步地增加。与蛋白变化实验结果相似,3 Gy剂量单次照射后1 h,人乳腺癌MCF-7细胞就可以见到时间依赖性的BTG2 mRNA水平的改变,6 h时BTG2 mRNA水平明显升高,24 h时达到最高(图 5)。这些实验结果清楚地表明辐射导致的BTG2表达是具有时间依赖性的。
-
采用高剂量电离辐射的放射治疗是包括乳腺癌和宫颈癌在内的许多类型肿瘤的重要治疗手段之一,而其中电离辐射诱导基因的研究及其在放射治疗敏感性调节中的作用一直是肿瘤放射治疗的热门研究课题。希望通过对这些辐射诱导基因的深入研究为临床提高放射治疗的疗效和预后评价提供重要的诊断指标。
BTG2蛋白又称为PC3,在1991年首次作为神经生长因子诱导的瞬时早期反应蛋白而被报道[11],后经深入研究发现其具有细胞增殖抑制蛋白家族TOB/BTG的共性——抗细胞增殖功能。BTG2基因位于人类染色体的1q32区,mRNA的长度为2717 bp,编码一个由158个氨基酸组成的蛋白质[1]。虽然目前还未发现在肿瘤中含有BTG2畸变,但来自包括本实验室在内的国内外的研究结果表明,BTG2在包括肿瘤细胞在内的细胞分化、抑制细胞增殖、诱导细胞凋亡、增加放射敏感性等方面都具有重要功能[2-10]。本实验室以前的研究揭示,提高BTG2的表达可以明显增加乳腺癌细胞的放射敏感性,而且BTG2的放射敏感性的调节是与一种DNA损伤修复蛋白——乳腺癌易感基因1蛋白的表达水平密切相关的[9-10]。本研究发现γ射线照射可以明显提高不同肿瘤细胞中BTG2的表达水平(图 1),而且这种辐照诱导的BTG2增加不仅表现在mRNA水平上(图 3和图 5),也表现在蛋白表达水平上(图 2和图 4)。另外,这种BTG2的增加是与辐射剂量(图 2和图 3)和照射后的时间(图 4和图 5)成正比的,即显现出一种与照射剂量和时间的依赖关系。
已知p53是BTG2转录活性调节蛋白,因为BTG2的启动子中含有一种野生型p53反应元件。p53辐照诱导的BTG2表达水平的增加可以发生在乳腺癌细胞MCF-7和宫颈癌细胞C33A(2种p53基因野生型细胞系)以及乳腺癌细胞MDA-MB-231和宫颈癌细胞HeLa(2种p53功能失活型的细胞系)中。这些结果表明,虽然p53是BTG2转录活性的重要调节蛋白,但是辐照诱导的BTG2表达水平的改变可能存在与p53基因以及肿瘤细胞类型非依赖性的关系。另外这一实验结果在临床肿瘤放射治疗上可能具有一定的意义,因为70%以上的中晚期乳腺癌患者的肿瘤细胞都发生了p53基因畸变,变得对放射治疗不敏感。而大部分的宫颈癌的发生和发展与人类乳头状病毒感染有关,人类乳头状病毒感染导致p53基因功能的失活,从而导致宫颈癌细胞对放射治疗不敏感和耐辐射。这些研究结果暗示,放射治疗前后的肿瘤细胞中BTG2表达水平的检测可能对肿瘤放射治疗的疗效和预后评价具有一定的意义和临床价值,因此辐射诱导BTG2表达增加的实际作用还有待深入的研究。目前,本实验室正采用p53 siRNA和畸变p53质粒的转染实验进一步论证辐射对BTG2表达水平的调节是否属于p53非依赖性的。
细胞增殖抑制蛋白TOB/BTG家族目前主要包括BTG、BTG2/PC3/TIS21、BTG3/ANA、BTG4/PC3B、TOB1/TOB和TOB2 6个成员[1]。虽然其成员各自具有不同的生物学功能,但它们具有以下共同的功能:调控细胞生长、促进细胞分化成熟,并可能与细胞DNA损伤修复有关。本研究结果也促使我们有兴趣了解TOB/BTG家族其他成员是否也是电离辐射诱导的基因,是否改变肿瘤细胞中这些蛋白的表达水平可以改变放射敏感性和肿瘤放射治疗的疗效。以上问题目前本实验室正在进一步研究中。
总之,本研究结果表明辐射可以明显提高BTG2 mRNA水平和蛋白的表达水平,为深入了解BTG2作为一种新的辐射损伤诱导基因在肿瘤放射治疗中的功能提供了新的研究基础和理论依据。
BTG2作为一种新的电离辐射诱导基因的研究
Study on B-cell translocation gene 2 as a novel radiation-induced gene
-
摘要:
目的 研究γ射线照射对肿瘤细胞的B细胞易位基因2(BTG2)表达水平的影响。 方法 应用RT-PCR方法研究电离辐射对肿瘤细胞BTG2 mRNA水平的影响;应用Western blot方法测定电离辐射对肿瘤细胞BTG2蛋白表达水平的影响。 结果 与未照射对照细胞相比,3 Gy γ射线单次剂量照射明显提高了人乳腺癌细胞系MCF-7、MDA-MB-231和人宫颈癌细胞系C33A、HeLa中的BTG2蛋白的表达水平。γ射线照射人乳腺癌细胞系MCF-7和MDA-MB-231导致了照射剂量和时间依赖性的BTG2表达水平的升高,而且这种改变既表现在BTG2 mRNA水平上,也反映在BTG2蛋白水平上。 结论 BTG2是一种新的辐射诱导DNA损伤的反应基因,进一步研究将为BTG2作为肿瘤放射治疗的疗效和预后评价指标提供实验基础和依据。 Abstract:Objective To investigate the effects of ionizing radiation on the expression of B-cell translocation gene 2(BTG2) in cancer cells. Methods RT-PCR was used to determine the level of BTG2 mRNA, while the expression of BTG2 protein was assayed by Western blot. Results Compared with the un-irradiated cells, a single dose of 3 Gy γ-rays caused a significant increase of BTG2 protein in breast cancer cell lines, MCF-7 and MDA-MB-231, and cervical cancer cell lines, C33A and HeLa. Furthermore, irradiation with γ-rays resulted in a dose and time dependent increase of BTG2 at both mRNA and protein levels. Conclusion The present study demonstrates, for the first time, that BTG2 is a value response gene to exposure of ionizing radiation, which may provide evidence for BTG2 as a novel marker for radiotherapy of cancer. -
Key words:
- Cancer /
- Radiation, ionizing /
- B-cell translocation gene 2
-
-
[1] Winkler GS. The mammalian anti-proliferative BTG/Tob protein family[J]. J Cell Physiol, 2010, 222(1): 66-72. doi: 10.1002/jcp.21919 [2] Zhang YJ, Wei L, Liu M, et al. BTG2 inhibits the proliferation, invasion, and apoptosis of MDA-MB-231 triple-negative breast cancer cells[J]. Tumour Biol, 2013, 34(3): 1605-1613. doi: 10.1007/s13277-013-0691-5 [3] Lim SK, Choi YW, Lim IK, et al. BTG2 suppresses cancer cell migration through inhibition of Src-FAK signaling by downregulation of reactive oxygen species generation in mitochondria[J]. Clin Exp Metastasis, 2012, 29(8): 901-913. doi: 10.1007/s10585-012-9479-z [4] Zhang Z, Chen C, Wang G, et al. Aberrant expression of the p53-inducible antiproliferative gene BTG2 in hepatocellular carcinoma is associated with overexpression of the cell cycle-related proteins[J]. Cell Biochem Biophys, 2011, 61(1): 83-91. [5] Mollerstrom E, Kovacs A, Lovgren K, et al. Up-regulation of cell cycle arrest protein BTG2 correlates with increased overall survival in breast cancer, as detected by immunohistochemistry using tissue microarray[J/OL]. BMC Cancer, 2010, 10: 296[2010-06-16]. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2902444. [6] Li F, Liu J, Park ES, et al. The B cell translocation gene(BTG) family in the rat ovary: hormonal induction, regulation, and impact on cell cycle kinetics[J]. Endocrinology, 2009, 150(8): 3894-3902. doi: 10.1210/en.2008-1650 [7] Cullmann C, Hoppe-Seyler K, Dymalla S, et al. Oncogenic human papillomaviruses block expression of the B-cell translocation gene-2 tumor suppressor gene[J]. Int J Cancer, 2009, 125(9): 2014-2020. doi: 10.1002/ijc.24671 [8] Wagener N, Bulkescher J, Macher-Goeppinger S, et al. Endogenous BTG2 expression stimulates migration of bladder cancer cells and correlates with poor clinical prognosis for bladder cancer patients[J]. Br J Cancer, 2013, 108(4): 973-982. doi: 10.1038/bjc.2012.573 [9] Hu XD, Meng QH, Xu JY, et al. BTG2 is an LXXLL-dependent co-repressor for androgen receptor transcriptional activity[J]. Biochem Biophys Res Commun, 2011, 404(4): 903-909. doi: 10.1016/j.bbrc.2010.12.064 [10] 李敏, 孟庆慧, 胡旭东, 等. BTG2表达水平对肿瘤细胞放射敏感性的影响[J].国际放射医学核医学杂志, 2013, 37(3): 129-134.
[11] Bradbury A, Possenti R, Shooter EM, et al. Molecular cloning of PC3, a putatively secreted protein whose mRNA is induced by nerve growth factor and depolarization. Proc Natl Acad Sci U S A, 1991, 88(8): 3353-3357. doi: 10.1073/pnas.88.8.3353 -





 下载:
下载: