-
肿瘤的治疗是人类一直追求的目标,其中放射治疗是治疗肿瘤的主要手段。据统计,每年有60%以上的肿瘤患者要接受放射治疗。因此,提高肿瘤的放射治疗效果,降低正常组织的辐射剂量,对于肿瘤的放射治疗具有重要的科学意义和实用价值。
高能的γ射线和X射线与物质的主要作用方式包括康普顿散射和光电吸收,而物质的光电吸收与重金属原子的原子序数密切相关。也就是说,原子序数越高,其放射增敏效果越明显。Au的原子序数为79,明显高于临床常使用的I(原子序数为53)及其化合物。然而,离子状态的Au具有较强的活性,其表面容易与体内的各种蛋白相互结合,最终导致较强的毒性。与Au离子相比,Au纳米颗粒具有明显的优势,首先,Au纳米颗粒具有较强的高通透性和滞留效应[(enhanced permeability and retention,EPR)效应],有利于放射治疗;其次,相对于Au离子,Au纳米颗粒的毒性较低;最后,Au纳米颗粒的表面容易修饰,具有更为广泛的医学用途。Au纳米颗粒由于其独特的光学[1-3]和表面化学特性[4-6],以及在光热治疗[7-8]、放射治疗[9-10]和X射线造影剂[11-13]等方面的潜在应用,引起了人们广泛的兴趣。Hainfeld等[11]使用尺寸为1.9 nm的裸Au颗粒,发现小鼠连续照射后其肿瘤体积明显变小,直至消失,而没有辐照的小鼠全部死亡。此后,多个团队也研究发现Au纳米颗粒具有明显的放射增敏作用[11-14]。
然而,纳米材料在生理环境中的形成是个极其复杂的过程。大量研究表明,Au纳米材料的生物学反应与其表面化学[14-16]、尺寸[17-19]和给药方式[20]有关。一方面,我们研究发现,表面化学可以影响Au纳米颗粒在生理环境中的稳定性,从而影响其毒性;裸的Au纳米颗粒在血液中与蛋白作用形成100 nm的聚集体,然后被内皮网状系统吸收到达肝脏和脾脏[21-23]。聚乙二醇(polyethylene glycols,PEG)包裹层通过降低表面电势来提高Au纳米颗粒的稳定性[24]。另一方面,我们发现,小尺寸的Au纳米颗粒具有更强的EPR效应,可以在肿瘤组织中更好地富集,从而达到治疗的效果。
本研究以15 nm的PEG包裹的Au纳米颗粒为材料,从物理学性质、血浆稳定性、体外的细胞活性、体外放射增敏作用等几个方面来研究其生物学反应。
-
PEG-SH购自德国Serva公司,氯金酸(HAuCl4,分析纯)、柠檬酸钠试剂均购于国药集团上海化学试剂有限公司,UV-1750型紫外-可见分光光度计购自岛津仪器(苏州)有限公司,噻唑蓝、PBS购自北京索莱宝科技有限公司,HepG2细胞(人肝癌细胞)由我所提供。
-
将柠檬酸钠(3 ml,6 mg/ml)加到氯金酸溶液(19.7 ml,0.1%)中,在90 ℃的条件下搅拌1 h,即可制得Au纳米颗粒溶液,置于4 ℃备用。然后,取10 mg的PEG-SH室温下加入到Au纳米颗粒的溶液中,反应24 h。随后使用截留分子质量为3000的超滤管超滤,得到PEG包裹的Au纳米颗粒。
-
使用透射电子显微镜(JEM-2100F,日本电子株式会社生产)观测PEG包裹的Au纳米颗粒的形貌和尺寸,工作电压为200 kV。用紫外分光光度计测Au纳米颗粒的紫外吸收光谱,其光谱测量范围为400~800 nm。
-
取0.2 ml PEG包裹的Au纳米颗粒加入到0.8 ml的血浆中,充分均匀搅拌,然后使用紫外-可见分光光度计测量上述溶液分别在0、0.5、1、2、6、12、24 h各时间点的光学吸收谱。
-
在96孔培养板的每孔铺6 000个处于对数期的HepG2细胞,待细胞贴壁后,加入浓度为0~0.25 mmol/L的PEG包裹的Au纳米颗粒,作用24 h和48 h后,加入噻唑蓝继续培养4 h,终止培养后吸去培养液,加入二甲基亚砜溶液,用酶标仪在492 nm波长处测吸光度值,做出Au纳米团簇毒性测试曲线,从而判断Au纳米团簇的细胞毒性范围。
-
在6孔培养板的每孔铺10万个对数期的HepG2细胞,待细胞贴壁后,用含0.05和0.1 mmol/L Au纳米颗粒的培养基替换孔中原有的培养基,24 h后用137Cs进行照射,照射剂量分别为0、1、2、4、6、8 Gy。每个浓度、每个照射剂量设3个平行孔。照射后立即用新鲜培养基替换含Au纳米颗粒的培养基,放置培养箱中进行培养。当6孔板中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加纯甲醇或醋酸甲醇混合液(醋酸:甲醇为1:3)5 ml,固定15 min。然后去掉固定液,加适量Giemsa染色液染10~30 min,用流水缓慢洗去染色液,放置空气中干燥。在显微镜下计数,大于50个细胞为一个克隆,计数克隆数。最后计算克隆形成率。
-
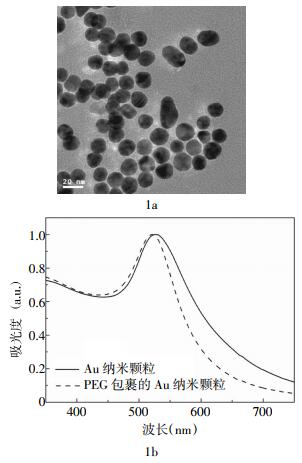
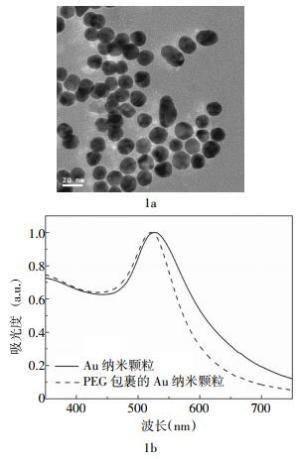
图 1a为PEG包裹的Au纳米颗粒的透射电子显微镜图片,从图中可以看出,PEG包裹的Au纳米颗粒的平均尺寸为15 nm,而且具有较好的单分散性。图 1b是PEG包裹和未包裹的Au纳米颗粒的紫外吸收光谱图,从图中可以看出,在525 nm波长处出现了明显的吸收峰,即表面等离子共振峰。表面等离子共振峰与Au纳米颗粒的尺寸有很大关系,15 nm的Au纳米颗粒对应于525 nm波长的表面等离子共振吸收。我们注意到,用PEG包裹后,Au纳米颗粒吸收峰有微小的移动,这说明PEG包裹层对Au纳米颗粒的光学特性有微小的影响。
-
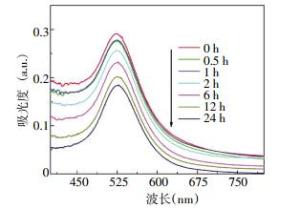
血浆中PEG包裹的Au纳米颗粒在0、0.5、1、2、6、12、24 h各时间点的稳定性检测结果见图 2。从图 2可以看出,PEG包裹的Au纳米颗粒加入血浆中后,仍然能清晰地看到525 nm波长处的表面等离子共振吸收峰,且随着反应时间的增加表面等离子峰强度逐渐降低,但是Au纳米颗粒的表面等离子共振吸收峰没有明显的移动。这说明,PEG包裹的Au纳米颗粒在血浆中与各种蛋白发生了反应,并且形成了大的Au纳米颗粒-蛋白质杂化结构,即所谓的蛋白质电晕(corona)结构。表面等离子共振吸收峰没有移动说明PEG包裹的Au纳米颗粒没有发生团聚,仍然保持其物理学特性。
-
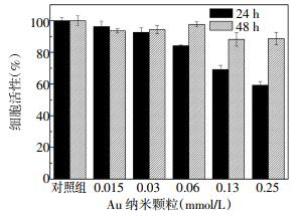
为了进一步研究Au纳米颗粒的体外毒性反应。本研究使用噻唑蓝比色法检测24和48 h时不同浓度的PEG包裹的Au纳米颗粒对HepG2细胞活性的影响,结果见图 3。图 3显示,在24 h时,0~0.03 mmol/L的PEG包裹的Au纳米颗粒对HepG2细胞的毒性较小,细胞活性较高,能达到90%以上;然而当Au纳米颗粒的浓度大于0.06 mmol/L时,细胞活性逐渐降低,0.25 mmol/L时降到60%。在48 h时,HepG2细胞的活性均较高,即使Au纳米颗粒的浓度为0.25 mmol/L,细胞活性也能保持在90%以上。结果显示,PEG保护的Au纳米颗粒对HepG2细胞的毒性相对较低。
-
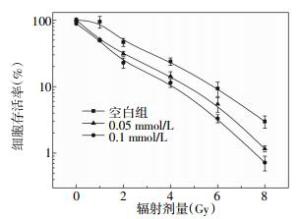
不同剂量137Cs照射含PEG包裹的Au纳米颗粒的HepG2细胞存活率结果见图 4。从图 4可以看出,随着辐射剂量的增加,空白组(无PEG包裹的Au纳米颗粒)和含0.05、0.1 mmol/L PEG包裹的Au纳米颗粒的HepG2细胞存活率逐渐降低。在8 Gy照射时,空白组的细胞存活率约为3%,而含0.05和0.1 mmol/L的Au纳米颗粒的HepG2细胞存活率分别为1.3%和0.9%,说明Au纳米颗粒表现出了明显的放射增敏作用。使用多靶单击拟合模型方程计算发现,PEG包裹的Au纳米颗粒的放射增敏比为1.31。
-
Au纳米颗粒的物理性质与其大小和表面化学密切相关。对于尺寸大于5 nm的贵金属纳米颗粒,都会在不同波长范围内出现表面等离子共振吸收。以Au为例,其表面等离子共振峰位于520 nm波长处左右。我们之前系统地研究了不同大小尺寸的Au纳米颗粒的表面等离子共振,发现当Au纳米颗粒的尺寸从5 nm增加到80 nm时,其表面等离子共振吸收峰也将移动到545 nm波长左右的范围;另外一个影响其物理性质的因素就是Au纳米颗粒的表面化学,当PEG包裹了Au纳米颗粒以后,Au纳米颗粒的亲水半径将增加,表面电子增加,因此表面等离子共振将略微增加,这与我们实验观测到的一致[24]。
通过进一步研究得知,当纳米材料与生物组织相互作用时,表面化学将扮演更为重要的角色。我们前期的研究发现,当纳米颗粒与血浆相互作用时,Au纳米颗粒将首先与血液中的各种蛋白和酶迅速反应,生成各种新的Au纳米颗粒-蛋白质杂化物,这种结构称为“蛋白质电晕”;我们前期的研究发现,对于10~20 nm的Au纳米颗粒,容易在血液中形成30 nm的蛋白质电晕,这些结构最终决定纳米颗粒的细胞摄取、细胞活性等生物界面的反应[7, 9, 16]。Au纳米颗粒对其表面等离子共振极其敏感,从血浆稳定性实验中,没有发现明显的表面等离子共振吸收峰的移动,说明纳米颗粒没有发生严重的团聚;同时,表面等离子共振吸收逐渐降低,说明PEG包裹的Au纳米颗粒已经和各种蛋白开始反应。PEG是一种较为常用的生物包裹物,其可以降低对纳米颗粒的物理特性和血浆稳定性的影响。
Au纳米颗粒的毒性也与诸多因素有关。其中最为重要的就是表面配体和细胞毒性,不同大小的纳米颗粒将决定其进入细胞膜的多少。大量的研究表明,与裸的Au纳米颗粒相比,PEG包裹的Au纳米颗粒的细胞摄取要高很多,而且摄取的最佳时间为6 h[24-25]。对于15 nm的Au纳米颗粒,其进入细胞的方式必然是内吞,而且需要消耗大量能量,这决定其过程必然要有各种蛋白参与。摄取的Au纳米颗粒在细胞内将与DNA发生相互作用,从而对细胞造成影响。PEG保护层是一种较为稳定的结构,可以有效地降低裸Au与DNA发生相互作用而造成的损伤,从而降低毒性。
对于放射增敏作用,有很多的影响因素。一方面,其与细胞摄取有关。HepG2细胞对Au纳米颗粒的摄取对其放射增敏作用产生很大的影响。已有研究表明,15 nm的PEG包裹的Au纳米颗粒对肿瘤细胞的摄取较高,这为放射增敏提供了非常好的证据[7]。另一方面,Au纳米颗粒的光电吸收截面较大,其对于γ射线的吸收较高。以Au为例,其在100 keV处的γ射线吸收系数为5.18 cm2/g。高的γ射线吸收率导致了更多的次级电子,比如俄歇电子、散射的光电子和激发产生的特征X射线,这些射线都可以加速肿瘤细胞的死亡,从而起到增强放射治疗的作用。从材料上讲,选取较好的配体分子是未来的发展趋势。本实验中所选用的PEG包裹分子,可以有效改进Au纳米颗粒的血液稳定性,但是未来还可以进一步改进表面包裹层,从而达到更高的治疗效果。此外,尽管有一些体内的放射增敏研究,但是更深入的放射增敏的研究仍然很有必要,这将对纳米材料的使用起到极大的推动作用。
本实验研究了15 nm的PEG包裹的Au纳米颗粒的血浆稳定性、体外毒性和放射增敏作用。结果表明,PEG包裹的Au纳米颗粒在血浆中的稳定性较好,表面等离子共振吸收峰没有明显移动。进一步研究的体外毒性表明,PEG包裹的Au纳米颗粒的毒性较低,48 h后肿瘤细胞的活性仍能达到90%以上。放射增敏研究表明,Au纳米颗粒具有一定的放射增敏作用,其体外的增敏比可以达到1.31。这些研究表明,Au纳米颗粒具有较好的放射增敏作用,对于其放射增敏作用可以通过改进纳米颗粒而进一步提高。
15 nm聚乙二醇保护的Au纳米颗粒对HepG2细胞的放射增敏作用
Radiosensitivity enhancement of typical 15 nm polyethylene-glycol-coated Au nanoparticles on HepG2 cell
-
摘要:
目的 研究Au纳米颗粒对HepG2细胞的放射增敏作用。 方法 首先制备典型的15 nm聚乙二醇(PEG)包裹的Au纳米颗粒,然后使用紫外可见分光光度计实时定量检测纳米颗粒的血浆稳定性,同时使用噻唑蓝法研究给药后24 h和48 h的细胞活性,最后,通过克隆形成实验研究不同浓度的Au纳米颗粒对HepG2细胞的放射增敏作用。 结果 PEG包裹的Au纳米颗粒具有较好的血浆稳定性,在24 h及以后未见表面等离子共振吸收峰有明显的偏移。细胞活性实验表明,24 h后,细胞的活性有所降低,但是48 h后细胞的活性迅速恢复到90%。进一步研究克隆形成发现,Au纳米颗粒具有明显的放射增敏作用。 结论 15 nm PEG包裹的Au纳米颗粒具有较高的血浆稳定性、较低的细胞毒性和较好的放射增敏作用。 Abstract:Objective To investigate the radiosensitivity enhancement of Au nanoparticles to HepG2 cell. Methods 15 nm polyethylene-glycol-coated(PEG) Au nanoparticles were synthesized, and then blood stability were tested by using the UV-vis optical absorption. Meanwhile, 3-(4, 5-dimethylthiazol-2-yl)-2, 5-diphenyltetrazolium bromide methods were used to investigate the cell viability after 24 and 48 hours treatments, and cloning formation were used to investigate the radiosensitivity enhancement. Results It was found that PEG-coated Au nanoparticles presented a high blood stability, and surface plasmon response has not shown significant changes after 24 hours. Cell viability was decreased after 24 hours treatment, but it was recovered to 90% after 48 hours. Cloning formation showed Au nanoparticles presented a significant radiosensitivity enhancement. Conclusions 15 nm PEG-coated Au nanoparticles presented a good blood stability, low cytotoxicity and high radiosensitivity enhancement. -
Key words:
- Polyethylene glycols /
- Gold nanoparticles /
- Radiation sensitizing
-
-
[1] Giljohann DA, Seferos DS, Daniel WL, et al. Gold nanoparticles for biology and medicine[J]. Angew Chem Int Ed Engl, 2010, 49(19):3280-3294. doi: 10.1002/anie.200904359 [2] Eustis S, El-Sayed MA. Why gold nanoparticles are more precious than pretty gold:noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes[J]. Chem Soc Rev, 2006, 35(3):209-217. doi: 10.1039/B514191E [3] 陈婕, 张晓东, 吴迪, 等.巯基-聚乙二醇修饰的不同尺寸金纳米颗粒的制备和光学特性[J].国际放射医学核医学杂志, 2013, 37(1):16-19. doi: 10.3760/cma.j.issn.1673-4114.2013.01.005
[4] Hu M, Chen J, Li ZY, et al. Gold nanostructures:engineering their plasmonic properties for biomedical applications[J]. Chem Soc Rev, 2006, 35(11):1084-1094. doi: 10.1039/b517615h [5] Wang S, Huang P, Nie L, et al. Single continuous wave laser induced photodynamic/plasmonic photothermal therapy using photosensitizer-functionalized gold nanostars[J]. Adv Mater, 2013, 25(22):3055-3061. doi: 10.1002/adma.201204623 [6] Luo Z, Yuan X, Yu Y, et al. From aggregation-induced emission of Au(I)-thiolate complexes to ultrabright Au(0)@ Au(I)-thiolate core-shell nanoclusters[J]. J Am Chem Soc, 2012, 134(40):16662-16670. doi: 10.1021/ja306199p [7] Zhang XD, Wu D, Shen X, et al. Size-dependent radiosensitization of PEG-coated gold nanoparticles for cancer radiation therapy[J]. Biomaterials, 2012, 33(16):6408-6419. [8] Day ES, Bickford LR, Slater JH, et al. Antibody-conjugated gold-gold sulfide nanoparticles as multifunctional agents for imaging and therapy of breast cancer[J]. Int J Nanomedicine, 2010, 5:445-454. [9] Zhang XD, Chen J, Luo Z, et al. Enhanced tumor accumulation of sub-2 nm gold nanoclusters for cancer radiation therapy[J]. Adv Healthc Mater, 2014, 3(1):131-141. [10] Rahman WN, Bishara N, Ackerly T, et al. Enhancement of radiation effects by gold nanoparticles for superficial radiation therapy[J]. Nanomedicine, 2009, 5(2):136-142. [11] Hainfeld JF, Slatkin DN, Focella TM, et al. Gold nanoparticles:a new X-ray contrast agent[J]. Br J Radiol, 2006, 79(939):248-253. doi: 10.1259/bjr/13169882 [12] Kim D, Park S, Lee JH, et al. Antibiofouling polymer-coated gold nanoparticles as a contrast agent for in vivo X-ray computed tomography imaging[J]. J Am Chem Soc, 2007, 129(24):7661-7665. doi: 10.1021/ja071471p [13] Tong L, Wei Q, Wei A, et al. Gold nanorods as contrast agents for biological imaging:optical properties, surface conjugation and photothermal effects[J]. Photochem Photobiol, 2009, 85(1):21-32. doi: 10.1111/j.1751-1097.2008.00507.x [14] Goodman CM, McCusker CD, Yilmaz T, et al. Toxicity of gold nanoparticles functionalized with cationic and anionic side chains[J]. Bioconjug Chem, 2004, 15(4):897-900. doi: 10.1021/bc049951i [15] Hauck TS, Ghazani AA, Chan WC. Assessing the effect of surface chemistry on gold nanorod uptake, toxicity, and gene expression in mammalian cells[J]. Small, 2008, 4(1):153-159. doi: 10.1002/smll.200700217 [16] Zhang XD, Wu D, Shen X, et al. In vivo renal clearance, biodistribution, toxicity of gold nanoclusters[J]. Biomaterials, 2012, 33(18):4628-4638. doi: 10.1016/j.biomaterials.2012.03.020 [17] Pan Y, Neuss S, Leifert A, et al. Size-dependent cytotoxicity of gold nanoparticles[J]. Small, 2007, 3(11):1941-1949. doi: 10.1002/smll.200700378 [18] De Jong WH, Hagens WI, Krystek P, et al. Particle size-dependent organ distribution of gold nanoparticles after intravenous administration[J]. Biomaterials, 2008, 29(12):1912-1919. doi: 10.1016/j.biomaterials.2007.12.037 [19] Zhang XD, Wu D, Shen X, et al. Size-dependent in vivo toxicity of PEG-coated gold nanoparticles[J]. Int J Nanomedicine, 2011, 6:2071-2081. [20] Zhang G, Yang Z, Lu W, et al. Influence of anchoring ligands and particle size on the colloidal stability and in vivo biodistribution of polyethylene glycol-coated gold nanoparticles in tumor-xenografted mice[J]. Biomaterials, 2009, 30(10):1928-1936. doi: 10.1016/j.biomaterials.2008.12.038 [21] Lipka J, Semmler-Behnke M, Sperling RA, et al. Biodistribution of PEG-modified gold nanoparticles following intratracheal instillation and intravenous injection[J]. Biomaterials, 2010, 31(25):6574-6581. doi: 10.1016/j.biomaterials.2010.05.009 [22] Zhang XD, Wu HY, Wu D, et al. Toxicologic effects of gold nanoparticles in vivo by different administration routes[J]. Int J Nanomedicine, 2010, 5:771-781. [23] Xie J, Zheng Y, Ying JY. Protein-directed synthesis of highly fluorescent gold nanoclusters[J]. J Am Chem Soc, 2009, 131(3):888-889. doi: 10.1021/ja806804u [24] Wu X, He X, Wang K, et al. Ultrasmall near-infrared gold nanoclusters for tumor fluorescence imaging in vivo[J]. Nanoscale, 2010, 2(10):2244-2249. doi: 10.1039/c0nr00359j [25] Wu Z, Jin R. On the ligand′s role in the fluorescence of gold nanoclusters[J]. Nano Lett, 2010, 10(7):2568-2573. doi: 10.1021/nl101225f -





 下载:
下载: