-
随着临床肿瘤放射治疗的广泛应用,胸部肿瘤患者生存时间明显延长,而在治疗过程中位于纵隔的心脏不可避免地要受到射线照射。大量临床资料显示,由放射治疗所导致的放射性心脏损伤(radiation-induced heart disease,RIHD)已成为患者非肿瘤死亡的重要原因,这部分患者心血管疾病的发病率和病死率都明显升高,特别是心功能不全的患者[1]。有研究者认为,能量代谢的改变在心功能不全的发病机制中起着重要作用,调节心肌能量代谢有望成为一种治疗心功能不全的新策略,而线粒体作为心肌能量供应的主要细胞器,其结构和功能的正常对于维持心肌细胞正常的能量代谢具有重要作用[2]。因此,本研究旨在观察X射线照射对心肌细胞线粒体功能的影响以及自噬在线粒体功能改变中的作用。
-
Wistar大鼠,雄性,135只,8周龄,体质量180~200 g,由山西医科大学实验动物中心提供。
-
LC3Ⅱ(一种自噬蛋白)及Beclin 1(一种自噬标志物)抗体购自美国Cell Signaling Technology公司;LC3Ⅱ及Beclin 1引物购自日本TaKaRa公司;3-甲基腺嘌呤(3-methyladenine,3-MA)购自美国Cell Signaling Technology公司;JC-1染料购自美国Genmed Scientifics公司。采用Varian IX直线加速器制备大鼠RIHD模型,6 mV X射线以2 cm×2 cm的照射野照射大鼠心脏,照射源靶距100 mm,吸收剂量为20 Gy。
-
将135只Wistar雄性大鼠随机分成3组:假照射组、照射组、照射+3-MA组,分别测定大鼠离体心功能、线粒体膜电位、LC3Ⅱ及Beclin 1水平。假照射组10只,5只用于离体心功能测定,5只用于后3项指标测定;照射组分为3 h、6 h、12 h、1 d、2 d、4 d、7 d、14 d和21 d等9个亚组,各亚组用于离体心功能测定各5只,前7个亚组用于后3项指标测定各5只;照射+3-MA组分为3 h、6 h、12 h、1 d、2 d、4 d、7 d和14 d等8个亚组,各亚组用于离体心功能测定各5只,6 h亚组用于后3项指标测定5只。假照射组接受0 Gy X射线照射,照射组进行20 Gy X射线一次性胸部心脏全野照射。照射+3-MA组大鼠在行20 Gy X射线照射前30 min腹腔注射2 μl 3-MA。
-
猛击大鼠枕后部致昏,迅速开胸取出心脏,放入预冷的Krebs-Henseleit液(美国Sigma公司)中,修剪后将主动脉悬挂于Langendorff灌流装置(ML870B2,澳大利亚埃德仪器有限公司)上,用充以95%氧气与5%二氧化碳混合气体的Krebs-Henseleit液灌流。将起搏电极置于离体心脏右室,刺激强度设置为2倍阈强度,频率为200次/min。将一乳胶水囊(直径约3~5 mm)经左心房插入左心室内,水囊内充有一定量的灌流液,水囊导管另一端与压力换能器(YP501,成都仪器厂)相连,待各项心功能指标稳定后对左心室内压进行采集、分析。采用BL-410生物信号记录分析系统(成都泰盟科技有限公司)记录大鼠左心室舒张压(left ventricular diastolic pressure,LVDP)、左心室压力上升的最大速率(+dP/dtmax)和左心室压力下降的最大速率(-dP/dtmax)。
-
选用对线粒体膜电位敏感的JC-1染料,按照冰冻切片线粒体内膜功能(膜电位)荧光测定试剂盒(由Genmed Scientifics公司提供)流程进行实验。采用激光共聚焦显微镜(OLYMPUS,FV1000)观察。当线粒体膜电位正常时,JC-1发红色荧光;而当线粒体膜电位下降时,JC-1发绿色荧光。
-
取心肌组织70 mg,经裂解、匀浆、离心10 min(3600 r/min,离心半径为10 cm)提取上清蛋白定量。各组上样量均为30 μg,经15%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,以β-actin蛋白(北京中杉金桥公司)作为内参。采用SuperECL Plus超敏发光液(普利莱基因技术有限公司)发光,将膜置于Kodak Image Station 400系统(美国Kodak公司)成像并进行灰度值分析。
-
取心肌组织70 mg,裂解并提取总RNA。3 μg总RNA反转为cDNA,选用SYBR Green荧光定量PCR试剂盒(日本TaKaRa公司)扩增cDNA产物,确定实时定量PCR的扩增曲线和溶解曲线。以甘油醛-3-磷酸脱氢酶(日本TaKaRa公司)作为内参。按照ΔΔCt解析法来进行目的基因和管家基因的相对定量。
-
照射组大鼠经20 Gy X射线照射后7 d、14 d左心室各功能参数与假照射组比较无明显变化,而照射后21 d大鼠的LVDP、±dP/dtmax均低于假照射组,且差异显著(表 1)。
组别 数量
(只)0 d 7 d LVDP
(mmHg)+dP/dt max
(mmHg/s)-dP/dt max
(mmHg/s)LVDP
(mmHg)+dP/dt max
(mmHg/s)-dP/dt max
(mmHg/s)假照射组 10 107.5±12.6 3060.0±280.1 -1999.0±241.4 108.5±10.8 3043.3±258.3 -2016.0±211.7 照射组 80 108.5±10.3 3060.0±304.9 -1999.0±222.2 102.5±8.7 2813.5±366.4 -2031.0±252.4 组别 14 d 21 d LVDP
(mmHg)+dP/dt max
(mmHg/s)-dP/dt max
(mmHg/s)LVDP
(mmHg)+dP/dt max
(mmHg/s)-dP/dt max
(mmHg/s)假照射组 106.3±13.0 3093.3±225.7 -2033.0±236.8 105.5±11.7 3093.3±306.9 -2016.0±261.5 照射组 104.2±9.3 2893.3±252.5 -2066.0±297.1 87.5±11.6 2060.0±266.6 -1666.0±243.5 注:表中,1 mmHg=0.133 kPa;LVDP:左心室舒张压;+dP/dtmax:左心室压力上升的最大速率;-dP/dtmax:左心室压力下降的最大速率。20 Gy X射线照射后21 d,大鼠的LVDP、±dP/dtmax均低于假照射组。 表 1 经20 Gy X射线照射后大鼠离体心功能参数的变化(x±s)
-
线粒体膜电位常作为评估线粒体功能的重要参数之一。本实验采用JC-1荧光染色来反映心肌细胞线粒体膜电位的变化。本实验中假照射组大鼠心肌组织呈高红荧光,而照射组大鼠经20 Gy X射线照射后1 d的心肌组织绝大部分呈绿色荧光,提示照射后大鼠线粒体功能损伤。
-
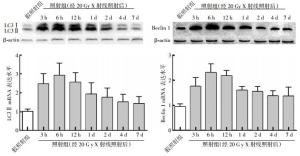
本实验选用LC3Ⅱ和Beclin 1作为自噬形成的标志物。与假照射组比较,照射组大鼠经X射线照射后3 h、6 h、12 h、1 d、2 d、4 d和7 d,LC3Ⅱ及Beclin 1的蛋白表达水平和mRNA水平均明显升高,在照射后6 h达到最高值(图 1)。
-
3-MA是一种特异性的自噬抑制剂。与照射组相比,照射+3-MA组经X射线照射6 h后,大鼠心肌细胞LC3Ⅱ及Beclin 1蛋白表达水平明显下降,大鼠离体心功能参数出现异常的时间提前至照射后14 d:LVDP=(84.2±9.3)mmHg(1 mmHg=0.133 kPa);+dP/dtmax=(1993.3±167.8)mmHg/s;-dP/dtmax=(-1599.0±185.4)mmHg/s。
-
RIHD常处于亚临床状态,需经过相当长的潜伏期才出现临床症状,多发生于放射治疗后数月至数年,放射治疗早期多因心肌纤维化导致心脏舒缩功能障碍[3]。机体通过神经体液调节维持重要器官功能的稳定性,为排除神经体液的影响,我们选择检测大鼠RIHD后的离体心功能,因为心脏在无神经体液调节下,对损伤因素缺乏一定的代偿,能客观地反映放射性损伤后心脏早期的实际变化。参照Kruse等[3]建立的RIHD模型,给予大鼠心脏单次局部照射剂量20 Gy(近似临床常规分割照射80 Gy),到照射后21 d才出现心脏离体功能的异常。Dogan等[4]的研究显示,大鼠RIHD后4个月出现心肌细胞的凋亡,6个月后出现在体心功能的损伤。同时,本研究证实,线粒体膜电位的降低出现在大鼠RIHD后1 d,明显早于离体心功能异常的出现,这一结果提示我们可能还有其他的机制参与了放射治疗后心肌线粒体功能障碍的过程。
自噬作为细胞保持稳定状态的“管家机制”,可调控线粒体等多种细胞器的更新,自噬在应激状态下可以被激活,以延长细胞的寿命[5]。当自噬发生时,细胞胞浆可溶性LC3Ⅰ经加工修饰而形成LC3Ⅱ,并定位于自噬体膜上。因此,LC3Ⅱ的含量或LC3Ⅱ与LC3Ⅰ含量的比值变化在某种程度上反映了细胞的自噬活性[6]。Beclin 1基因参与调节前自噬体的形成及自噬蛋白在自噬体膜上的定位过程,具有调节细胞存活、分化和生长的作用,是检测自噬的常用指标之一[7]。线粒体损伤或功能障碍可能导致一个或多个线粒体功能、形态、膜电位、ATP以及Ca2+稳态的变化。在正常情况下,自噬可以清除或降解细胞内损伤的线粒体,并利用降解产物提供能量并重建细胞结构,以维持能量代谢平衡和内环境稳态,是一个重要的细胞保护性反应[8]。有研究表明,当自噬能力不足时,细胞对损伤线粒体的清除能力下降,线粒体途径的细胞凋亡启动,线粒体膜电位下降,线粒体功能受损,导致线粒体外膜被破坏,凋亡诱导因子释放,导致细胞凋亡,进而引起心功能障碍[9]。
本研究发现,在大鼠RIHD后1 d,心肌细胞的LC3 Ⅱ及Beclin 1水平明显升高,提示线粒体功能下降激活了自噬水平的升高。那么,RIHD后引起的线粒体功能损伤以及心功能下降的过程中是否存在自噬水平的改变呢?本实验选用3-MA来下调自噬水平,发现自噬水平的下调引起了离体心功能异常的提前出现。
综上所述,在大鼠RIHD模型中,线粒体膜电位的降低早于心功能异常的出现,并激活自噬水平的升高;下调自噬加剧了离体心功能的下降,提示自噬在心功能异常中起着一定的保护作用,为临床进一步减轻RIHD提供了新思路。
自噬在X射线照射所致心肌线粒体损伤中的作用
Effects of autophagy in myocardial mitochondrial injury caused by X-ray irradiation
-
摘要:
目的 观察X射线照射对大鼠心肌线粒体功能的影响以及自噬在线粒体功能损伤中的作用。 方法 将135只实验大鼠分成假照射组(10只)、照射组(80只)和照射+3-甲基腺嘌呤(3-MA)组(45只),假照射组接受0 Gy X射线照射,照射组给予20 Gy X射线照射,照射+3-MA组接受20 Gy X射线照射前30 min腹腔注射2 μl 3-MA。采用蛋白免疫印迹法和实时定量PCR法检测心肌细胞的LC3Ⅱ及Beclin 1蛋白表达及其mRNA水平变化,检测左心室舒张压及±dP/dtmax(左心室压力上升及下降的最大速率)等离体心功能指标。 结果 与假照射组相比,照射组大鼠经20 Gy X射线照射后离体心功能在21 d时出现降低;而在1 d时心肌组织线粒体功能便出现了损伤;同时,心肌细胞自噬水平在3 h、6 h、12 h、1 d、2 d、4 d及7 d时出现明显上升,与假照射组之间的差异显著,且在6 h达到最高值。与照射组相比,照射+3-MA组大鼠心肌LC3Ⅱ及Beclin 1表达水平明显下降,且心功能出现异常的时间提前至14 d。 结论 X射线照射损伤大鼠心肌线粒体功能并诱导自噬发生,可能是心肌保护的重要因素。 Abstract:Objective To observed the effects of X-ray irradiation on myocardial mitochondrial function and role of autophagy in mitochondrial injury. Methods The rats were divided into sham-irradiation control group, irradiation group and irradiation+3-methyladenine(3-MA) group. Rat in sham-irradiation control group accepted no irradiation, while rat in irradiation group accepted local 20 Gy X-ray irradiation in the chest, the last group accepted 20 Gy X-ray irradiation prior to intraperitoneal injection 2 μl 3-MA. Western blot and real time PCR were used to detect the expression of LC3Ⅱ and Beclin 1 in protein and their mRNA levels. In vitro cardiac function was used to detect the changes of the left ventricular diastolic pressure(LVDP), the maximal rate of rise of pressure in the isovolumetric systolic left ventricle(+dP/dtmax)and the maximal rate of rise of pressure in the isovolumetric diastolic left ventricle(-dP/dtmax). Results Compared with the sham-irradiation control group, there were the decreased of the LVDP, +dP/dtmax and -dP/dtmax at 21 d, and myocardial mitochondrial injury at 1 d after 20 Gy irradiation. The expression of LC3 and Beclin 1 in protein and mRNA levels increased significantly at 3 h, 6 h, 12 h, 1 d, 2 d, 4 d and 7 d after 20 Gy irradiation, up to peak at 6 h. Compared with irradiation group, intraperitoneal injection 2 μl 3-MA 30 min before irradiation, the expression of LC3Ⅱ and Beclin 1 in protein decreased significantly at 6 h after irradiation, there were the decreased of the LVDP, +dP/dtmax and -dP/dtmax at 14 d, then the irradiation group for 21 days. Conclusion X-ray irradiation could injury myocardial mitochondrial function and induce autophagy in rat myocardial cell, which was an important factor of myocardial protection. -
Key words:
- Mitochondria, heart /
- Radiation injury /
- Autophagy /
- X-rays
-
表 1 经20 Gy X射线照射后大鼠离体心功能参数的变化(x±s)
组别 数量
(只)0 d 7 d LVDP
(mmHg)+dP/dt max
(mmHg/s)-dP/dt max
(mmHg/s)LVDP
(mmHg)+dP/dt max
(mmHg/s)-dP/dt max
(mmHg/s)假照射组 10 107.5±12.6 3060.0±280.1 -1999.0±241.4 108.5±10.8 3043.3±258.3 -2016.0±211.7 照射组 80 108.5±10.3 3060.0±304.9 -1999.0±222.2 102.5±8.7 2813.5±366.4 -2031.0±252.4 组别 14 d 21 d LVDP
(mmHg)+dP/dt max
(mmHg/s)-dP/dt max
(mmHg/s)LVDP
(mmHg)+dP/dt max
(mmHg/s)-dP/dt max
(mmHg/s)假照射组 106.3±13.0 3093.3±225.7 -2033.0±236.8 105.5±11.7 3093.3±306.9 -2016.0±261.5 照射组 104.2±9.3 2893.3±252.5 -2066.0±297.1 87.5±11.6 2060.0±266.6 -1666.0±243.5 注:表中,1 mmHg=0.133 kPa;LVDP:左心室舒张压;+dP/dtmax:左心室压力上升的最大速率;-dP/dtmax:左心室压力下降的最大速率。20 Gy X射线照射后21 d,大鼠的LVDP、±dP/dtmax均低于假照射组。 -
[1] Heidenreich PA, Kapoor JR. Radiation induced heart disease: systemic disorders in heart disease. Heart, 2009, 95(3): 252-258. [2] Neubauer S. The failing heart-an engine out of fuel. N Engl J Med, 2007, 356(11): 1140-1151. doi: 10.1056/NEJMra063052 [3] Kruse JJ, Strootman EG, Wondergem J. Effects of amifostine on radiation-induced cardiac damage. Acta Oncol, 2003, 42(1): 4-9. doi: 10.1080/0891060310002168 [4] Dogan I, Sezen O, Sonmez B, et al. Myocardial perfusion alterations observed months after radiotherapy are related to the cellular damage. Nuklearmedizin, 2010, 49(6): 209-215. [5] Green DR, Galluzzi L, Kroemer G. Mitochondria and the autophagy-inflammation-cell death axis in organismal aging. Science, 2011, 333(6046): 1109-1112. doi: 10.1126/science.1201940 [6] Tanida I, Ueno T, Kominami E. LC3 and Autophagy. Methods Mol Biol, 2008, 445: 77-88. [7] Wirawan E, Lippens S, Vanden Berghe T, et al. Beclin1: a role in membrane dynamics and beyond. Autophagy, 2012, 8(1): 6-17. doi: 10.4161/auto.8.1.16645 [8] Wang K, Klionsky DJ. Mitochondria removal by autophagy. Auto-phagy, 2011, 7(3): 297-300. [9] Gottlieb RA, Mentzer RM. Autophagy during cardiac stress: joys and frustrations of autophagy. Annu Rev Physiol, 2010, 72: 45-59. doi: 10.1146/annurev-physiol-021909-135757 -





 下载:
下载:

