-
烟酰胺是近年来国内外研究较多的放射增敏剂。经研究发现,它对体外培养的恶性肿瘤细胞以及人类恶性肿瘤移植瘤均有明显的放疗增敏作用,且毒性低[1-3]。尼可胺是以烟酰胺为母体化合物合成的烟酰氨基酸类化合物,其放射增敏效果优于母体化合物烟酰胺[4],且毒性更低,是很有希望成为高效低毒并有实用前景的肿瘤放疗增敏剂。本文采用高效液相色谱法(high performance liquid chromatography,HPLC)测定尼可胺在大鼠体内的血药浓度变化[5],拟为尼可胺在人体内的代谢规律评价提供科学依据。
-
Shimadzu LC-10A高效液相色谱仪购自日本岛津公司;BP-211D电子分析天平由上海菲恰尔分析仪器有限公司提供;WH-2微型涡旋混合器购自上海沪西分析仪器厂。
-
尼可胺为白色粉状晶体,纯度>95%,由中国医学科学院放射医学研究所药物室合成提供,色谱纯乙腈购自天津市科密欧化学试剂有限公司,色谱纯甲醇购自天津市标准科技有限公司。
-
健康大鼠36只,雌雄各半,初始体质量为220~240 g,购自中国人民解放军军事医学科学院卫生学与环境医学研究所动物实验中心,许可证号:SCXK(军)2009-003。
-
色谱柱:大连依利特Sino chrom BDS柱(250 mm×4.6 mm,5 μm);流动相:甲醇-0.02%醋酸(10:90);检测波长:260 nm;柱温:30 ℃;流速:1 ml/min;进样量:5 μl[6-7]。
-
取100 μl大鼠空白血浆样品,加入200 μl乙腈,漩涡混匀2 min,离心10 min(8000 r/min,离心半径为10 cm),吸取上清进样,按1.4.1.1节中所述色谱条件进行分析[4]。
-
精密吸取10 mg/ml的尼可胺储备液0.1 ml后,加入大鼠空白血浆0.9 ml,置漩涡混合器上混匀后,得到1 mg/ml的溶液。再用空白血浆稀释得到的溶液,以1 mg/ml为最大值,将其稀释成浓度为20、30、50、100、150、250、500 μg/ml的溶液。按照血浆样品的处理方法操作。以待测药物浓度为横坐标,待测物峰面积为纵坐标,进行线性回归分析。
-
按1.4.1.3小节中的方法,分别制备尼可胺在大鼠血浆中低、中、高3种浓度(50、150、500 μg/ml)的质量控制样品,每种浓度配制6个平行样本,共配制5份。
取1份低、中、高3种浓度的质量控制样品,以提取后的色谱图峰面积与未经提取直接进样所得的色谱图峰面积之比来考察样品的提取回收率。
-
取1份低、中、高3种浓度的质量控制样品,分别分析不同浓度的6份平行样本,各分析3 d,根据当日工作曲线,分别计算质量控制样品的测定浓度,与配制浓度对照,求得测定方法的精密度。
-
取1份低、中、高3种浓度的质量控制样品,分别测定不同浓度的6份平行样本在24 h内经3次-20 ℃冰冻然后室温融化后的浓度。
-
取1份低、中、高3种浓度的质量控制样品,分别测定不同浓度的6份平行样本经-20 ℃低温冻存1、7、14、21 d后的浓度。
-
取1份低、中、高3种浓度的质量控制样品,分别于0、16、24 h后测定样品浓度。
-
取健康大鼠36只,随机分为3组,每组12只,雌雄各半。给药剂量分别为125、250、500 mg/kg体质量。
-
每组随机选取雌雄大鼠各3只,分别于给药后0、1、15、45、90、180、300 min自眼眶取血于1.5 ml抗凝离心管中;其余动物于给药后0、5、30、60、120、240、360 min同法采集血液于1.5 ml抗凝离心管中,采集的所有血液均离心10 min(3000 r/min,离心半径为10 cm),分别取上清血浆于-20 ℃保存待测。
-
用DAS2.0药代动力学软件拟合血药浓度-时间曲线并计算药代动力学参数。尼克胺药代动力学参数均采用x±s表示,两组间比较采用t检验,P<0.05表示差异有统计学意义。
-
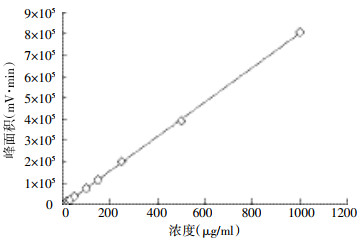
大鼠血浆中尼可胺在20~1000 μg/ml范围内呈现良好的线性,回归方程为y=805.51x-3173,r=0.9998(图 1)。
-
由表 1可知,在尼克胺低、中、高3种浓度的质量控制样品中,血浆的提取回收率分别为84.9%、81.9%和79.1%。
尼可胺浓度
(μg/ml)测定值
(x±s,μg/ml)回收率
(%)相对标准偏差
(%)50 51.38±2.45 84.9 5.18 150 145.70±5.47 81.9 3.86 500 476.89±6.44 79.1 1.37 表 1 不同浓度的尼可胺大鼠血浆的提取回收率(n=6)
-
血浆中尼可胺HPLC测定方法的回收率见表 2,在尼克胺低、中、高3种浓度的质量控制样品中,批内精密度和批间精密度均小于5%。
尼可胺浓度(μg/ml) 样本数 测定值
(μg/ml)回收率
(%)相对标准偏差
(%)批内 50 6 51.39±2.45 102.8 4.77 150 6 145.70±5.47 97.1 3.75 500 6 476.88±6.46 95.4 1.35 批间 50 18 50.84±2.32 101.7 4.56 150 18 149.49±7.18 99.7 4.80 500 18 492.25±21.36 98.5 4.34 注:表中,HPLC:高效液相色谱法。 表 2 血浆中尼可胺HPLC测定方法的回收率(x±s)
-
不同浓度的尼克胺大鼠血浆样品的稳定性考察结果见表 3~表 5,血浆样品在室温下放置24 h、24 h内冻融3次及冰冻条件下存放至21 d的条件下均稳定。
尼可胺浓度
(μg/ml)室温放置后尼可胺浓度(x±s,μg/ml) 相对标准偏差
(%)0 h后 16 h后 24 h后 50 48.59±1.38 48.76±1.11 51.08±0.96 3.23 150 145.37±4.76 154.88±4.08 146.13±3.42 3.96 500 481.41±10.67 497.23±8.65 479.66±10.85 2.57 表 3 不同浓度的尼克胺大鼠血浆样品在室温放置下的稳定性考察(n=6)
尼可胺浓度
(μg/ml)冻融前后尼可胺浓度(x±s,μg/ml) 相对标准偏差(%) 冻融前 24 h内冻融3次后 50 51.39±2.45 50.54±0.71 3.48 150 145.70±5.47 145.91±1.79 2.66 500 476.88±6.46 508.30±10.46 3.73 表 4 不同浓度的尼克胺大鼠血浆样品在冻融条件下的稳定性考察(n=6)
尼可胺浓度
(μg/ml)冰冻后尼可胺浓度(x±s,μg/ml) 相对标准偏差(%) 0 d后 1 d后 7 d后 14 d后 21 d后 50 51.39±2.45 52.55±0.67 54.17±1.66 56.80±2.23 49.82±2.59 5.84 150 145.70±5.47 157.40±3.22 154.99±3.22 153.99±3.75 144.54±2.89 4.21 500 476.88±6.46 518.45±12.16 522.77±14.83 558.20±27.52 496.33±7.25 5.30 表 5 不同浓度的尼克胺大鼠血浆样品在冰冻条件下的稳定性考察结果(n=6)
-
大鼠单次腹腔注射尼可胺各剂量组的平均血药浓度-时间曲线见图 2。以DAS2.0药代动力学软件计算并根据药代动力学房室模型判断方法确定尼可胺在大鼠体内的动力学过程符合二室模型,各剂量组药代动力学参数详见表 6。
组别 注射剂量(mg/kg) 参数 分布相半衰期
(min)消除相半衰期
(min)表观分布容积
(L/kg)清除率
(L·min-1·kg-1)血药浓度-时间曲线下面积(0-t)
(mg·L-1·min)血药浓度-时间曲线下面积(0-∞)
(mg·L-1·min)达峰时间
(min)达峰浓度
(mg/L)低剂量组 125 27.17±24.60# 32.99±23.14# 0.16±0.11#* 0.008±0.002 14390.23±2584.02#* 16569.89±3450.31#* 27.0±6.7# 242.13±33.89#* 中剂量组 250 47.33±16.26△ 59.05±16.34 0.53±0.28 0.007±0.002 26752.23±7967.03△ 35812.87±9476.48△ 27.5±11.3△ 316.32±63.68△ 高剂量组 500 65.47±8.70 69.06±0.62 0.70±0.15 0.006±0.002 77306.48±27878.03 88014.22±26960.89 40.0±7.7 601.42±147.15 注:表中,#表示低剂量组与高剂量组大鼠的药代动力学参数相比,两者之间的差异具有统计学意义,t=3.60、4.70、7.11、5.50、6.44、3.12、5.83,P均<0.05;△表示中剂量组与高剂量组大鼠的药代动力学参数相比,两者之间的差异具有统计学意义,t=2.41、4.27、4.47、2.24、4.36,P均<0.05;*表示低剂量组与中剂量组大鼠的药代动力学参数相比,差异有统计学意义,t=3.01、3.62、4.67、2.52,P均<0.05。注:表中,#表示低剂量组与高剂量组大鼠的药代动力学参数相比,两者之间的差异具有统计学意义,t=3.60、4.70、7.11、5.50、6.44、3.12、5.83,P均<0.05;△表示中剂量组与高剂量组大鼠的药代动力学参数相比,两者之间的差异具有统计学意义,t=2.41、4.27、4.47、2.24、4.36,P均<0.05;*表示低剂量组与中剂量组大鼠的药代动力学参数相比,差异有统计学意义,t=3.01、3.62、4.67、2.52,P均<0.05。 表 6 大鼠单次腹腔注射尼可胺的主要药代动力学参数结果(x±s,n=6)
从表 6中可以看出,当大鼠腹腔注射125、250、500 mg/kg的尼可胺时,清除率不随剂量改变;表观分布容积、血药浓度-时间曲线下面积及达峰浓度基本随剂量增大而成比例增加;分布相的半衰期和消除相半衰期也随剂量的增加而延长;中、低剂量组的达峰时间基本相同。
-
采用HPLC研究尼可胺在大鼠体内的药代动力学结果表明,大鼠腹腔给予尼可胺后其代谢符合二室模型。给药剂量及给药方式符合该药的预期设计要求,所取得的各项药代动学参数对研究未来人体内的代谢规律及临床合理正确用药(如通过血药浓度达峰时间数据结果,选择最佳放疗照射时间)具有重要的参考价值。实验选取的HPLC检测方法,经典简便、灵敏度高、测定结果准确、重现性好,完全适用于尼可胺在大鼠体内的药代动力学研究。
尼可胺在大鼠体内的药代动力学研究
Study on pharmacokinetics of NiKeAn in rat
-
摘要:
目的 采用高效液相色谱法(HPLC)研究尼可胺在大鼠体内的药代动力学变化。 方法 色谱柱为Sino chrom BDS柱(250 mm×4.6 mm,5 μm),流动相为甲醇-0.02%醋酸(10:90),检测波长为260 nm,柱温为30 ℃,流速为1 ml/min,进样量为5 μl。通过大鼠眼底静脉取血,血浆经乙腈沉淀蛋白,测定尼可胺血药浓度,通过DAS2.0计算其药代动力学参数。 结果 尼可胺的线性范围:20~1000 μg/ml(r=0.9998)。当尼可胺在大鼠血浆中的浓度为50、150和500 μg/ml时,提取回收率分别为84.9%、81.9%和79.1%,批内精密度和批间精密度均<5%。当大鼠给予125 mg/kg的尼可胺后,其主要药代动力学参数为:消除相半衰期(t1/2β)为(32.99±23.14)min,血药-时间浓度曲线下面积(AUC)(0-t)为(14390.23±2584.02)mg·L-1·min,AUC(0-∞)为(16569.89±3450.31)mg·L-1·min,达峰时间(Tmax)为(27.0±6.7)min,药峰浓度(Cmax)为(242.13±33.89)mg/L。当大鼠给予250 mg/kg的尼可胺后,其主要药代动力学参数为:t1/2β为(59.05±16.34)min,AUC(0-t)为(26752.23±7967.03)mg·L-1·min,AUC(0-∞)为(35812.87±9476.48)mg·L-1·min,Tmax为(27.5±11.3)min,Cmax为(316.32±63.68)mg/L。当大鼠给予500 mg/kg的尼可胺后,其主要药代动力学参数为:t1/2β为(69.06±0.62)min,AUC(0-t)为(77306.48±27878.03)mg·L-1·min,AUC(0-∞)为(88014.22±26960.89)mg·L-1·min,Tmax为(40.0±7.7)min,Cmax为(601.42±147.150)mg/L。 结论 HPLC操作简便、准确、灵敏度高、重现性好,能够用于尼可胺在大鼠体内的药代动力学研究,为人体内尼可胺的药代动力学研究提供了参考。 Abstract:Objective To develop a sensitive and specific high performance liquid chromatography(HPLC)method for determination of NiKeAn in rat plasma, and study the Pharmacokinetics in rat. Methods Sino chrom BDS column(250 mm×416 mm, 5 μm)was used. The mobile phase was CH3OH-0.02%-phosphoric acid(10:90)with a flow rate of 1.0 ml/min, and the detection wave length was at 260 nm and 30 ℃ column temperature. The plasma was analyzed after a simple protein precipitation procedure with acetonitrile. The blood sample was collected from retinal vein and involved protein precipitation with acetonitrile. Concentration of NiKeAn in rat blood was analyzed by the established method, and the pharmacokinetics parameters were calculated by the DAS2.0 software. Results The linear range of NiKeAn in rat plasma was 20-1000 μg/ml(r=0.9998). As concentration of NiKeAn in rat plasma were 50, 150 and 500 μg/ml, the relative standard deviation of intra-batch and inter-batch were both less than 5.0%. The recovery rates of NiKeAn were 84.9%, 81.9% and 79.1%, respectively. After single dose of 125 mg/kg in rat, the main pharmacokinetic parameters were estimated to be as follows: elimination half-life time(t1/2β)was(32.99±23.14)min, the area under the curve(AUC)(0-t)was(14390.23±2584.02)mg·L-1·min, AUC(0-∞)was(16569.89±3450.31)mg·L-1·min, the time of peak(Tmax)was(27.0±6.7)min, the peak concentration of drug(Cmax) was(242.13±33.89)mg/L. After single dose of 250 mg/kg in rat, the main pharmacokinetic parameters were estimated to be as follows: t1/2β was(59.05±16.34)min, AUC(0-t)was(26752.23±7967.03)mg·L-1·min, AUC(0-∞)was(35812.87±9476.48)mg·L-1·min, Tmax was(27.5±11.3)min, Cmax was(316.32±63.68)mg/L. After single dose of 500 mg/kg in rat, the main pharmacokinetic parameters were estimated to be as follows: t1/2β was(69.06±0.62)min, AUC(0-t)was(77306.48±27878.03) mg·L-1·min, AUC(0-∞)was(88014.22±26960.89)mg·L-1·min, Tmax was(40.0±7.7)min, Cmax was(601.42±147.15)mg/L. Conclusions The operation of established HPLC approach was simple, accurate, high-sensitive and better reproducible. This study provides a better reference for pharmacokinetics of NiKeAn in human bodies. -
表 1 不同浓度的尼可胺大鼠血浆的提取回收率(n=6)
尼可胺浓度
(μg/ml)测定值
(x±s,μg/ml)回收率
(%)相对标准偏差
(%)50 51.38±2.45 84.9 5.18 150 145.70±5.47 81.9 3.86 500 476.89±6.44 79.1 1.37 表 2 血浆中尼可胺HPLC测定方法的回收率(x±s)
尼可胺浓度(μg/ml) 样本数 测定值
(μg/ml)回收率
(%)相对标准偏差
(%)批内 50 6 51.39±2.45 102.8 4.77 150 6 145.70±5.47 97.1 3.75 500 6 476.88±6.46 95.4 1.35 批间 50 18 50.84±2.32 101.7 4.56 150 18 149.49±7.18 99.7 4.80 500 18 492.25±21.36 98.5 4.34 注:表中,HPLC:高效液相色谱法。 表 3 不同浓度的尼克胺大鼠血浆样品在室温放置下的稳定性考察(n=6)
尼可胺浓度
(μg/ml)室温放置后尼可胺浓度(x±s,μg/ml) 相对标准偏差
(%)0 h后 16 h后 24 h后 50 48.59±1.38 48.76±1.11 51.08±0.96 3.23 150 145.37±4.76 154.88±4.08 146.13±3.42 3.96 500 481.41±10.67 497.23±8.65 479.66±10.85 2.57 表 4 不同浓度的尼克胺大鼠血浆样品在冻融条件下的稳定性考察(n=6)
尼可胺浓度
(μg/ml)冻融前后尼可胺浓度(x±s,μg/ml) 相对标准偏差(%) 冻融前 24 h内冻融3次后 50 51.39±2.45 50.54±0.71 3.48 150 145.70±5.47 145.91±1.79 2.66 500 476.88±6.46 508.30±10.46 3.73 表 5 不同浓度的尼克胺大鼠血浆样品在冰冻条件下的稳定性考察结果(n=6)
尼可胺浓度
(μg/ml)冰冻后尼可胺浓度(x±s,μg/ml) 相对标准偏差(%) 0 d后 1 d后 7 d后 14 d后 21 d后 50 51.39±2.45 52.55±0.67 54.17±1.66 56.80±2.23 49.82±2.59 5.84 150 145.70±5.47 157.40±3.22 154.99±3.22 153.99±3.75 144.54±2.89 4.21 500 476.88±6.46 518.45±12.16 522.77±14.83 558.20±27.52 496.33±7.25 5.30 表 6 大鼠单次腹腔注射尼可胺的主要药代动力学参数结果(x±s,n=6)
组别 注射剂量(mg/kg) 参数 分布相半衰期
(min)消除相半衰期
(min)表观分布容积
(L/kg)清除率
(L·min-1·kg-1)血药浓度-时间曲线下面积(0-t)
(mg·L-1·min)血药浓度-时间曲线下面积(0-∞)
(mg·L-1·min)达峰时间
(min)达峰浓度
(mg/L)低剂量组 125 27.17±24.60# 32.99±23.14# 0.16±0.11#* 0.008±0.002 14390.23±2584.02#* 16569.89±3450.31#* 27.0±6.7# 242.13±33.89#* 中剂量组 250 47.33±16.26△ 59.05±16.34 0.53±0.28 0.007±0.002 26752.23±7967.03△ 35812.87±9476.48△ 27.5±11.3△ 316.32±63.68△ 高剂量组 500 65.47±8.70 69.06±0.62 0.70±0.15 0.006±0.002 77306.48±27878.03 88014.22±26960.89 40.0±7.7 601.42±147.15 注:表中,#表示低剂量组与高剂量组大鼠的药代动力学参数相比,两者之间的差异具有统计学意义,t=3.60、4.70、7.11、5.50、6.44、3.12、5.83,P均<0.05;△表示中剂量组与高剂量组大鼠的药代动力学参数相比,两者之间的差异具有统计学意义,t=2.41、4.27、4.47、2.24、4.36,P均<0.05;*表示低剂量组与中剂量组大鼠的药代动力学参数相比,差异有统计学意义,t=3.01、3.62、4.67、2.52,P均<0.05。注:表中,#表示低剂量组与高剂量组大鼠的药代动力学参数相比,两者之间的差异具有统计学意义,t=3.60、4.70、7.11、5.50、6.44、3.12、5.83,P均<0.05;△表示中剂量组与高剂量组大鼠的药代动力学参数相比,两者之间的差异具有统计学意义,t=2.41、4.27、4.47、2.24、4.36,P均<0.05;*表示低剂量组与中剂量组大鼠的药代动力学参数相比,差异有统计学意义,t=3.01、3.62、4.67、2.52,P均<0.05。 -
[1] Fenton BM, Lord EM, Paoni SF. Enhancement of tumor perfusion and oxygenation by carbogen and nicotinamide during single- and multifraction irradiation. Radiat Res, 2000, 153(1): 75-83. [2] Janssens GO, Rademakers SE, Terhaard CH, et al. Accelerated radiotherapy with carbogen and nicotinamide for laryngeal cancer: results of a phase Ⅲ randomized trial. J Clin Oncol, 2012, 30(15): 1777-1783. doi: 10.1200/JCO.2011.35.9315 [3] Sharma PK, Dwarakanath BS, Varshney R. Radiosensitization by 2-deoxy-D-glucose and 6-aminonicotinamide involves activation of redox sensitive ASK1-JNK/p38MAPK signaling in head and neck cancer cells. Free Radic Biol Med, 2012, 53(7): 1500-1513. doi: 10.1016/j.freeradbiomed.2012.07.001 [4] 王桂亮, 刘晓秋, 沈秀, 等.尼可胺对H22肝癌荷瘤小鼠的放射增敏作用.天津医药, 2011, 39(5): 442-444. doi: 10.3969/j.issn.0253-9896.2011.05.017
[5] 《化学药物非临床药代动力研究技术指导原则》课题研究组.化学药物非临床药代动力学研究技术指导原则. 3版.北京:中国医药科技出版社, 2005:133-144.
[6] 刘奕芳, 沈维敏, 沈杰, 等.人血浆中茶碱和多索茶碱的HPLC法测定.中国医药工业杂志, 2010, 41(2): 131-133. doi: 10.3969/j.issn.1001-8255.2010.02.018
[7] 姚瑶, 丁从珠, 葛卫红.高效液相色谱法测定甲氨蝶呤对来氟米特在大鼠体内药动学的影响.中国医院药学杂志, 2012, 32(23): 1929-1931.
-






 下载:
下载: