-
电离辐射直接作用于机体,可通过能量沉积或产生自由基造成DNA结构和功能的损伤,从而导致急、慢性放射病甚至致癌等一系列的生物学后果。DNA损伤和修复的程度决定了其生物学的最终结局。近年来,国内外研究表明角质细胞生长因子(keratinocyte growth factor,KGF)可有效防治辐射损伤,且作用迅速、高效,有望成为新的辐射防护细胞因子[1-2]。本实验以137Cs γ射线照射小鼠建立辐射损伤模型,运用单细胞凝胶电泳(single cell gel electrophoresis,SCGE)和微核实验,评价KGF对受照小鼠的遗传保护作用,为研究KGF作为辐射损伤防治药物提供理论依据。
-
KGF购自上海朗月生物科技有限公司,批号为121229。正常熔点和低熔点琼脂糖凝胶购自法国Biowest公司,Tris·HCl、二甲基亚砜、TritonX-100、Giemsa染液均购于美国Sigma公司。水平电泳仪为美国BIO-RAD公司产品,Nikon 90i荧光显微镜购自日本Nikon公司。137Cs源购自加拿大Best Theratronics公司,剂量率1.02 Gy/min。
-
C57BL/6J雄性小鼠40只,无特定病原体级,8~10周龄,体质量20~22 g,购于中国食品药品检定研究院国家啮齿类实验动物种子中心,饲养于天津市实验动物中心。将实验动物随机分为5组,每组8只,分别为:空白对照组、照射对照组、KGF低(1 mg/kg)、中(2 mg/kg)、高(4 mg/kg)剂量组,KGF的3个给药组于照射前给药,连续3 d分别给予腹腔注射1、2、4 mg/kg的KGF,1次/d。照射对照组腹腔注射磷酸盐缓冲液。给药后,空白对照组给予假照射,其余4组均给予7.2 Gy 137Cs γ射线全身一次性照射。
-
参考Banáth等[3]的方法进行操作,步骤如下:①铺胶:照射后立即采用微量眼球取血法取5组小鼠外周血0.05 ml/只,分离淋巴细胞。将100 μl正常熔点琼脂糖凝胶均匀铺于彗星玻片上,置于4 ℃冰箱中固化,将25 μl淋巴细胞悬液与75 μl低熔点琼脂糖凝胶混匀后均匀铺于第一层凝胶上面,置于4 ℃冰箱中固化;②裂解和电泳:将胶板置于新鲜配制的碱性裂解液中,于4 ℃裂解1.5 h;用双蒸水漂洗去掉多余的盐分,置于4 ℃电泳液中解旋20 min,然后在20 V、200 mA的电泳条件下电泳20 min;③染色和观察:采用溴化乙锭染色,双蒸水漂洗,去掉多余染液,于荧光显微镜(40倍物镜)下观察彗星,用图像传感器对每份样品随机拍摄100个彗星图像。采用波兰弗罗茨瓦夫大学(Wroclaw university)提供的慧星分析软件系统对所得彗星图像进行分析。
-
5组小鼠全身照射1 h后,脱颈椎处死并取两侧股骨,剪去骨两端,用2 ml胎牛血清(美国Gibco公司)冲洗骨髓,直至骨髓腔发白为止。将骨髓冲洗液以200×g离心8 min,除去约0.5 ml胎牛血清外,弃多余上清,将沉淀悬浮混匀。在每个载玻片上滴1滴混匀液,推片后自然干燥,于冰乙酸:甲醇为1:3的固定液中固定10 min,晾干后于10%的Giemsa染液中染色2 min,用pH 6.8的K2HPO3:Na2HPO3为1:1的缓冲液洗涤背景。晾干后,在油镜下计数每只动物1000个骨髓嗜多染红细胞(polychromatic erythrocytes,PCE)并统计其微核发生率,计数每只动物200个骨髓细胞并统计其中PCE与正染红细胞(normochromatic erythrocytes,NCE)的比例。
-
应用SPSS13.0统计学软件对彗星尾部DNA百分含量、尾长、尾矩、Olive尾矩、微核率、PCE/NCE值等所有数据进行统计学处理,数据均以均数±标准差(x±s)表示,多组比较采用单因素方差分析,组间两两比较采用最小显著差数法,P < 0.05为差异有统计学意义。
-
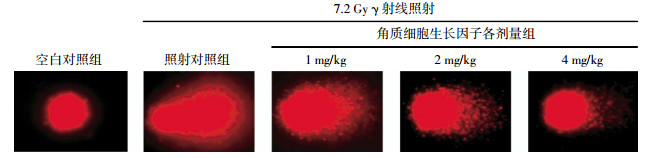
各实验组小鼠彗星尾部DNA百分含量、尾长、尾矩、Olive尾矩分别见图 1和表 1。结果显示,小鼠接受7.2 Gy γ射线全身一次性照射后,照射对照组各项指标与空白对照组相比均明显升高,差异有统计学意义(t=6.226、9.520、3.924和5.369,P均 < 0.01),提示造模成功。与照射对照组相比,KGF低剂量组各项指标差异均无统计学意义,中剂量组各项指标差异均有统计学意义(t=2.385、3.188、2.733和2.892,P分别为 < 0.05、 < 0.01、 < 0.01和 < 0.01),高剂量组的差异更加明显(t=3.189、6.987、3.648和3.097,P均 < 0.01)。以上结果提示KGF可促进小鼠淋巴细胞DNA损伤的修复,且修复能力与KGF的给药剂量存在一定相关性。
组别 只数 尾部DNA百分含量(%) 尾长(μm) 尾矩 Olive尾矩 空白对照组 8 1.22±2.76 7.24±7.09 0.31±1.04 0.49±0.90 照射对照组 8 4.72±5.20 19.73±13.90 1.83±3.92 1.93±2.57 KGF低剂量组 8 5.21±4.31 20.22±14.06 1.62±3.06 1.76±2.00 KGF中剂量组 8 3.65±3.15 16.35±8.96 0.85±1.10 1.31±1.00 KGF高剂量组 8 3.41±1.37 13.04±4.08 0.32±0.26 0.59±0.34 F值 17.731 35.950 8.194 10.814 P值 <0.01 <0.01 <0.01 <0.01 注:表中,KGF:角质细胞生长因子。 表 1 各组小鼠彗星尾部DNA百分含量、尾长、尾矩、Olive尾矩的比较
-
各实验组小鼠微核率、PCE/NCE值结果见表 2。结果显示,小鼠接受7.2 Gy γ射线全身一次性照射后,与空白对照组相比,照射对照组微核率显著升高,PCE/NCE值显著降低,差异均有统计学意义(t=5.336和4.511,P均 < 0.01),提示造模成功。与照射对照组相比,KGF低剂量组微核率显著降低(t=3.805,P < 0.01),PCE/NCE值明显升高(t=2.181,P < 0.05);中剂量组和高剂量组微核率显著降低(t=4.391和4.935,P均 < 0.01),PCE/NCE值显著升高(t=3.914和7.312,P均 < 0.01)。以上结果提示KGF可减少辐射引起的染色体异常,且可能减轻辐射引起的骨髓抑制。
组别 只数 微核率(‰) PCE/NCE值 空白对照组 8 3.00±1.00 2.0±0.7 照射对照组 8 77.60±13.81 0.6±0.2 KGF低剂量组 8 26.67±12.40 1.4±0.8 KGF中剂量组 8 18.83±8.30 1.5±0.3 KGF高剂量组 8 9.00±4.94 2.7±0.5 F值 9.056 14.118 P值 <0.01 <0.01 注:表中,KGF:角质细胞生长因子;PCE:嗜多染红细胞;NCE:正染红细胞。 表 2 各组小鼠微核率、PCE/NCE值的比较
-
随着放射性核素工业应用及电离辐射医学应用的发展,辐射损伤的防治显得尤为重要。DNA损伤是电离辐射的最初效应,电离辐射通过能量沉积或激活氧自由基直接或间接导致DNA损伤[4]。DNA损伤及修复的程度决定了放射性疾病的转归,因此,减轻辐射导致的DNA损伤或者促进DNA损伤的修复可有效防治放射性疾病的发生。
SCGE可在细胞水平上评价DNA损伤的程度,该技术不仅能从单细胞水平上检测DNA链的断裂程度,还可以根据DNA链断裂的量化指标,进一步分析辐照后不同时相点DNA的残余量,从而揭示了DNA的修复过程。Szerencsi等[5]采用该技术比较了核磁共振与60Co γ射线对人外周血白细胞DNA的损伤程度。本研究运用SCGE检测各组小鼠接受7.2 Gy全身照射后外周血淋巴细胞DNA的损伤程度,评价KGF对受照小鼠DNA损伤的保护作用。结果显示,7.2 Gy照射后小鼠DNA的损伤明显,但与照射对照组相比,照前给予2、4 mg/kg的KGF对辐射损伤小鼠均表现出明显的遗传保护作用,提示KGF可以显著促进DNA的损伤修复。
微核实验是一种常用的细胞遗传学方法,真核细胞经辐射作用后可产生微核。微核发生率可评价染色体损伤的程度,PCE/NCE值可反映受照后骨髓抑制程度。本研究运用此实验技术检测各组小鼠接受7.2 Gy全身照射后骨髓细胞的损伤程度。结果显示,7.2 Gy照射后小鼠外周血淋巴细胞的微核率明显增加,与照射对照组相比,KGF给药组均可明显降低细胞微核发生率,提高照射后PCE/NCE值,表明KGF可减轻辐射引起的染色体异常及骨髓抑制。
KGF最初在肺成纤维细胞的培养液中发现,由间质细胞产生,特异地作用于上皮细胞表面的成纤维细胞生长因子受体2b,参与细胞分化、增殖、DNA修复、清除活性氧等诸多生物学过程。近年来,由于对皮肤[6]、肺[7]、胃肠[8]等器官的辐射保护作用以及免疫重建[9]作用,KGF成为各国辐射损伤防护的研究热点,但其对于辐射损伤的遗传保护作用却鲜有研究。KGF可修复或减轻氧自由基介导肺组织上皮细胞的DNA损伤[10],推测其可提高DNA断裂链的修复。本研究结果表明,KGF具有显著的遗传保护作用,且能够减轻辐射引起的骨髓抑制,有望成为新型辐射损伤防治药物。
角质细胞生长因子对受照小鼠的遗传保护作用
Keratinocyte growth factor pretreatment prevents radiation-induced genetics damage in a mouse model
-
摘要:
目的 应用单细胞凝胶电泳(SCGE)和微核实验探讨角质细胞生长因子(KGF)对受照小鼠的遗传保护作用。 方法 将40只C57BL/6J小鼠随机分为空白对照组、照射对照组、KGF低(1 mg/kg)、中(2 mg/kg)、高(4 mg/kg)剂量组5组。KGF的3个给药组于照射前给药,连续3 d分别给予腹腔注射1、2、4 mg/kg的KGF,1次/d。照射对照组腹腔注射磷酸盐缓冲液。给药后,空白对照组给予假照射,其他4组给予7.2 Gy 137Cs γ射线全身一次性照射。应用SCGE和微核实验检测5组小鼠的DNA损伤情况。 结果 与照射对照组相比,KGF低剂量组小鼠的DNA微核率显著降低,中、高剂量组的彗星尾矩、Olive尾矩和微核率均显著降低。 结论 KGF对受照小鼠有显著的遗传保护作用。 Abstract:Objective To study the protective effect of keratinocyte growth factor (KGF) in genetics damage induced by radiation using the methods of single cell gel electrophoresis (SCGE) and micronuclei assay. Methods The C57BL/6J mice were randomly divided into five groups:control group, radiation group and low, middle, high dose groups of KGF(1, 2, 4 mg/kg). Drugs were administrated by intraperitoneal injection. Then control group was given sham-irradiated, and other groups were given a whole body irradiation at the dose of 7.2 Gy with γ-rays. DNA damage of different groups were detected by SCGE and micronuclei assay. Results Compared with radiation group, pretreatment with KGF can significantly decrease the tail moment and micronucleus formation. Conclusion Pretreatment with KGF can effectively protect the radiation-induced genetics damage in mouse model. -
Key words:
- Fibroblast growth factor /
- Radiation injuries /
- Comet assay /
- Micronucleus tests
-
表 1 各组小鼠彗星尾部DNA百分含量、尾长、尾矩、Olive尾矩的比较
组别 只数 尾部DNA百分含量(%) 尾长(μm) 尾矩 Olive尾矩 空白对照组 8 1.22±2.76 7.24±7.09 0.31±1.04 0.49±0.90 照射对照组 8 4.72±5.20 19.73±13.90 1.83±3.92 1.93±2.57 KGF低剂量组 8 5.21±4.31 20.22±14.06 1.62±3.06 1.76±2.00 KGF中剂量组 8 3.65±3.15 16.35±8.96 0.85±1.10 1.31±1.00 KGF高剂量组 8 3.41±1.37 13.04±4.08 0.32±0.26 0.59±0.34 F值 17.731 35.950 8.194 10.814 P值 <0.01 <0.01 <0.01 <0.01 注:表中,KGF:角质细胞生长因子。 表 2 各组小鼠微核率、PCE/NCE值的比较
组别 只数 微核率(‰) PCE/NCE值 空白对照组 8 3.00±1.00 2.0±0.7 照射对照组 8 77.60±13.81 0.6±0.2 KGF低剂量组 8 26.67±12.40 1.4±0.8 KGF中剂量组 8 18.83±8.30 1.5±0.3 KGF高剂量组 8 9.00±4.94 2.7±0.5 F值 9.056 14.118 P值 <0.01 <0.01 注:表中,KGF:角质细胞生长因子;PCE:嗜多染红细胞;NCE:正染红细胞。 -
[1] 苗莉, 缪竞诚.细胞因子在急性辐射损伤治疗中的作用.国际放射医学核医学杂志, 2006, 30(3): 173-176. doi: 10.3760/cma.j.issn.1673-4114.2006.03.014
[2] 傅成波, 王宝勤.角质细胞生长因子及其辐射防护作用.中华放射医学与防护杂志, 2001, 21(2): 140-142. doi: 10.3760/cma.j.issn.0254-5098.2001.02.034
[3] Banáth JP, Fushiki M, Olive PL. Rejoining of DNA single- and double-strand breaks in human white blood cells exposed to ionizing radiation. Int J Radiat Biol, 1998, 73(6): 649-660. doi: 10.1080/095530098141906 [4] Acharya S, Sanjeev G, Bhat NN, et al. The effect of electron and gamma irradiation on the induction of micronuclei in cytokinesis-blocked human blood lymphocytes. Radiat Environ Biophys, 2009, 48(2): 197-203. doi: 10.1007/s00411-008-0209-5 [5] Szerencsi A, Kubinyi G, Váliczkó E, et al. DNA integrity of human leukocytes after magnetic resonance imaging. Int J Radiat Biol, 2013[2013-05-28]. http://informahealthcare.com/doi/abs/10.3109/09553002.2013.804962. [published online ahead of print Jun 12, 2013]. [6] Nakayama F, Hagiwara A, Kimura M, et al. Evaluation of radiation-induced hair follicle apoptosis in mice and the preventive effects of fibroblast growth factor-1. Exp Dermatol, 2009, 18(10): 889-892. doi: 10.1111/j.1600-0625.2009.00849.x [7] Liu CJ, Ha XQ, Jiang JJ, et al. Keratinocyte growth factor(KGF)gene therapy mediated by an attenuated form of Salmonella typhi-murium ameliorates radiation induced pulmonary injury in rats. J Radiat Res, 2011, 52(2): 176-184. doi: 10.1269/jrr.10148 [8] Cai Y, Wang W, Liang H, et al. Keratinocyte growth factor pretreatment prevents radiation-induced intestinal damage in a mouse model. Scand J Gastroenterol, 2013, 48(4): 419-426. doi: 10.3109/00365521.2013.772227 [9] Kelly RM, Highfill SL, Panoskaltsis-Mortari A, et al. Keratinocyte growth factor and androgen blockade work in concert to protect against conditioning regimen-induced thymic epithelial damage and enhance T-cell reconstitution after murine bone marrow transplantation. Blood, 2008, 111(12): 5734-5744. doi: 10.1182/blood-2008-01-136531 [10] Takeoka M, Ward WF, Pollack H, et al. KGF facilitates repair of radiation-induced DNA damage in alveolar epithelial cells. Am J Physiol, 1997, 272(6 Pt 1): L1174-L1180. -






 下载:
下载: