-
脑胶质瘤在治疗上主要采用手术加术后放射治疗,而部分不能手术或者拒绝手术的患者,单纯放疗可能是唯一的治疗方法。但是目前的治疗效果令人不甚满意,治疗失败的主要原因为局部肿瘤未控和复发。有研究表明,脑胶质瘤是干细胞疾病,干细胞的放射抵抗可能是治疗失败的根源[1-2]。因此,研究脑胶质瘤干细胞的放射敏感性及其可能的原因显得尤为重要。为此,本研究选用人脑胶质瘤细胞系U87,采用免疫流式分选技术,分选出人脑胶质瘤干细胞,在研究放射敏感性的基础上进一步研究DNA双链断裂的损伤修复。
-
人脑胶质瘤细胞系U87购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所,U87细胞常规培养于DMEM培养液(含10%胎牛血清)中,置于5%CO2孵箱37 ℃孵育。DMEM培养基培养传代至所需数量,收集U87细胞,加入含20 ng/μl重组人碱性成纤维生长因子(basic fibroblast growth factor,bFGF)、20 ng/μl重组人表皮生长因子(epidermal growth factor,EGF)、20 ng/μl B27添加剂的DMEM/F12无血清培养液(bFGF、EGF购自美国Invitrogen公司,B27购自美国Gibco公司)中继续培养1周,获取CD133+细胞富集的悬浮肿瘤细胞球。
-
收集CD133+细胞富集的肿瘤细胞球,用0.25%胰酶消化吹打成单细胞悬液,然后标上AC133抗体(德国Miltenyi Biote公司),以藻红蛋白标记的鼠抗人免疫球蛋白G1(德国Miltenyi Biote公司)作为对照标记。经美国Beckman Coulter流式细胞仪分选,收集CD133+和CD133-细胞。
-
将分选后的CD133+细胞加入干细胞培养液中培养24 h,CD133-细胞加入含血清的DMEM培养液中培养24 h,随后收集细胞,制备成单细胞悬液并调整至一定浓度后接种于经0.1%多聚左旋赖氨酸(美国Sigma公司)预处理的6孔培养板中。待细胞完全贴壁后,用德国西门子公司Primus直线加速器6 MV X射线垂直照射。源靶距100 cm,吸收剂量率2 Gy/min,每组细胞分别以假照射(0 Gy)和4 Gy剂量照射。照射后置于5%CO2孵箱37 ℃培养12 d后终止培养。用磷酸盐缓冲液冲洗培养板2遍,1 ml甲醇固定10 min,0.1%姬姆萨液100 μl染色15 min。用清水冲去多余染料,待自然干燥后计数每孔中形成的克隆数(≥50个细胞为计数克隆的标准)。克隆形成率(%)=细胞克隆数/接种细胞数×100%。
-
将分选后的CD133+、CD133-细胞培养24 h,再按1.3节中的方法进行照射。分别于照射后0.5、6、24 h进行中性单细胞凝胶电泳实验,并以假照射条件下的细胞作为对照。中性单细胞凝胶电泳实验参照张军宁等[3]的方法并进行调整,具体操作方法如下:①将正常熔点琼脂糖(0.9%)100 μl均匀铺在磨砂载玻片上,然后将100 μl约含1000个细胞的低熔点琼脂糖(0.8%)均匀铺在其上面;②将玻片浸入新配的中性裂解液(2 mol/L NaCl,30 mmol/L乙二胺四乙酸,10 mmol/L Tris,1%肌氨酸钠,1% Triton X?鄄100,10%二甲基亚砜,pH 8.2~8.5;NaCl、乙二胺四乙酸、二甲基亚砜购自上海恒信化学试剂有限公司,Tris、肌氨酸钠、Triton X-100购自北京索来宝公司)中,于4 ℃裂解2 h;③取出玻片,用磷酸盐缓冲液浸没漂洗3次;④将玻片置于0.5%TBE电泳缓冲液(2 mmol/L乙二胺四乙酸,90 mmol/L Tris,90 mmol/L硼酸,pH 8.2~8.5;硼酸购自上海恒信化学试剂有限公司)中解旋30 min后,在电压30 V、电流18 mA的条件下电泳30 min;⑤取出玻片用2 μg/ml的溴化乙锭100 μl染色,在荧光显微镜下随机摄取彗星图像。
-
将分选后的CD133+、CD133-细胞爬片培养24 h,再按1.3节中的方法进行照射。分别于照射后0.5、6、24 h进行以下处理,并以假照射条件下的细胞作为对照。具体步骤如下:①多聚甲醛固定10 min后,用0.5% TritonX?鄄100 4 ℃通透30 min;②用含10%羊血清封闭液室温封闭1 h;③用γ-H2AX一抗(美国Upstate Biotechnology公司)以1:500的比例或Rad51一抗(英国Abcam公司)以1:200的比例4 ℃孵育过夜;④加入1:500稀释的羊抗小鼠二抗Alexa Fluor 633(美国Invitrogen公司)或1:1000稀释的羊抗小鼠二抗Alexa Fluor 488(美国Invitrogen公司)室温避光孵育1 h;⑤用碘化丙啶(美国Invitrogen公司)避光常温染核10 min;⑥用抗荧光淬灭封片液封片。以上各步骤完成后均用磷酸盐缓冲液漂洗3次。用德国Leica激光共聚焦显微镜随机扫描各组γ-H2AX或Rad51荧光灶。每个实验重复3遍,取平均值。
-
采用SPSS 17.0软件进行统计学分析,所有实验结果均用$\bar x \pm s$表示,组间比较采用独立样本t检验,P < 0.05表示差异有统计学意义。
-
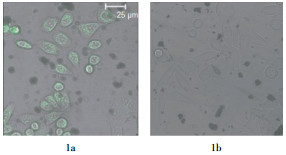
本实验中,由于U87单细胞悬液中加入了藻红蛋白标记的CD133抗体,经过流式细胞仪分选后,得到细胞膜表面有CD133表达的细胞(CD133+细胞)和无CD133表达的细胞(CD133-细胞),见图 1。
-
U87细胞系在假照射条件下,CD133+和CD133-细胞的克隆形成率分别为5.33%和1.50%,前者显著高于后者(t=3.66,P < 0.01);4 Gy照射后,CD133+细胞的克隆形成率为4.50%,与假照射组相比差异无统计学意义(t=0.71,P > 0.05),CD133-细胞的克隆形成率为0.33%,与假照射组相比明显下降(t=2.91,P < 0.05)。实验结果表明,CD133+细胞的放射敏感性显著低于CD133-细胞。
-
采用中性单细胞凝胶电泳实验初步研究分选后的干细胞及非干细胞在0 Gy和4 Gy照射后0.5、6、24 h的DNA双链断裂情况。DNA双链断裂水平通过尾力矩表示。实验中发现,假照射条件下,CD133+和CD133-细胞的DNA双链断裂程度差异无统计学意义(t=1.67,P > 0.05);4 Gy照射后0.5 h,两种细胞的DNA双链断裂程度均明显增加,但损伤程度差异无统计学意义(t=1.44,P > 0.05);4 Gy照射后6、24 h,CD133+细胞的DNA双链断裂程度与CD133-细胞相比均有下降(t=5.31和8.09,P < 0.01),其中,CD133-细胞在照射后24 h的DNA双链断裂程度接近假照射时水平(t=1.56,P > 0.05),而CD133+细胞的DNA双链断裂程度进一步减小,至24 h时已经远远低于假照射时的水平(t=16.28,P < 0.01)。实验结果表明,CD133+和CD133-细胞在4 Gy照射后的DNA损伤均有一定程度的修复,而前者的修复能力远远高于后者(表 1,图 2)。
细胞 样本数 假照射 照后0.5h 照后6h 照后24h CD133- 150 1.52±0.14 5.36±0.26 2.31±0.14 1.91±0.22 CD133+ 150 1.26±0.07 4.99±0.04 1.23±0.15 0.17±0.02 表 1 CD133+和CD133-脑胶质瘤U87细胞在4 Gy X射线照射后不同时间DNA尾力矩的测定结果(
$\bar x \pm s$ 实验中进一步采用γ-H2AX作为辐射后DNA双链断裂损伤的观察指标。实验结果发现,假照射条件下,CD133+和CD133-细胞均有γ-H2AX灶的低水平表达(t=0.28,P > 0.05);4 Gy照射后0.5 h,CD133+和CD133-细胞的γ-H2AX灶表达水平显著上升(t=16.37和12.48,P < 0.01),而两者间差异无统计学意义(t=0.12,P > 0.05),且在照射后6 h两种细胞的γ-H2AX灶的表达仍维持在较高的水平,但两者间差异仍无统计学意义(t=0.99,P > 0.05);照射后24 h,两种细胞的γ-H2AX灶的表达水平明显下降(t=8.64和5.02,P < 0.01),且CD133+细胞的下降程度明显大于CD133-细胞(t=4.99,P < 0.01)。这种结果可能与CD133+细胞的修复能力远高于CD133-细胞有关(表 2,图 3)。
细胞 样本数 假照射 照后0.5h 照后6h 照后24h CD133+ 100 11.76±2.78 74.09±2.60 60.52±9.30 41.39±2.75 CD133- 100 10.39±3.99 74.59±3.25 70.36±3.48 56.82±1.42 表中,γ-H2AX:磷酸化组蛋白H2AX。 表 2 CD133+和CD133-脑胶质瘤U87细胞在4 Gy X射线照射后不同时间γ-H2AX灶的表达率(
$\bar x \pm s$ -
同源重组是哺乳动物DNA双链断裂重要的修复方式,Rad51荧光灶被认为是同源重组修复的标志[4]。本研究中CD133+和CD133-细胞在假照射时的Rad51灶表达率差异无统计学意义(t=2.41,P > 0.05);4 Gy照射后0.5 h内就能检测到Rad51灶的高表达(t=36.65和32.80,P < 0.01),而这两种细胞之间的表达率差异无统计学意义(t=1.12,P > 0.05);照射后6 h,CD133+细胞Rad51灶的表达率与照射后0.5 h相比仍维持在较高水平(t=1.91,P > 0.05),而CD133-细胞则下降(t=20.64,P < 0.01),两种细胞之间的表达率差异有统计学意义(t=22.88,P < 0.01);照射后24 h,CD133+细胞Rad51灶的表达率与CD133-细胞相比差异有统计学意义(t=12.43,P < 0.01),而CD133+细胞的Rad51灶的表达率与照射后6 h相比无明显变化(t=0.47,P > 0.05),即照射后6~24 h,CD133+细胞的Rad51灶的表达率未见明显变化,CD133-细胞的Rad51灶的表达率与照射后6 h相比继续降低(t=2.86,P < 0.05)。这一结果表明CD133+和CD133-细胞在辐照初期均有修复,但随着时间的增加,CD133+细胞在24 h内仍能保持在较高的修复水平,而CD133-细胞的修复能力持续下降(表 3,图 4)。
细胞 样本数 假照射 照后0.5h 照后6h 照后24h CD133+ 100 24.48±0.43 72.72±2.98 69.54±1.11 68.29±2.43 CD133- 100 22.56±0.67 68.61±2.13 37.93±0.83 33.14±1.46 表中,Rad51:一种同源重组修复蛋白。 表 3 CD133+和CD133-脑胶质瘤U87细胞在4 Gy X射线照射后不同时间Rad51灶的表达率(
$\bar x \pm s$ -
近年来的研究认为,脑胶质瘤中存在极少量的一些细胞,它们在脑胶质瘤的发生、发展中起着决定性的作用,即脑胶质瘤干细胞[1]。Singh等[5]通过体外培养发现,移植100个CD133+胶质瘤细胞即能形成肿瘤,而移植1×106个CD133-细胞却不能形成肿瘤,只是在注射部位形成胶质瘢痕。这提示CD133+胶质瘤细胞可能是肿瘤干细胞。目前对脑胶质瘤干细胞放射敏感性的研究更多的是基于CD133+细胞富集的干细胞球,但是其中的CD133+细胞也只占很少一部分。因此,采用免疫流式分选技术分选出CD133+和CD133-细胞进行研究则更有意义。
在实验放射肿瘤学中,克隆形成分析法被认为是离体检测细胞内在放射敏感性的“金标准”。本实验中首先采用克隆形成法研究分选后细胞的放射敏感性,结果发现CD133+和CD133-细胞经4 Gy照射后,前者的克隆形成率无明显变化,而后者则显著下降,且在照射前CD133+细胞的克隆形成率就明显高于CD133-细胞,表明CD133+细胞有着明显的辐射抗性,这也与Bao等[2]报道的结果相同。
辐射作用的主要生物靶分子是DNA,辐射所致DNA双链断裂难以修复,是最常见的细胞致死性损伤方式[6]。因此,DNA双链断裂损伤以及其后的修复程度最终决定了细胞是否能够成活。有研究发现,CD133+和CD133-脑胶质瘤细胞亚群在受到相同剂量的照射后所产生的DNA损伤程度相同,但CD133+脑胶质瘤细胞亚群的DNA损伤后的修复效率更高[2]。采用Olive等[7]建立的中性微凝胶电泳技术在检测DNA双链断裂的实验中发现,CD133+和CD133-细胞在假照射时的DNA双链断裂程度并没有不同,4 Gy照射后两种细胞DNA的损伤程度也无明显差别。但在照射后24 h,CD133+细胞的DNA损伤程度与CD133-细胞相比明显减少,甚至低于假照射时的DNA损伤水平。该结果表明CD133+细胞的修复程度远高于CD133-细胞。
DNA损伤后会产生一系列的损伤应答反应,其中,效应器H2AX的迅速磷酸化被认为是DNA双链断裂修复过程中最早且最具有决定性的事件[8-9]。研究发现,γ-H2AX能够被快速诱导,其特异性荧光抗体能够在DNA双链断裂周围形成灶,γ-H2AX灶和DNA双链断裂在数量上具有一一对应的关系[10]。因此,γ-H2AX也被认为是DNA双链断裂的标志。通过间接免疫荧光技术观察照射后不同时间点γ-H2AX灶的变化情况,可以判断肿瘤干细胞及非干细胞受到照射后DNA双链断裂的损伤及修复情况。本实验中发现CD133+和CD133-细胞经4 Gy照射后0.5 h,γ-H2AX荧光灶的表达率基本相同,照射后24 h,两种细胞γ-H2AX灶的表达率均有下降,且CD133+细胞γ-H2AX灶的表达率下降程度明显大于CD133-细胞,这与以上中性单细胞凝胶电泳的结果一致。
DNA双链断裂修复的主要方式包括核苷酸切除修复、碱基切除修复、错配修复、同源重组修复和非同源性末端连接。有研究表明,同源重组修复在人脑胶质瘤细胞DNA双链断裂的修复中起主导作用[11],Rad51灶被认为是同源重组修复的标志[4]。Rad51灶是具有酶活力的亚核结构,电离辐射等引起DNA双链断裂修复过程中,Rad51灶的形成是非常重要的步骤,在电离辐射等导致DNA损伤中有较高的水平[12]。Amy等[6]检测了人脑胶质瘤U87细胞经2 Gy照射后Rad51灶的表达情况,结果发现照射后1 h内就能检测到Rad51灶的表达,1 h后表达开始减少,并在24 h后回到假照射时水平。本实验发现,CD133+和CD133-细胞经4 Gy照射后0.5 h即可检测到Rad51灶的表达,且两者的表达率差异无统计学意义;照射后6、24 h,CD133+细胞Rad51灶的表达率仍维持在较高水平,变化不大,但在U87细胞中占较大比例的CD133-细胞的Rad51灶的表达率明显下降,接近假照射时水平。由此看来,随着修复时间的延长,CD133-细胞的Rad51灶的表达率显著下降,而CD133+细胞仍然维持在较高水平。这可能是由于CD133+细胞经电离辐射后对DNA双链断裂修复的“保持能力”高于CD133-细胞。
由此可见,CD133+细胞的放射敏感性低于CD133-细胞,这种现象的原因可能是电离辐射后CD133+细胞对DNA双链断裂的修复能力高于CD133-细胞。
CD133+ U87人脑胶质瘤干细胞放射敏感性和DNA双链断裂损伤修复的实验研究
CD133 positive U87 glioma stem cell radiosensitivity and DNA double-strand break repair
-
摘要:
目的 探讨CD133+ U87人脑胶质瘤干细胞放射敏感性及DNA双链断裂损伤修复的情况。 方法 选择人脑胶质瘤U87细胞系,采用免疫流式分选技术分选出CD133+、CD133-细胞;采用克隆形成实验研究细胞的放射敏感性;采用中性单细胞凝胶电泳实验检测4 Gy X射线垂直照射后不同时间点的DNA双链断裂;采用间接免疫荧光技术检测不同时间点磷酸化组蛋白H2AX(γ-H2AX)荧光灶、Rad51(一种同源重组修复蛋白)荧光灶的表达。 结果 假照射条件下,CD133+细胞克隆的形成率明显高于CD133-细胞(t=3.66,P < 0.01);CD133+细胞经4 Gy照射后的克隆形成率无明显变化(t=0.71,P > 0.05),而CD133-细胞经4 Gy照射后的克隆形成率下降(t=2.91,P < 0.05)。4 Gy照射后0.5 h,CD133+、CD133-细胞间尾力矩差异无统计学意义(t=1.44,P > 0.05),照射后6、24 h,CD133+细胞尾力距下降程度大于CD133-细胞(t=5.31和8.09,P < 0.01);照射后0.5、6 h,CD133+、CD133-细胞间γ-H2AX灶的表达率差异均无统计学意义(t=0.12和0.99,P > 0.05),照射后24 h,CD133+细胞的γ-H2AX灶的表达率下降程度大于CD133-细胞(t=4.99,P < 0.01);照射后0.5 h,CD133+、CD133-细胞间Rad51灶的表达率差异无统计学意义(t=1.12,P > 0.05),照射后6、24 h,CD133-细胞的Rad51灶的表达率与CD133+细胞相比明显下降(t=22.88和12.43,P < 0.01),而CD133+细胞无明显变化。 结论 CD133+ U87人脑胶质瘤干细胞具有放射抵抗性,可能与其照射后DNA双链的断裂修复能力较高有关。 Abstract:Objective To explore the radiosensitivity and DNA double-strand break repair of CD133+ U87 glioma stem cell. Methods CD133+ and CD133- cells were isolated from glioma U87 cell lines by flow cytometry sorter system. After irradiated vertically by 4 Gy X-rays, the radiosensitivity of cells was determined by clonogenic assay. The radiation-induced DNA double-strand break repair of CD133+ and CD133- cells was determined by the neutral comet assay, and the expression of phosphorylated histone H2AX (γ-H2AX) and Rad51 foci were measured by immunofluorescence. Results The clone forming rate of CD133+ cells was higher than CD133- cells (t=3.66, P < 0.01) with no radiation. The clone forming rate of CD133+ cells irradiated by 4 Gy X-rays has no significant changes compared to that of the non-irradiation cells(t=0.71, P > 0.05), but for CD133- cells, it decreased compared to non-irradiation cells(t=2.91, P < 0.05). The tailmoment between CD133+ cells and CD133- cells had no difference at 0.5 h after irradiation (t=1.44, P > 0.05); the tailmoment of CD133+ cells was lower than CD133- cells at 6 and 24 h after irradiation, respectively(t=5.31 and 8.09, P < 0.01). There was no significant difference in the expression of γ-H2AX foci between CD133+ and CD133- cells at 0.5 and 6 h after irradiation(t=0.12 and 0.99, P > 0.05), γ-H2AX foci of CD133+ cells was significantly decreased compared to CD133- cells at 24 h after irradiation(t=4.99, P < 0.01). For Rad 51 foci, there was no difference between CD133+ and CD133- cells at 0.5 h after irradiation(t=1.12, P > 0.05). The expression of Rad 51 foci of CD133- cells was decreased compared to that of CD133+ cells at 6 and 24 h after irradiation, respectively (t=22.88 and 12.43, P < 0.01). And the expression of Rad51 foci of CD133+ cells had no significant changes at 6-24 h after irradiation. Conclusions Glioma stem cells is more radioresistive than glioma non-stem cells. The probable mechanism is that the DNA double-strand break repair capacity of glioma stem cells is more powerful than non-stem cells. -
Key words:
- Glioma /
- Stem cells /
- Radiation tolerance /
- DNA repair /
- Histones /
- Rad51 recombinase
-
表 1 CD133+和CD133-脑胶质瘤U87细胞在4 Gy X射线照射后不同时间DNA尾力矩的测定结果(
$\bar x \pm s$ 细胞 样本数 假照射 照后0.5h 照后6h 照后24h CD133- 150 1.52±0.14 5.36±0.26 2.31±0.14 1.91±0.22 CD133+ 150 1.26±0.07 4.99±0.04 1.23±0.15 0.17±0.02 表 2 CD133+和CD133-脑胶质瘤U87细胞在4 Gy X射线照射后不同时间γ-H2AX灶的表达率(
$\bar x \pm s$ 细胞 样本数 假照射 照后0.5h 照后6h 照后24h CD133+ 100 11.76±2.78 74.09±2.60 60.52±9.30 41.39±2.75 CD133- 100 10.39±3.99 74.59±3.25 70.36±3.48 56.82±1.42 表中,γ-H2AX:磷酸化组蛋白H2AX。 表 3 CD133+和CD133-脑胶质瘤U87细胞在4 Gy X射线照射后不同时间Rad51灶的表达率(
$\bar x \pm s$ 细胞 样本数 假照射 照后0.5h 照后6h 照后24h CD133+ 100 24.48±0.43 72.72±2.98 69.54±1.11 68.29±2.43 CD133- 100 22.56±0.67 68.61±2.13 37.93±0.83 33.14±1.46 表中,Rad51:一种同源重组修复蛋白。 -
[1] Singh SK, Clarke ID, Terasaki M, et al. Identification of a cancer stem cell in human brain tumors. Cancer Res, 2003, 63(18):5821-5828. [2] Bao S, Wu Q, Mclendon RE, et al. Glioma stem cells promote radioresistance by preferential activation of the DNA damage response. Nature, 2006, 444(7120):756-760. doi: 10.1038/nature05236 [3] 张军宁, 朱寿彭, 洪承皎. 中性单细胞电泳检测肿瘤细胞放射敏感性. 中华放射医学与防护杂志, 2003, 23(3):166-168. doi: 10.3760/cma.j.issn.0254-5098.2003.03.008
[4] Tashiro S, Walter J, Shinohara A, et al. Rad51 accumulation at sites of DNA damage and in postreplicative chromatin. J Cell Biol, 2000, 150(2):283-291. doi: 10.1083/jcb.150.2.283 [5] Singh SK, Hawkins C, Clarke ID, et al. Identification of human brain tumour initiating cells. Nature, 2004, 432(7015):396-401. doi: 10.1038/nature03128 [6] McCord AM, Jamal M, Williams ES, et al. CD133+ glioblastoma stem-like cells are radiosensitive with a defective DNA damage response compared with established cell lines. Clin Cancer Res, 2009, 15(16):5145-5153. doi: 10.1158/1078-0432.CCR-09-0263 [7] Olive PL, Frazer G, Banáth JP. Radiation-induced apoptosis measured in TK6 human B lymphoblast cells using the comet assay. Radiat Res, 1993, 136(1):130-136. [8] Paull TT, Rogakou EP, Yamazaki V, et al. A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage. Curr Biol, 2000, 10(15):886-895. doi: 10.1016/S0960-9822(00)00610-2 [9] Celeste A, Petersen S, Romanienko PJ, et al. Genomic instability in mice lacking histone H2AX. Science, 2002, 296(5569):922-927. doi: 10.1126/science.1069398 [10] Rogakou EP, Pilch DR, Orr AH, et al. DNA double-stranded breaks induce histone H2AX phosphorylation on serine 139. J Biol Chem, 1998, 273(10):5858-5868. doi: 10.1074/jbc.273.10.5858 [11] Golding SE, Rosenberg E, Khalil A, et al. Double strand break repair by homologous recombination is regulated by cell cycle-independent signaling via ATM in human glioma cells. J Biol Chem, 2004, 279(15):15402-15410. doi: 10.1074/jbc.M314191200 [12] Tarsounas M, Davies D, West SC. BRCA2-dependent and independent formation of RAD51 nuclear foci. Oncogene, 2003, 22(8):1115-1123. doi: 10.1038/sj.onc.1206263 -






 下载:
下载: