-
近年来,随着立体定向放射外科、放射治疗设备和技术的飞速发展,放射治疗为适于放射治疗的肿瘤患者提供了非常有效的治疗手段。然而,肿瘤细胞在放射治疗的中后期往往产生不同程度的辐射耐受性,从而降低了放射治疗预期的疗效。因此,充分了解肿瘤细胞产生辐射耐受性的机制和寻求提高辐射耐受性的肿瘤放射治疗的方法和药物,一直是肿瘤放射治疗领域中急需解决的课题。非小细胞肺癌(non-small cell lung cancer,NSCLC)细胞有较强的辐射抗性[1],如何增加NSCLC细胞的辐射敏感性,进而提高放射治疗的效果显得尤为重要。研究发现,环氧化酶2(cyclooxygenase-2,COX-2)在许多恶性肿瘤中高表达,并与辐射敏感性呈负相关[2]。塞来昔布(Celecoxib)是COX-2的特异性抑制剂,具有抗炎镇痛的作用,可阻止炎性前列腺素类物质的产生。本研究主要探讨塞来昔布对NSCLC细胞系H460细胞放疗敏感性的影响,并对其增敏机制进行初步探讨。
-
NSCLC细胞系H460购自中国医学科学院基础医学研究所。Balb/c裸鼠购自中国医学科学院实验动物研究所实验动物中心,饲养于无特殊病原体级实验室。塞来昔布为美国西尔达药厂波多黎各分厂(苏州普强制药分装)生产,规格为3 mg/支。23OOC/D型医用直线加速器购自美国瓦里安公司,室温下剂量率为4 Gy/min。鼠抗人肿瘤毛细血管扩张性共济失调症突变蛋白(ataxia telangiectasis mutated,ATM)单克隆抗体(一抗)和兔抗鼠免疫球蛋白G(immunoglobulin G,IgG)(二抗)为美国Alpha公司产品,由晶美生物工程有限公司(北京)分装,工作浓度为1:200。兔抗人表皮生长因子受体(epidermal growth factor receptor,EGFR)多克隆抗体(一抗)和鼠抗兔IgG(二抗)购自武汉博士德生物工程有限公司,工作浓度为1:100。
-
H460细胞培养于含10%胎牛血清的DMEM培养基中,37 ℃,5%CO2培养箱中常规培养,0.25%胰酶消化传代。
-
Balb/c裸鼠40只,5~6周龄,雌雄各半,体质量达到16~19 g时于大腿部皮下接种H460细胞,0.1 ml/只,浓度约为2×107个/ml瘤细胞。当肿瘤生长到约100 mm3时,认为模型建立成功。
-
模型建立一周后,将模型鼠用完全随机法平均分成4组:A组为塞来昔布+放疗组、B组为放疗组、C组为塞来昔布组、D组为空白对照组。用灌肠法给予塞来昔布,给药剂量为16 mg·kg-1·d-1[3],给药2 h后进行放疗,肿瘤局部放疗采用分次照射,分割剂量为5 Gy/次,2次/周,C和D组不予照射。4周后处死模型鼠,剥离瘤组织进行称重,并制作标本以进行免疫组化检测。
-
采用石蜡包埋肿瘤组织,二甲苯脱蜡、酒精脱苯和水化,切片,用磷酸盐缓冲液冲洗,以过氧化氢阻断内源性过氧化酶的活性,加入50 μl一抗后室温下孵育60 min,再加生物素二抗50 μl(SPKit液),37 ℃孵育10 min,然后加入50 μl链霉亲和素过氧化物酶溶液室温下孵育10 min,加入新鲜配制的3,3′-二氨基联苯胺溶液。冲洗后,用苏木素复染,中性树胶封片,光镜下检测。
-
数据以均数±标准差($\bar x \pm s$)表示,计量资料采用t检验,P < 0.05为差异有统计学意义。
-
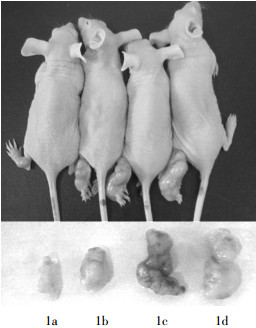
塞来昔布联合放射治疗能显著抑制裸鼠H460细胞的增殖,模型鼠联合治疗后,瘤体明显缩小(图 1),瘤重明显减轻(表 1),与放疗组比较,t=5.41,P < 0.01;与空白对照组比较,t=7.62,P < 0.01。
组别 只数 瘤重( $\bar x \pm s$ 抑瘤率(%) 塞来昔布+放疗组 10 35.51±4.23 72.26 放疗组 10 81.17±8.29 39.10 塞来昔布组 10 130.37±12.59 3.57 空白对照组 10 133.62±12.37 - 注:表中,“-”表示无此项数据。 表 1 各组裸鼠经照射后的肿瘤质量及抑瘤率
-
选取5个不同的视野,5个视野的平均光密度值代表ATM、EGFR的表达水平。平均光密度值越大,表明表达水平越高。表 2中的结果显示,塞来昔布+放疗组与放疗组比较,ATM表达水平明显降低,差异有统计学意义,EGFR表达水平亦降低,差异有统计学意义。
组别 只数 ATM EGFR 塞来昔布+放疗组 10 0.11±0.02* 0.38±0.04# 放疗组 10 0.24±0.03 0.59±0.06 塞来昔布组 10 0.20±0.03 0.53±0.04 空白对照组 10 0.19±0.02 0.51±0.08 注:表中,ATM:毛细血管扩张性共济失调症突变蛋白;EGFR:表皮生长因子受体;*与空白对照组比较,t=2.52,P < 0.01,与放疗组比较,t=4.23,P < 0.01;#与空白对照组比较,t=2.93,P < 0.01,与放疗组比较,t=3.17,P < 0.01。 表 2 免疫组化法对ATM和EGFR平均光密值的统计结果(
$\bar x \pm s$ -
COX-2是催化花生四烯酸转化为前列腺素E的限速酶。炎症刺激可诱导COX-2生成,因而导致炎性前列腺素类物质的合成和聚积,尤其是前列腺素E2,能引起炎症、水肿和疼痛。癌基因的刺激亦可诱导COX-2的产生,具有促进肿瘤发生和发展的作用。塞来昔布是COX-2抑制剂,其可通过抑制COX-2,阻止炎性前列腺素类物质的产生,从而抑制肿瘤的生长,在某些肿瘤中也可增强肿瘤对放射治疗的敏感性,但其机制尚不明确[3]。本实验以COX-2选择性抑制剂塞来昔布为研究对象,证实其能增强荷瘤鼠对放疗的敏感性。ATM基因属于磷脂酰肌醇3激酶家族成员,是P53的靶基因,其编码蛋白主要参与DNA的损伤识别和修复、细胞周期调控等,在乳腺癌的发生发展中起着重要作用,并与多种肿瘤尤其是乳腺癌的患病风险相关[4]。研究表明,ATM基因与肺癌的易感性明显相关,而且与肺癌的病理分级和恶性程度呈正相关,而与肺癌的辐射敏感性呈负相关[5]。EGFR表达于正常上皮细胞表面,而在一些肿瘤细胞中常过表达,EGFR的过表达与肿瘤细胞的转移、浸润、预后差有关[6]。有研究发现,EGFR的高表达也是肺癌细胞产生辐射抵抗的原因,针对EGFR的RNA干扰,可明显增加肺癌的辐射敏感性[7]。本研究发现,塞来昔布可明显影响ATM和EGFR的表达,结果提示塞来昔布可能通过抑制ATM和EGFR的表达,从而增加H460细胞的放疗敏感性。
本研究是对塞来昔布辐射增敏作用的初步探索,尚需深入研究其机理。塞来昔布是选择性抑制剂,对正常肺组织的影响较小,并且有研究表明它具有减轻放射性肺损伤的作用[8]。因此,塞来昔布极有可能成为潜在的肺癌辐射增敏剂。
塞来昔布对非小细胞肺癌移植瘤的辐射增敏实验研究
Radiosensitization on non-small cell lung cancer induced by celecoxib
-
摘要:
目的 建立裸鼠非小细胞肺癌H460细胞动物模型,观察环氧化酶2选择性抑制剂塞来昔布对H460放疗的增敏作用,并对其作用机理进行初步探讨。 方法 将40只荷瘤鼠用完全随机法分成4组,分别为空白对照组、放疗组、塞来昔布组、塞来昔布+放疗组,每组10只。采用灌肠法给予塞来昔布16 mg·kg-1·d-1,给药2 h后进行放疗,放疗分割剂量为5 Gy/次,2次/周,4周后处死所有荷瘤鼠,解剖瘤块称重。采用免疫组化方法分析毛细血管扩张性共济失调症突变蛋白(ATM)和表皮生长因子受体(EGFR)表达的变化。 结果 空白对照组、塞来昔布组、放疗组、塞来昔布+放疗组肿瘤瘤重分别为(133.62±12.37)、(130.37±12.59)、(81.17±8.29)、(35.51±4.23)mg,塞来昔布+放疗组与放疗组比较差异有统计学意义(t=5.41,P < 0.01)。塞来昔布+放疗组的ATM和EGFR表达水平明显降低,与放疗组比较差异有统计学意义(t=4.23和3.17,P均 < 0.01)。 结论 塞来昔布可能通过降低ATM和EGFR的表达水平,增强H460细胞的放疗敏感性,将来可能具有较好的临床应用价值。 Abstract:Objective To establish the nude mice model of non-small cell lung cancer(NSCLC)H460 cell to investigate the combined effects of radiotherapy and celecoxib. Methods Athymic mice bearing H460 were randomly divided into 4 groups:control, radiotherapy, celecoxib and radiotherapy plus celecoxib group. The administration dose of celecoxib was 16 mg·kg-1·d-1. The mice were treated with radiotherapy 2 hours after administration and the fractionated dose was 5 Gy, 2 fractions per week. Mice were killed to detect tumor weight 4 weeks after treatment. The expression levels of ataxia telangiectasis mutated(ATM)and epidermal growth factor receptor(EGFR)in tumor tissues were detected by immune-histochmical method. Results The tumor weight in control, radiotherapy, celecoxib and radiotherapy plus celecoxib group were(133.62±12.37), (130.37±12.59), (81.17±8.29) and (35.51±4.23)mg respectively. There was significant difference between the radiotherapy plus celecoxib group and the radiotherapy group(t=5.41, P < 0.01). The expression levels of ATM and EGFR in the radiotherapy plus celecoxib group were significantly lower than that in radiotherapy group(t=4.23 and 3.17, both P < 0.01). Conclusions Celecoxib promotes radiotherapeutic sensitivity of H460 by down-regulating the expression levels of ATM and EGFR. Celecoxib may presents potency in curing human lung cancer. -
Key words:
- Carcinoma, non-small-cell lung /
- Radiation-sensitizing agents /
- Radiotherapy /
- Celecoxib /
-
表 1 各组裸鼠经照射后的肿瘤质量及抑瘤率
组别 只数 瘤重( $\bar x \pm s$ 抑瘤率(%) 塞来昔布+放疗组 10 35.51±4.23 72.26 放疗组 10 81.17±8.29 39.10 塞来昔布组 10 130.37±12.59 3.57 空白对照组 10 133.62±12.37 - 注:表中,“-”表示无此项数据。 表 2 免疫组化法对ATM和EGFR平均光密值的统计结果(
$\bar x \pm s$ 组别 只数 ATM EGFR 塞来昔布+放疗组 10 0.11±0.02* 0.38±0.04# 放疗组 10 0.24±0.03 0.59±0.06 塞来昔布组 10 0.20±0.03 0.53±0.04 空白对照组 10 0.19±0.02 0.51±0.08 注:表中,ATM:毛细血管扩张性共济失调症突变蛋白;EGFR:表皮生长因子受体;*与空白对照组比较,t=2.52,P < 0.01,与放疗组比较,t=4.23,P < 0.01;#与空白对照组比较,t=2.93,P < 0.01,与放疗组比较,t=3.17,P < 0.01。 -
[1] Brondani A, Regner A, Grivicich I, et al. Radioresistance is associated to increased Hsp70 content in human glioblastoma cell lines.Int J Oncol, 2004, 25(3):777-785. [2] Matuschek C, Bölke E, Nawatny J, et al. Bevacizumab as a treatment option for radiation-induced cerebral necrosis. Strahlenther Onkol, 2011, 187(2):135-139. doi: 10.1007/s00066-010-2184-4 [3] Sminia P, Kuipers G, Geldof A, et al. COX-2 inhibitors act as radiosensitizer in tumor treatment. Biomed Pharmacother, 2005, 59 suppl 2:S272-275. [4] Mao C, Chung VC, He BF, et al. Association between ATM 5557G>A polymorphism and breast cancer risk:a meta-analysis. Mol Biol Rep, 2012, 39(2):1113-1118. [5] Roy K, Wang L, Makrigiorgos GM, et al. Methylation of the ATM promoter in glioma cells alters ionizing radiation sensitivity.Biochem Biophys Res Commun, 2006, 344(3):821-826. [6] Sato Y, Ebara T, Sunaga N, et al. Interaction of radiation and gefitinib on a human lung cancer cell line with mutant EGFR gene in vitro. Anticancer Res, 2012, 32(11):4877-4881. [7] Saydam O, Glauser DL, Heid I, et al. Herpes simplex virus 1 amplicon vector-mediated siRNA targeting epidermal growth factor receptor inhibits growth of human glioma cells in vivo. Mol Ther, 2005, 12(5):803-812. doi: 10.1016/j.ymthe.2005.07.534 [8] Khan R, Krasin M, Kasow K, et al. Cyclooxygenase-2 inhibition to treat radiation-induced brain necrosis and edema. J Pediatr Hematol Oncol, 2004, 26(4):253-255. -






 下载:
下载: