-
第二线粒体来源的caspase激活因子(second mitochondria-derived activator of caspases,Smac)也称为低等电点的凋亡抑制蛋白(inhibitors of apoptosis proteins,IAPs)家族直接结合蛋白,是一个从线粒体释放到细胞质中具有促凋亡活性的蛋白[1],它在凋亡信号的刺激作用下,从线粒体释放到细胞质,与IAPs结合并抑制其抗凋亡活性,从而产生促进凋亡的作用。国内外大量科学研究证实,Smac模拟活性小分子可以显著增强化疗以及放疗对肿瘤细胞的凋亡诱导效应[2-6],为未来的肿瘤治疗提供了一种新的手段。而Smac蛋白中N末端的四肽Ala-Val-Pro-Ile(以下简称AVPI)是诱导细胞凋亡的重要部分,本研究中将反式激活蛋白(transactivator,Tat)中既有穿膜特性又无细胞毒性的最小片断Tat9肽与Smac中含有AVPI的N端七肽分子合成了具有细胞穿透性的Tat-SmacN7蛋白。食管癌是人类常见的消化道恶性肿瘤之一,本研究中用Tat-SmacN7蛋白以及γ射线分别或联合处理食管癌109(esophageal carcinoma 109,EC109)细胞,观察Tat-SmacN7蛋白对EC109细胞辐射敏感性的影响。
-
人食管癌细胞系EC109由天津医科大学总医院惠赠,用含10%胎牛血清的RPMI1640培养基(SH3080901B,赛默飞世尔生物化学制品有限公司),置5%CO2、饱和湿度、37 ℃培养箱中培养。EC109细胞为贴壁细胞,每2~3天传代一次,实验用对数生长期细胞。
-
胎牛血清(10099-141,美国invitrogen公司),胰酶(25200-72,美国invitrogen公司),Gammacell 40137Cs γ射线照射源(加拿大原子能有限公司,剂量率为0.71 Gy/min),BioTek多功能Synergy HT酶标仪(美国Gene公司)。anti-Smac(AB32023,英国abcam公司),anti-β-actin(CW0623A,北京康为世纪生物科技有限公司),抗兔二抗(ZB-2301,北京中杉金桥生物技术有限公司),抗鼠二抗(ZB-2305,北京中杉金桥生物技术有限公司),水溶性四唑盐1(water-soluble tetrazolium salt-1,WST-1)(C0035,碧云天生物技术研究所)。
-
将细胞分为空白对照组(不做任何处理)、Tat-SmacN7组(50 μmol/L)、照射组(137Cs γ射线照射源4 Gy照射)和Tat-SmacN7联合照射组(以下简称联合组)(加Tat-SmacN7后4 h进行4 Gy照射)。
-
取对数生长期的EC109细胞,按每孔6×103个细胞接种于96孔板中,细胞贴壁后分组给予相应处理,包括空白对照组、Tat-SmacN7组、照射组和Tat-SmacN7联合照射组,每组6个复孔,空白对照组每孔加100 μl培养基,Tat-SmacN7组和联合组每孔加100 μl Tat-SmacN7稀释液(浓度为50 μmol/L),4 h后照射组和联合组进行4 Gy照射,培养24、48 h后用多功能酶标仪测定492 nm吸光度值,测前4 h加20 μl WST-1共孵。计算细胞生长的抑制率:抑制率(%)=(1-实验组吸光度值/对照组吸光度值)×100%。
-
取对数生长期的EC109细胞,接种到4块不同照射剂量(0、2、4、6 Gy)的六孔板,0 Gy的六孔板内为500个细胞/孔,2 Gy的六孔板内为1000个细胞/孔,4 Gy的六孔板内为2000个细胞/孔,6 Gy的六孔板内为4000个细胞/孔,其中每块板的3个孔为对照孔,3个孔为加药孔。接种细胞后将细胞摇匀,放置到孵箱继续培养,待细胞贴壁后加药孔加Tat-SmacN7溶液使其最终浓度为20 μmol/L,4 h后进行照射,照射完毕后将细胞放孵箱培养14 d左右,固定、染色、计克隆数,以>50个细胞数为一个克隆,计算细胞克隆形成率,绘制存活曲线。
-
按上述分组分别进行细胞蛋白质的提取、定量,等量蛋白采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,半干转膜法转移至聚偏二氟乙烯膜,5%脱脂奶粉封闭3 h,孵育一抗(anti-Smac,1:1000稀释,anti-β-actin,1:500稀释)3 h或过夜。tris-buffered saline and tween 20缓冲液(简称TBST缓冲液)冲洗3次(10 min/次)后孵育二抗(1:2000稀释)1 h,TBST缓冲液冲洗3次(10 min/次)后显影,化学发光凝胶成像系统(411NJC124316,美国Cell Biosciences公司)曝光。
-
实验数据以均数±标准差($\bar x \pm s$)表示,组间均数比较采用SPSS17.0软件中的独立样本t检验,P < 0.05表示差异有统计学意义。
-
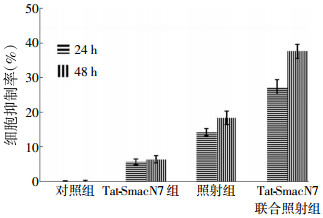
如图 1所示,24 h后,Tat-SmacN7组、照射组和联合组细胞抑制率分别为(5.60±0.82)%、(14.24±1.00)%和(27.36±2.08)%,联合组与Tat-SmacN7组、照射组相比,差异有统计学意义(t=16.821、9.825,P < 0.05);48 h后,Tat-SmacN7组、照射组和联合组细胞抑制率分别为(6.36±1.07)%、(18.35±1.92)%和(37.63±2.03)%,联合组与Tat-SmacN7组、照射组相比,差异有统计学意义(t=23.553、11.930,P < 0.05)。Tat-SmacN7单独对细胞的抑制作用较弱,Tat-SmacN7联合照射具有明显的抑制肿瘤生长作用。Tat-SmacN7对EC109细胞有辐射增敏作用。
-
细胞克隆实验如图 2,随着照射剂量的增大,细胞存活数明显下降,而相同照射剂量下,联合组细胞和照射组细胞相比,细胞的存活数下降,联合组细胞的存活曲线明显下移,说明细胞在Tat-SmacN7的作用下,对辐射的敏感性增强,凋亡增加。
-
为了进一步证明Smac的表达与细胞凋亡的关系,本研究对细胞进行Tat-SmacN7、照射以及联合处理,通过Western blot检测各组细胞Smac蛋白的表达水平,结果发现Tat-SmacN7组和联合组两组的Smac蛋白表达明显增多,照射组的Smac表达水平较对照组多一些(图 3)。
-
X连锁凋亡抑制蛋白(X-linked inhibitor-of-apoptosis protein,XIAP)是IAPs家族中具有潜在抑制活性的一种蛋白质,它可以与caspase-3、caspase-7和caspase-9(3种蛋白酶)直接结合,抑制caspase的活性,从而抑制细胞凋亡的发生。IAPs家族成员的共同特征是含有几个杆状病毒IAPs重复序列。Smac是2000年发现的一种重要的凋亡调节基因,是IAPs特异性的作用靶点,在各种凋亡刺激因素(电离辐射、抗癌药物、DNA损伤和化学信号等)的诱导下,定位于线粒体内的Smac可与细胞色素c一同从线粒体膜间隙释放出来,通过结合XIAP,破坏XIAP与caspase-3以及caspase-9的结合,从而解除了XIAP对caspases家族的抑制作用,促进细胞的凋亡。
细胞凋亡有两条经典的途径:死亡受体途径和线粒体途径。Smac在促进肿瘤细胞凋亡的机制上参与了两条途径。在线粒体凋亡途径中,Smac蛋白通过其AVPI 4个疏水氨基酸残基同XIAP的杆状病毒IAPs重复序列2或杆状病毒IAPs重复序列3结合,这两个结构域正是XIAP抑制caspase活性的结合位点,从而促进细胞凋亡。在死亡受体途径中,肿瘤坏死因子相关的凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)是细胞凋亡的死亡受体途径中的重要因子。肿瘤坏死因子家族成员与相应的肿瘤坏死因子受体家族成员结合,启动procaspase-8自身切割并形成成熟的caspase-8。通过TRAIL激活caspase-8的级联反应,可促使成熟的Smac蛋白迅速释放到细胞质中。Smac蛋白再与XIAP结合并消除对caspase-3的抑制作用,并使caspase-8激活caspase-3,通过caspase级联反应诱导靶细胞凋亡[7]。实验表明,Smac的高表达可促进TRAIL诱导的caspase-8和Bid(一种凋亡诱导蛋白)的加工及细胞色素c的释放,进一步引起caspase-3的激活及缩短的Bid形成,从而促进细胞凋亡[8]。SmacN7是Smac氨基端的7个氨基酸序列,也是Smac最小的功能单位,我们前期实验证明了SmacN7结合Tat引导肽后可以顺利穿透细胞[9]。研究表明Smac蛋白对正常细胞没有破坏作用[10],并且在本实验中,单独使用Tat-SmacN7多肽对肿瘤细胞的抑制作用也不是很强,这和国外多篇文献的报道一致[3-4]。Tat-SmacN7联合照射后,对细胞的抑制作用明显增加,24 h的抑制率为(27.36±2.08)%,48 h的抑制率为(37.63±2.03)%,明显高于照射组[抑制率分别为(14.24±1.00)%和(18.35±1.92)%],表明Tat-SmacN7的高表达使EC109细胞对放射的敏感性增高。这与国外报道的将Smac转染人肿瘤细胞,使其过表达,可以大大增强肿瘤细胞对化疗以及放疗的敏感性结果一致[11-12]。这一结果为提高食管癌患者化疗敏感性、降低不良反应提供了新的思路。同时也为进一步研究Smac基因在食管癌细胞体内外生长活性以及食管癌凋亡调控中的作用奠定了实验基础。
Tat-SmacN7蛋白对食管癌109细胞辐射敏感性的影响
The effects of Tat-SmacN7 protein on radiosensitivity of esophageal carcinoma l09
-
摘要:
目的 探讨Tat-SmacN7蛋白(其中,Tat:反式激活蛋白;Smac:第二线粒体来源的caspase激活因子;N7:Smac的N端含有Ala-Val-Pro-Ile的七肽)对食管癌109(EC109)细胞放疗敏感性的影响。 方法 对EC109细胞给予Tat-SamcN7、照射、以及联合处理,观察不同处理在24 h和48 h时对细胞的抑制作用,采用Western blot检测各组细胞中Smac蛋白表达水平。 结果 通过水溶性四唑盐1检测发现Tat-SmacN7单独使用对细胞的抑制作用不明显,但与Tat-SmacN7组和照射组相比,Tat-SmacN7联合放射组可以明显增强对细胞的抑制(24 h:t=16.821和9.825,P < 0.05;48 h:t=23.553和11.930,P < 0.05)。说明Tat-SmacN7能增强EC109细胞对放射的敏感性。Western blot证明了Tat-SmacN7可以使细胞内Smac蛋白表达增加。 结论 Tat-SmacN7蛋白能通过细胞高表达Smac,增强EC109细胞对辐射的敏感性。 Abstract:Objective To investigate the effects of Tat-SmacN7 protein on sensitivity of esophageal carcinoma 109(EC109) to radiation. Methods Cells were treated with Tat-SmacN7 peptides, radiation or combination, the inhibition rate of EC109 cells were detected by water-soluble tetrazolium salt-1 assay. The protein level expression of Smac was determined by Western blot. Results The cells were resistant to Tat-SmacN7 as a single agent, but it could improve the sensitization of EC109 to radiation. Compared with the Tat-SamcN7 group and the radiation group, the Tat-SmacN7 combined with radiation group was inhibited significantly(24 h:t=16.821 and 9.825, both P < 0.05; 48 h:t=23.553 and 11.930, both P < 0.05). Western blot assay showed that Tat-SmacN7 could increase the expression of Smac protein. Conclusions Tat-SmacN7 could improve the radiosensitization of EC109 cell by increasing the expression of Smac. -
[1] Du C, Fang M, Li Y, et al. Smac, a mitochondrial protein that promotes cytochrome c-dependent caspase activation by eliminating IAP inhibition. Cell, 2000, 102(1):33-42. [2] Eschenburg G, Eggert A, Schramm A, et al. Smac mimetic LBW242 sensitizes XIAP-overexpressing neuroblastoma cells for TNF-α-independent apoptosis. Cancer Res, 2012, 72(10):2645-2656. doi: 10.1158/0008-5472.CAN-11-4072 [3] Yang J, McEachern D, Li W, et al. Radiosensitization of head and neck squamous cell carcinoma by a SMAC-mimetic compound, SM-164, requires activation of caspases. Mol Cancer Ther, 2011, 10(4):658-669. [4] Yang D, Zhao Y, Li AY, et al. Smac-mimetic compound SM-164 induces radiosensitization in breast cancer cells through activation of caspases and induction of apoptosis. Breast Cancer Res Treat, 2012, 133(1):189-199. [5] Yang L, Mashima T, Sato S, et al. Predominant suppression of apoptosome by inhibitor of apoptosis protein in non-small cell lung cancer H460 cells:therapeutic effect of a novel polyarginine-conjugated Smac peptide. Cancer Res, 2003, 63(4):831-837. [6] Fandy TE, Shankar S, Srivastava RK. Smac/DIABLO enhances the therapeutic potential of chemotherapeutic drugs and irradiation, and sensitizes TRAIL-resistant breast cancer cells. Mol Cancer, 2008, 7:60. doi: 10.1186/1476-4598-7-60 [7] Deng Y, Lin Y, Wu X. TRAIL-induced apoptosis requires Bax-dependent mitochondrial release of Smac/DIABLO. Genes Dev, 2002, 16(1):33-45. [8] Zhang XD, Zhang XY, Gray CP, et al. Tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis of human melanoma is regulated by smac/DIABLO release from mitochondria. Cancer Res, 2001, 61(19):7339-7348. [9] Chen F, Xu C, Du L, et al. Tat-SmacN7 induces radiosensitization in cancer cells through activation of caspases and inducti Tat-SmacN7 induces radiosensitization in cancer cells through the activation of caspases and induction of apoptosis. Int J Oncol, 2013, 42(3):985-992. [10] Verhagen AM, Ekert PG, Pakusch M, et al. Identification of DIABLO, a mammalian protein that promotes apoptosis by binding to and antagonizing IAP proteins. Cell, 2000, 102(1):43-53. [11] Ogura A, Watanabe Y, Iizuka D, et al. Radiation-induced apoptosis of tumor cells is facilitated by inhibition of the interaction between Survivin and Smac/DIABLO. Cancer Lett, 2008, 259(1):71-81. [12] Pluta A, Wrzesien-Kus A, Cebula-Obrzut B, et al. Influence of high expression of Smac/DIABLO protein on the clinical outcome in acute myeloid leukemia patients. Leuk Res, 2010, 34(10):1308-1313. doi: 10.1016/j.leukres.2009.11.030 -






 下载:
下载: