-
聚酰胺-胺(polyamidoamine, PAMAM)型树枝状高分子纳米材料是以乙二胺为核,与丙烯酸甲酯通过麦克尔加成反应制备的支化大分子,以-CH2CH2-CONHCH2CH2N-为重复单元可以得到不同代数的PAMAM[1-2]。不同代数的PAMAM具有不同的几何尺寸和分子质量,与生物体内的生物大分子大小相当,有人称之为“人工蛋白”(artificial protein)[3]。随着树枝状聚合物代数的升高,其末端官能团数目成倍增加,并交替转化。因其大量的末端活性基团和可控的结构,自合成以来即在催化材料、生物医用材料、废水处理等领域得到广泛的应用,近年来,将PAMAM应用于药物载体[4-5]及非病毒基因载体[6]的报道大量出现。
虽然PAMAM作为药物载体具有很多优势,但是,作为一类新的纳米材料,PAMAM在体内的分布及代谢特性是否满足临床使用要求的研究却很少。本研究通过对PAMAM进行125I标记来研究其在小鼠体内的分布代谢规律,探讨PAMAM作为药物载体的可行性。
-
体质量为(20±2)g的雄性C57BL/6纯系小鼠由中国医学科学院血液病研究所提供;4代PAMAM和羟基琥珀酰亚胺购自美国Sigma公司;Na125I(125I,放射性比活度为12.95 GBq/ml,无载体)购自美国PE公司;氯胺-T、偏重亚硫酸钠和酪氨酸购自北京鼎国昌盛生物技术有限公司;Kodak In-Vivo Imaging System FX小动物活体成像仪为Care-stream Health公司产品;SN-6100全自动放射免疫γ计数器为上海核所日环光电仪器有限公司产品;AR-2000薄层扫描仪为美国Bioscan公司产品。
-
称取25 mg酪氨酸溶于8 ml水和2 ml二甲基甲酰胺的混合溶剂中,加入32 mg羟基琥珀酰亚胺,调节pH至5左右,冰水浴中加入64 mg二氯乙烷,反应4 h,之后在溶液中加入200 mg PAMAM,室温反应24 h。反应液在纯水中通过截留相对分子质量为3500的透析袋透析,反复换水,透析2 d后进行冷冻干燥,对产物PAMAM-酪氨酸行磁共振氢谱法检测。
-
PAMAM的标记采用氯胺-T法,在50 μl pH 7.2、50 mmol磷酸盐缓冲液中加入200 μg PAMAM-酪氨酸,完全溶解后加入1.85×107 Bq Na125I和50 μl氯胺-T(1 g/L)液,室温震荡反应5 min,再加入50 μl(0.2 g/L)偏重亚硫酸钠溶液终止反应。取1 μl反应液点至硅胶板上,以体积比为V乙醇:V水=9:1的溶液为展开剂,采用放射性薄层扫描仪对薄层板进行扫描,计算标记率。剩余反应液加入截留相对分子质量为3500的透析袋中透析纯化,开始用水作为透析液,1 d后换成磷酸盐缓冲液,直至透析液中检测不到放射性计数为止。取2 μl纯化后的溶液进行薄板层析及薄层扫描,测定标记化合物的放化纯度。
-
取50 μl纯化后的125I-PAMAM,加入到200 μl人新鲜血清中,置于37 ℃培养箱中孵育12、24、48、72 h,取样并采用1.2.2节中的方法测定其放化纯度。
-
选用4~6周龄、体质量约20 g的雄性C57BL/6纯系小鼠,将125I-PAMAM按1.85×104 Bq /g体质量剂量通过尾静脉注射入小鼠体内,注射后1、4、8、24、48 h将小鼠麻醉,用小动物活体成像系统进行γ成像。
-
取15只C57BL/6纯系小鼠并随机分为5组,每组3只,将125I-PAMAM按1.85×104 Bq /g体质量剂量通过尾静脉注射入小鼠体内,注射后1、4、8、24、48 h眼球取血后脱颈处死,分别取心、肝、脾、肺、肾、胃、脑、大肠、小肠、甲状腺及睾丸,称重后利用γ计数仪检测各组织的放射性,计算各组织的放射性摄取率。
-
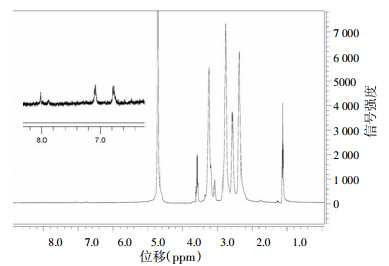
对合成的PAMAM-酪氨酸进行磁共振氢谱法检测,结果如图 1所示,在δ6.8 ppm和δ7.1 ppm处出现了明显的峰,此处为酪氨酸的特征峰,表明酪氨酸已成功连接到PAMAM上。而δ2.24 ppm处的峰是PAMAM中-CH2C(O)-的H的峰,共有248个,因此,可以通过两个峰的积分比值计算出平均每个PAMAM连接了约2个酪氨酸分子。
-
对125I-PAMAM进行薄层层析,在V乙醇:V水=9:1的展开剂中,125I的比移值约为0.7,而125I-PAMAM的比移值约为0.1,可以很好地将两者进行分离。薄层扫描仪检测的标记率为56%,透析纯化后的放化纯度>98%。将标记化合物在模拟体内环境中进行稳定性检测,在人血清37 ℃条件下孵育,由图 2所示可见,放置72 h后放化纯度仍然在90%以上,表明标记化合物在体外具有良好的稳定性,能满足后续动物实验的要求。
-
小鼠尾静脉注射125I-PAMAM后5个时间点的成像结果显示,尾静脉注射1 h后125I-PAMAM很快就集中至肝、胃、肾和脾所在的部位,而其他部位基本无放射性信号。因仪器无法进行三维扫描成像,肝的位置与胃、脾和肾基本重合,所以无法判断125I-PAMAM具体分布在哪个组织,因此需要分离各个组织来进一步确定其在每个组织中的具体分布。随着时间的延长,成像的结果基本一致,而且放射性信号衰减得很慢,48 h时仍能检测到非常强的放射性信号。图 3给出了注射后8 h的成像结果,其他时间点的成像结果基本类似。
-
125I-PAMAM在小鼠体内的分布结果见图 4,可以看出125I-PAMAM在注射后1 h即迅速地被肝、肾和脾吸收。125I-PAMAM分布最高的组织是肝,肝中的分布在4 h时最高,随后逐渐降低,在48 h时约代谢至最大摄取率的1/3;其次分布较高的为肾,前8 h的分布基本一致,随后逐渐降低,48 h时约代谢至最大摄取率的1/4;脾中的分布也较高,48 h时约代谢至最大摄取率的4/5;血液中的分布始终保持在较低的水平。
-
癌症已成为危害人类健康的最严重疾病,全球每年死亡人数接近800万,目前,化疗是肿瘤治疗中最主要的手段,但由于化疗药物的全身分布和对肿瘤细胞无特异选择性的缺点,使用化疗药物会产生较大的不良反应,而且易产生耐药性。为解决这一缺点,研究人员开始研发各种不同的药物靶向载体,希望能够将药物特定地输送至肿瘤部位,以起到提高局部药物浓度、提高疗效和降低不良反应的目的[7-8]。PAMAM因其独特的结构和可控的合成等优点而广受关注,有大量的将其作为药物载体的研究报道[4-5]。
药物载体除具有适合药物连接,载药量大等特点外,还应具有在体内循环时间长、除病变组织外不在其他组织大量蓄积或蓄积后能够较快代谢,以减少引起体内不良反应的可能性[9]。本研究结果表明,PAMAM在体内代谢缓慢,在肝、肾和脾组织中有较高的蓄积,而且从组织中清除缓慢,尤其在脾中,在检测的48 h内只清除了约20%的药物,如此缓慢的清除速度在临床上较难进行连续给药,因为连续给药会造成更大量的蓄积,PAMAM长时间蓄积在特定组织中是否会给组织带来不良反应需进一步观察。肿瘤组织的血管发达,需要比其他正常组织更大量的血液供应来维持其快速生长,因此血液中含量较高的药物可以更多的被肿瘤组织吸收,从而达到更好的肿瘤治疗效果,而血液中PAMAM的含量非常低,所以很难通过PAMAM来实现药物被动吸收入肿瘤的目的[10]。
鉴于PAMAM会在体内产生肝、肾和脾蓄积,而且代谢缓慢,血液中含量低等分布特点,说明其并不适合作为长期给药的药物载体,需要对其进行化学修饰以减少在肝、肾和脾中的蓄积,提高血液中的含量才更适合作为药物载体来使用。
125I标记聚酰胺-胺及其在小鼠体内的生物分布
Labeling of polyamidoamine with 125I and its biodistribution in mice
-
摘要:
目的 研究125I标记的树枝状高分子纳米材料聚酰胺-胺(PAMAM)在小鼠体内的生物分布。 方法 通过羟基琥珀酰亚胺将酪氨酸连接到4代PAMAM上,再对PAMAM进行125I标记,透析法对标记化合物进行纯化,放射性薄层扫描对标记物进行标记率、放化纯度及稳定性检测。将125I-PAMAM经尾静脉注射入小鼠体内,分别在1、4、8、24、48 h时对小鼠进行活体成像,并取主要脏器进行放射性计数。 结果 磁共振氢谱法检测结果显示,每个PAMAM分子上约连接了两个酪氨酸分子,标记率约为56%,放化纯度>98%,标记化合物具有良好的稳定性,体外放置72 h放化纯度仍>90%。小动物活体成像结果显示,PAMAM主要聚集在肝脏部位。各组织的放射性计数与显像结果基本一致,主要分布在肝、肾和脾中,而且体内代谢较慢,48 h时在小鼠体内仍有较高分布。 结论 未经修饰的PAMAM在肝、肾及脾中大量聚集,体内代谢缓慢,不适合直接作为药物载体进行使用,需进行化学修饰来加速体内代谢,防止体内蓄积从而引起不良反应。 Abstract:Objective To investigate the biodistribution of 125I labeled dendrimer nanomaterial—polyamidoamine (PAMAM) in mice. Methods Tyrosine was conjugated to four generation PAMAM by N-Hydroxysuccinimide, then 125I was labeled on PAMAM with chloramines-T method, and purified by dialysis. Labeling rate, radiochemical purity and stability of 125I-PAMAM were detected by radioactive thin layer chromatography scanning. The gamma imaging and biodistribution were detected by in vivo imaging system and gamma counter at one, four, eight, twenty-four and forty-eight hours after intravenous injection. Results The 1H nuclear magnetic resonance results showed that about two tyrosines were conjugated to PAMAM. The 125I labeling rate was about 56% and radiochemical purity was more than 98%. The radiochemical purity of labeled compound remained more than 90% at 72 hours in vitro. In vivo imaging results showed that PAMAM was mainly accumulated in liver periphery. The gamma counter results showed that PAMAM mainly accumulated in liver, kidney and spleen, the excretion of PAMAM was slow and there has high dose of PAMAM in mice at 48 hours. Conclusion PAMAM with no chemical modification was mainly accumulated in liver, kidney and spleen, and the excretion of PAMAM was slow, so PAMAM is not fit as drug carrier. PAMAM need to chemical modification to accelerate excretion and prevent the emergence of toxicity caused by accumulation in body. -
Key words:
- Iodine radioisotopes /
- Polyamidoamine /
- Body distribution
-
[1] Tomalia DA, Baker H, Dewald JR, et al. A new class of polymers: starburst-dendritic macromolecules. Polym J, 1985, 17(1): 117-132. doi: 10.1295/polymj.17.117 [2] Djeda R, Ruiz J, Astruc D, et al. "Click"synthesis and properties of carborane-appended large dendrimers. Inorg Chem, 2010, 49(22): 10702-10709. doi: 10.1021/ic101729s [3] Esfand R, Tomalia DA. Poly(amidoamine)(PAMAM) dendrimers: from biomimicry to drug delivery and biomedical applications. Drug Discov Today, 2001, 6(8): 427-436. doi: 10.1016/S1359-6446(01)01757-3 [4] Li Y, He H, Jia XR, et al. A dual-targeting nanocarrier based on poly(amidoamine) dendrimers conjugated with transferrin and tamoxifen for treating brain gliomas. Biomaterials, 2012, 33(15): 3899-3908. doi: 10.1016/j.biomaterials.2012.02.004 [5] Liu JF, Liu JJ, Chu LP, et al. Novel peptide-dendrimer conjugates as drug carriers for targeting nonsmall cell lung cancer. Int J Nanomedicine, 2010, 6: 59-69. [6] Zhu K, Guo C, Lai H, et al. Novel hyperbranched polyamidoamine nanoparticle based gene delivery: transfection, cytotoxicity and in vitro evaluation. Int J Pharm, 2012, 423(2): 378-383. [7] Sawyers C. Targeted cancer therapy. Nature, 2004, 432(7015): 294-297. doi: 10.1038/nature03095 [8] Basile L, Pignatello R, Passirani C. Active targeting strategies for anticancer drug nanocarriers. Curr Drug Deliv, 2012, 9(3): 255-268. doi: 10.2174/156720112800389089 [9] Holgado MA, Martin-Banderas L, Alvarez-Fuentes J, et al. Drug tar-geting to cancer by nanoparticles surface functionalized with spe-cial biomolecules. Curr Med Chem, 2012, 19(19): 3188-3195. doi: 10.2174/092986712800784720 [10] Maeda H. Nitroglycerin enhances vascular blood flow and drug delivery in hypoxic tumor tissues: analogy between angina pectoris and solid tumors and enhancement of the EPR effect. J Control Release, 2010, 142(3): 296-298. doi: 10.1016/j.jconrel.2010.01.002 -






 下载:
下载: