-
金属纳米材料是指纳米量级(10-9 m)的超微颗粒构成的金属固体物质[1]。纳米颗粒一般为球形或类球形,也有棒状结构,这主要是由于合成方法不同而导致纳米颗粒的形态不同。早在公元前四、五世纪就有对于胶体金的使用的记载。目前对于胶体金的报道主要是关于其在催化工艺和生物大分子中的电子转移中的应用以及利用细胞的内吞作用传输物质等方面[2-3]。金纳米颗粒(gold nanoparticles,GNPs)因其独特的光学、电学和磁学特性以及很好的生物相容性,已广泛用于生物传感器、分子和细胞成像、癌症的诊断和光热治疗以及药物的传输等研究中[4-13]。由于GNPs具有较强的表面等离子共振(surface plasmon resonance,SPR)的特性,使其有可能成为癌细胞成像中的新型造影剂。更重要的是,SPR随着颗粒尺寸的变化而变化,从而使GNPs具有特异性。例如,通过改变金纳米结构的尺寸和形状可以将SPR吸收带从可见光区域移至近红外区域,从而可用于体内成像和治疗。同时,2004年,美国科学家发现了GNPs的放射增敏作用[14]。与传统的块状金相比,GNPs具有更大的光电吸收截面及更强的光吸收和光散射能力,因此,GNPs有望作为一种新型的放射治疗增敏剂。总之,目前对于GNPs的研究越来越热,其制备及应用等方面的研究已成为近年来材料科学界研究的前沿课题。
合成GNPs的方法因原理不同而有所不同。较早合成GNPs的方法是由Turkevich等[15]在1951年提出的。虽然GNPs具有很好的表面化学和光学特性,但是其在高盐和某些生物分子(核酸、蛋白质等)存在的情况下易发生聚集和团聚,而改变表面化学特性是改善分散性和稳定性的关键和常用方法。巯基-聚乙二醇(sulfhydryl-polyethylene glycol,SH-PEG)中富含巯基和羟基,通过这两个基团和GNPs表面的强结合力将PEG与GNPs结合起来,从而提高GNPs的稳定性[16-17]。本研究通过SH-PEG修饰GNPs的表面,从而改进了GNPs的表面化学特性,制备得到了分散性较好的SH-PEG包裹的GNPs(即PEG-GNPs),这些结果对于进一步的放射增敏的研究非常重要。
-
氯金酸(分析纯)、硼氢化钠(分析纯)、柠檬酸三钠(分析纯)试剂均购自国药集团上海化学试剂有限公司;SH-PEG购自美国Sigma-Aldrich公司。
-
电子天平购自美国OHAUS公司;10~1000 μl移液枪购自德国Eppendorf AG公司;磁力搅拌器购自郑州长城科工贸有限公司;UV-1750型紫外可见分光光度计购自岛津仪器(苏州)有限公司;HT7700透射电子显微镜(transmission electron microscopic,TEM)购自日本日立公司;SIM-F120A制冰机购自日本三洋电机有限公司。
-
将1 g氯金酸在烧杯中用超纯水溶解,之后将溶液转移至1 L容量瓶中,洗涤烧杯3次,将溶液转移至容量瓶中,最后定容到1 L即可。
-
用天平称取1 g柠檬酸三钠,用1.3.1节的方法最后定容到100 ml即可。
-
用天平称取0.055 g硼氢化钠,用1.3.1节的方法最后定容到50 ml即可。
-
取3个50 ml圆底烧瓶,分别加入5 ml氯金酸溶液,用45 ml超纯水对其进行稀释,加热至沸腾,之后分别加入预热的1%的柠檬酸三钠溶液2.5、0.65、0.4 ml,再搅拌30 min,恢复至室温,则分别制得10、25、45 nm的GNPs。制备的GNPs放置4 ℃保存,以备使用。
-
取5 ml氯金酸溶液加入50 ml圆底烧瓶中,用45 ml超纯水对其进行稀释,加入1.5 ml 1%的柠檬酸三钠溶液,在冰浴搅拌的情况下加入1.5 ml冰浴处理的0.11%硼氢化钠溶液,再冰浴搅拌30 min,之后恢复至室温,即制得5 nm的GNPs。制备的GNPs放置4 ℃保存,以备使用。
-
将上述制备的4种不同尺寸的GNPs各取10 ml分别加入4个50 ml圆底烧瓶中,在搅拌的情况下加入5 mg SH-PEG,再搅拌1 h,即制得不同尺寸的PEG-GNPs。制备的GNPs放置4 ℃保存,以备使用。
-
用紫外可见分光光度计测定4种不同尺寸的GNPs和PEG-GNPs的紫外吸收光谱,其光谱测量范围为400~700 nm。
-
将制得的颗粒用无水乙醇分散,并用超声将其充分分散,然后用玻璃棒蘸取悬液滴在铜片上,在80 ℃干燥24 h,然后用TEM观察其尺寸。
-
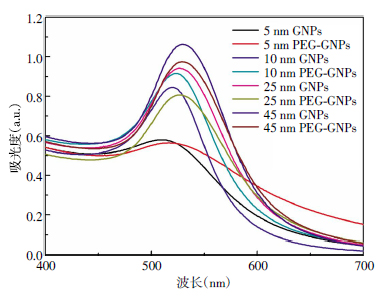
在制备GNPs的过程中,沸腾状态下,当柠檬酸三钠开始还原[AuCl]时,可以观察到氯金酸溶液的颜色随着时间的变化而变化。首先由黄色变为无色,接着由无色变为深蓝色、紫色,直至最后的酒红色。图 1为测得的GNPs和PEG-GNPs的紫外可见吸收光谱。
从图 1中可以看出,裸GNPs的SPR吸收峰位于510~530 nm,并且随着GNPs尺寸的增加,SPR吸收峰会向长波长方向移动。在加入PEG包裹层以后,不同尺寸的GNPs的SPR吸收峰红移3~5 nm,这说明包裹层对GNPs的光学特性造成了一定的影响。从图 1中还可以看出,PEG-GNPs的SPR吸收峰与GNPs相比,峰强也发生了不同程度的改变,这说明PEG包裹层退化了GNPs的等离子特性。同时还可以发现,随着柠檬酸三钠加入量的增加,合成的GNPs的尺寸会减小,这是因为随着柠檬酸三钠加入量的增加,Au被逐渐充分地还原。
为了研究GNPs的尺寸和形貌,我们使用了TEM研究GNPs。从图 2中可以得出,图 2a~2d中的GNPs的尺寸分别为5、10、25和45 nm,且GNPs的尺寸与紫外吸收谱中的一致。根据经典的Mie理论,当GNPs尺寸增加时,将伴随着SPR增加,这与紫外可见吸收光谱的结果一致。此外,从图 2中还可以看出GNPs的形状为球形或者椭球形。5 nm和45 nm的GNPs的单分散性最好,而10 nm和25 nm的GNPs的单分散性相对较差。另外,10 nm和25 nm的GNPs被大量的PEG包裹,而45 nm的GNPs表面的包裹层清晰可见(图 2d)。这说明PEG的包裹层已经成功地包裹在了GNPs表面。SH-PEG是一种有效的表面包裹层,能改进GNPs的表面化学特性。
-
Mie提出的光的散射理论,解释了由麦克斯韦电磁方程引出的球形颗粒的光相互作用的现象。当光子入射时,在特定波长范围内具有强的光吸收能力,即SPR,增强的光吸收可有效地增强肿瘤组织的吸收剂量。通过紫外可见分光光度计检测,在紫外可见光谱上显示强的吸收峰。SPR吸收峰的位置及光谱形状与纳米材料的形状及尺寸有关。随着纳米材料尺寸的增加,SPR吸收峰会向长波长方向移动。随着柠檬酸三钠加入量的增加,合成的GNPs的尺寸会减小。这是由于柠檬酸三钠是强碱弱酸盐,其水溶液的pH值约为8,加入的柠檬酸三钠越多,溶液的pH值越大,OH-就越多,从而与溶液中OH-结合成络合物的氯金酸就越多,所以与GNPs形成初期表面上包裹的柠檬酸三钠的OH-的氯金酸就会减少,使得反应过程中颗粒的聚集减少,制备的GNPs的尺寸减小。反之亦然。总之,加入的柠檬酸三钠越多,氯金酸被还原的就越充分,制得的GNPs的尺寸就会越小。对于制备5 nm的GNPs,要用更强的还原剂——硼氢化钠,通过还原氯金酸而制得。同时,GNPs的尺寸越大,SPR的波长就越大。
PEG是由环氧乙烷聚合而成的大分子聚合物,其系列产品具有无毒、无刺激性,良好的水溶性,并与许多有机物组分有良好的相容性等优点,同时还具有良好的润滑性、保湿性、分散性等,在化妆品、制药及食品加工等行业中均有着极为广泛的应用。由于巯基、氨基、羟基与金纳米表面具有较好的结合力[18],因此可以利用含有这些官能团的化合物对GNPs进行修饰,从而改善其分散性和生物相容性。SH-PEG中的末端巯基与金形成Au-S共价键[19],通过Au-S共价键将PEG的一端固定在GNPs表面,由于PEG另一末端具有强的亲水性,从而增加了GNPs的水溶性。由于GNPs具有SPR的特性,使其在500~550 nm间产生了强的吸收峰。但是吸收峰的峰位、峰强和峰宽受颗粒尺寸、聚集程度和表面修饰的影响。从图 2可以看出,由于PEG-GNPs复合物的形成,使得PEG修饰后的不同尺寸的纳米颗粒发生了不同程度的红移,同时峰强也发生了不同程度的改变。TEM研究表明,制备的GNPs在大多数情况下成球形,且颗粒的大小随着反应溶液中柠檬酸三钠加入量的减少而增大。
虽然GNPs有很多优点,如很好的表面化学特性、光学特性和良好的生物相容性,但是当GNPs进入血液后,首先与血液中的蛋白结合,结合后会对GNPs的稳定性产生一定的影响,甚至会使其在某些脏器中蓄积,产生毒性。有研究表明,尾静脉注射比灌胃和腹腔注射GNPs产生的毒性较小[20]。SH-PEG修饰可以提高GNPs的稳定性,对PEG-GNPs的毒性和生物学分布进行研究时发现,10 nm和60 nm的GNPs比5 nm和30 nm的GNPs有较大的毒性;同时,5 nm和10 nm的PEG-GNPs主要在肝脏蓄积,30 nm的PEG-GNPs主要在脾内蓄积,而60 nm的PEG-GNPs在更多的器官中有分布[21]。这些结论对癌症的治疗、药物传输和诊断是很有意义的。
巯基-聚乙二醇修饰的不同尺寸金纳米颗粒的制备和光学特性
The fabrication and option characteristics of polyethylene glycol-coated gold nanoparticles with differe
-
摘要:
目的 利用氯金酸和不同的还原剂(如柠檬酸三钠和硼氢化钠)制备不同尺寸的金纳米颗粒(GNPs),同时制备巯基-聚乙二醇(SH-PEG)修饰的PEG-GNPs。 方法 将氯金酸溶液加热至沸腾,之后加入不同量的柠檬酸三钠或硼氢化钠溶液,搅拌30 min即可制备不同尺寸的GNPs。之后加入一定量的SH-PEG,搅拌1 h,即可制备PEG-GNPs。利用紫外可见分光光度计和透射电子显微镜来观察GNPs和PEG-GNPs的光学特性和尺寸。 结果 利用1%的柠檬酸三钠溶液可以制备10、25、45 nm的GNPs,而用0.11%的硼氢化钠溶液可以制备5 nm的GNPs。通过加入一定量的SH-PEG,可以制备PEG-GNPs。将不同尺寸的GNPs和PEG-GNPs的紫外可见吸收谱相比,发现随着GNPs尺寸的增加,表面等离子共振峰会向长波长方向移动。 结论 通过调节氯金酸与柠檬酸三钠或硼氢化钠的比例,可以制备不同尺寸的GNPs。同时,颗粒尺寸越大,表面等离子共振峰红移的现象越明显。 Abstract:Objective To synthesize gold nanoparticles (GNPs) and polyethylene glycol-coated GNPs(PEG-GNPs)modified by sulfhydryl-polyethylene glycol(SH-PEG), chloroauric acid and different reductant agent, such as trisodium citrate and sodium borohydride were used. Methods Chloroauric acid solution was brought to a boil, and then different volume of trisodium citrate solution or sodium borohydride solution was added to the boiling solution. Then the mixture was boiled for a further 30 minutes. Subsequently some SH-PEG was mixed with the GNPs and stirred for 1 hour to fabricate the PEG-GNPs. The optical characteristic and size of GNPs and PEG-GNPs were observed by UV-Vis spectrophotometer and transmission electron microscopic respectively. Results 10, 25, and 45 nm GNPs were fabricated using 1% trisodium citrate, while the 5 nm GNPs were synthesized using 0.11% sodium borohydride. Meanwhile, SH-PEG was added to the GNPs and obtained the PEG-GNPs. Furthermore, when compared with the GNPs with different size, it can be found that the surface plasmon resonance (SPR) of GNPs have shift to long wavelength region with increasing particles size. The same phenomenon also can be found in the PEG-GNPs with different size. Conclusions The size of GNPs can be modulated by controlling the ratio between chloroauric acid and trisodium citrate or sodium borohydride. Meanwhile, the larger the size of GNPs is, the more significant of the shifting to the long wavelength of SPR is. -
Key words:
- Nanostructures /
- Gold /
- Polyethylene glycols /
- Microscopy /
- electron /
- transmission
-
[1] 白春礼.纳米科技及其发展前景.科学通报, 2001, 46(2): 89-92. doi: 10.3321/j.issn:0023-074X.2001.02.001
[2] Andreu EJ, Martin de Llano JJ, Moreno I, et al. A rapid procedure suitable to assess quantitatively the endocytosis of colloidal gold and its conjugates in cultured cells. J Histochem Cytochem, 1998, 46(10): 1199-1201. doi: 10.1177/002215549804601013 [3] Dykman L, Khlebtsov N. Gold nanoparticles in biomedical applications: recent advances and perspectives. Chem Soc Rev, 2012, 41(6): 2256-2282. doi: 10.1039/C1CS15166E [4] Griset AP, Walpole J, Liu R, et al. Expansile nanoparticles: synthesis, characterization, and in vivo efficacy of an acid-responsive polymeric drug delivery system. J Am Chem Soc, 2009, 131(7): 2469-2471. doi: 10.1021/ja807416t [5] Smith AM, Duan H, Mohs AM, et al. Bioconjugated quantum dots for in vivo molecular and cellular imaging. Adv Drug Deliv Rev, 2008, 60(11): 1226-1240. doi: 10.1016/j.addr.2008.03.015 [6] Mohamed MB, AbouZeid KM, Abdelsayed V, et al. Growth mechanism of anisotropic gold nanocrystals via microwave synthesis: formation of dioleamide by gold nanocatalysis. ACS Nano, 2010, 4(5): 2766-2772. doi: 10.1021/nn9016179 [7] Hu M, Chen J, Li ZY, et al. Gold nanostructures: engineering their plasmonic properties for biomedical applications. Chem Soc Rev, 2006, 35(11): 1084-1094. doi: 10.1039/b517615h [8] Anker JN, Hall WP, Lyandres O, et al. Biosensing with plasmonic nanosensors. Nat Mater, 2008, 7(6): 442-453. doi: 10.1038/nmat2162 [9] Sokolov K, Follen M, Aaron J, et al. Real-time vital optical imaging of precancer using anti-epidermal growth factor receptor antibodies conjugated to gold nanoparticles. Cancer Res, 2003, 63(9): 1999-2004. [10] Zhang XD, Wu D, Shen X, et al. In vivo renal clearance, biodistribution, toxicity of gold nanoclusters. Biomaterials, 2012, 33(18): 4628-4638. doi: 10.1016/j.biomaterials.2012.03.020 [11] Pissuwan D, Valenzuela SM, Cortie MB. Therapeutic possibilities of plasmonically heated gold nanoparticles. Trends Biotechnol, 2006, 24(2): 62-67. doi: 10.1016/j.tibtech.2005.12.004 [12] Zheng J, Zhang C, Dickson RM. Highly fluorescent, water-soluble, size-tunable gold quantum dots. Phys Rev Lett, 2004, 93(7): 1-4. [13] Huang X, El-Sayed IH, Qian W, et al. Cancer cell imaging and photothermal therapy in the near-infrared region by using gold nanorods. J Am Chem Soc, 2006, 128(6): 2115-2120. doi: 10.1021/ja057254a [14] Hainfeld JF, Slatkin DN, Smilowitz HM. The use of gold nanoparticles to enhance radiotherapy in mice. Phys Med Biol, 2004, 49(18): N309-315. doi: 10.1088/0031-9155/49/18/N03 [15] Turkevich J, Stevenson PC, Hillier J. A study of the nucleation and growth processes in the synthesis of colloidal gold. Discuss Faraday Soc, 1951, 11: 55-75. doi: 10.1039/df9511100055 [16] Mei BC, Susumu K, Medintz IL, et al. Polyethylene glycol-based bidentate ligands to enhance quantum dot and gold nanoparticle stability in biological media. Nat Protoc, 2009, 4(3): 412-423. doi: 10.1038/nprot.2008.243 [17] Fernandes R, Li M, Dujardin E, et al. Ligand-mediated self-assembly of polymer-enveloped gold nanoparticle chains and networks. Chem Commun, 2010, 46(40): 7602-7604. doi: 10.1039/c0cc03033c [18] Brewer SH, Glomm WR, Johnson MC, et al. Probing BSA binding to citrate-coated gold nanoparticles and surfaces. Langmuir, 2005, 21(20): 9303-9307. doi: 10.1021/la050588t [19] Gao J, Huang X, Liu H, et al. Colloidal stability of gold nanoparticles modified with thiol compounds: bioconjugation and application in cancer cell imaging. Langmuir, 2012, 28(9): 4464-4471. doi: 10.1021/la204289k [20] Zhang XD, Wu HY, Wu D, et al. Toxicologic effects of gold nanoparticles in vivo by different administration routes. Int J Nanomedicine, 2010, 5: 771-781. [21] Zhang XD, Wu D, Shen X, et al. Size-dependent in vivo toxicity of PEG-coated gold nanoparticles. Int J Nanomedicine, 2011, 6: 2071-2081. -






 下载:
下载: